天然绿色蚕丝抗氧化组分向皮肤迁移的特性研究
2023-12-05李哲阳马明波周文龙
谭 婷, 李哲阳, 马明波, 周文龙
(浙江理工大学 纺织科学与工程学院(国际丝绸学院), 浙江 杭州 310018)
我国有着丰富的天然彩色蚕丝资源,野蚕如天蚕、樟蚕、琥珀蚕等均可吐出颜色鲜艳的彩色丝,但由于养殖条件苛刻、产量低等原因,这些天然彩色蚕丝并未得到有效利用。少数家蚕种也携带有相关基因,能吐出金黄、黄、粉、绿等颜色的丝[1-2]。目前,浙江大学、苏州大学及西南大学等机构已培育出多个性状稳定、覆盖主要色系(包括金黄、粉色、绿色 3个品系)的新品种[3],并获得了产业化应用。
天然彩色蚕丝有着与普通家蚕丝相似的形态结构、力学性能与化学成分[3-4]。主要差异在于:天然彩色蚕丝非蛋白附生物含量较高,是普通白色茧丝的1.2~1.9倍, 包括色素以及其它众多生物质[1-2,5]。这些附生物赋予了天然彩色蚕丝颜色及优异的功能性,如紫外线防护性能、抗菌及抗氧化性能[1,5-6]。尤其是天然彩色蚕丝绿色品种(本文简称为天然绿色蚕丝),其抗菌活性高达99%,抗氧化活性更是普通白色茧丝的12~24倍[6]。这表明天然彩色蚕丝不仅是一种不需要染色的“绿色”环保纤维,更是一种优良的天然功能纤维,在卫生保健纺织品领域有较大的应用价值。天然彩色蚕丝的耐水洗和耐日晒牢度较差[4],目前主要用于蚕丝被和床上用品的开发,而其功能性远未被充分发掘和利用。
人体皮肤的老化和许多皮肤疾病的发生与其组织的过氧化密切相关,使用外源性抗氧化剂是缓解皮肤组织过氧化的有效手段之一,日常生活中人们使用含维生素C或E、超氧化物歧化酶(SOD)、葡萄籽提取物等抗氧化剂的护肤品便是典型的例子。近年来,将抗氧化剂微胶囊化并整理到纺织品上成为了研究热点[7-8]。抗氧化纺织品(也称美容纺织品)不仅获得了商业化应用,还用于临床实验治疗某些皮肤病[9]。天然绿色蚕丝纤维中含有较高含量的天然抗氧化剂黄酮类化合物,这使得其作为一种天然抗氧化纤维具有潜在的应用价值。本文利用经皮渗透实验评估了天然绿色蚕丝抗氧化组分向皮肤迁移的特性、影响因素及量效关系,以期为开发天然彩色蚕丝抗氧化功能纺织品奠定理论基础。
1 实验部分
1.1 材料与仪器
材料:天然绿色蚕丝非织造布(厚度为1 mm,面密度为203 g/m2),利用浙江大学动物学院培育的秋风系列彩色品种在实验室标准条件下喂食新鲜桑叶至吐丝前,然后将蚕放置在平板上吐丝获得。新鲜猪皮,购置于杭州下沙京西菜市场,所有猪皮均为猪肚两侧皮肤,厚度基本一致,皮层经过轻微刮皮处理,并去除皮下脂肪。Scotch 810型胶带,美国3M公司生产。
试剂:2,2-联苯基-1-苦基肼基(DPPH)、芦丁、硫酸庆大霉素、福林酚、咖啡酸,均为分析纯,购于麦克林试剂有限公司;乙醇(分析纯)、甲醇(色谱纯),购于杭州米克化工有限公司。
仪器:LC-100型高效液相色谱仪,上海伍丰色谱仪器有限公司生产;TU-1950型紫外-可见分光光度计,北京普析通用仪器有限公司生产。
1.2 实验方法
1.2.1 猪皮经皮渗透实验
利用经皮渗透研究领域常用的Franz扩散池装置进行实验,流程如下:将猪皮皮下脂肪层剥除,并裁剪成面积为4.91 cm2、厚度约为2 mm的圆形切片,放入扩散池装置中。扩散池由上部供体池和下部接收池组成,非织造布样品放在猪皮上,面向供体池放置,猪皮皮下组织面向下部接收池,如图1所示。
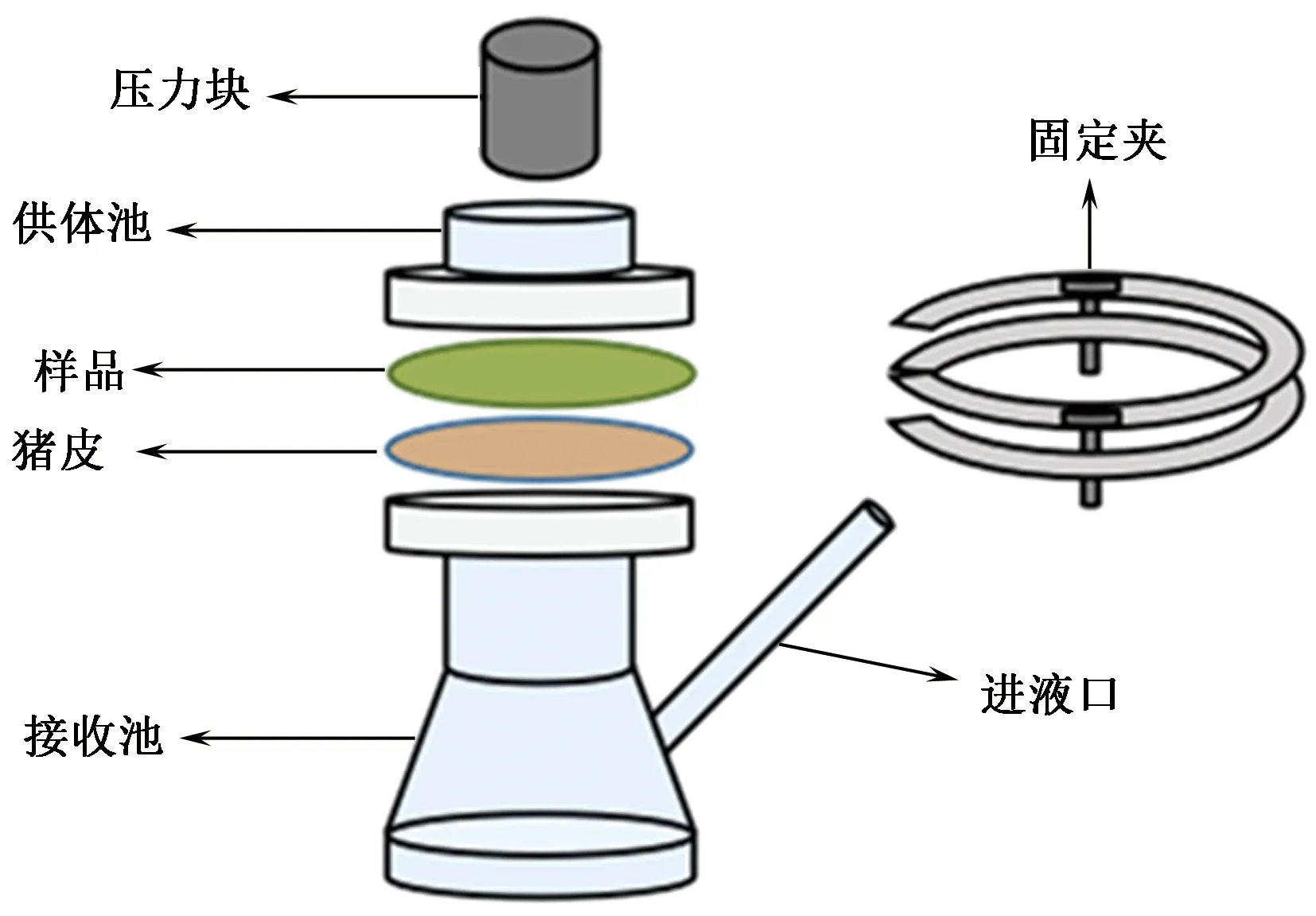
图1 经皮渗透实验装置的结构示意图Fig.1 Scheme of transdermal permeation device
通过扩散池的侧向口向接收池输入10 mL含0.4 mg/mL抗菌剂硫酸庆大霉素的生理盐水,即接收液。取若干猪皮圆片,其中不放置样品的1组作为空白对照组,另外3组猪皮上对齐放置面积为4.91 cm2、质量为0.100 g的样品圆片,放置前按样品与水质量比为1∶0、1∶5和1∶10向猪皮表面均匀滴加蒸馏水,分别模拟皮肤干态、微出汗和大量出汗的皮肤环境。依据GB/T 14576—2009《纺织品 色牢度试验 耐光、汗复合色牢度》制备碱性汗液和酸性汗液,以织物与汗液质量比为1∶5滴加相应汗液产生碱性及酸性皮肤环境。贴上样品后在其上放置10 g的石英压力块使之与猪皮充分贴合。最后将装置接收池放入37 ℃水浴中一定时间。实验结束后取出猪皮,用胶带黏取角质层,使用新胶带重复该过程8次后合并,获得猪皮的角质层。将胶带与剩下的真皮层剪碎后分别加入5 mL的30%乙醇溶液,于常温下超声波(频率为23 kHz,功率为200 W)提取60 min,过滤提取液,获得皮肤组织中的天然绿色蚕丝抗氧化成分。所有猪皮经皮渗透实验均重复 3次, 取平均值。
1.2.2 人体皮肤经皮渗透实验
招募6名年龄为23~25岁的女性志愿者参与本实验,实验地点为杭州,时间为10月中旬。将蚕丝非织造布裁剪为4 cm×4 cm的方块,然后添加0.2 mL蒸馏水至受试者手臂内侧(离手腕约15 cm), 皮肤润湿面积与样品大小一致,待皮肤无明显水滴后,将样品敷贴于皮肤上并用绷带固定。接触24 h后用胶带将测试区的角质层剥离,重复 8次后收集8条胶带。将胶带加入5 mL的30%乙醇溶液中超声波提取60 min,过滤提取液,待测。
1.2.3 高效液相色谱测试
利用高效液相色谱仪对天然绿色蚕丝的纯水提取物及以上皮肤组织的提取物进行分析。色谱条件:Sharpsil-U C18 (4.6 nm×250 nm,5 μm)色谱柱,柱温为30 ℃,检测波长为280 nm,流动相为甲醇(A)和体积分数为0.3%的乙酸水溶液(B),流速为1.0 mL/min,进样量为20 μL,采用梯度洗脱方法(0~10 min, (10%~60%)A;10~26 min,(60%~100%)A;100%A条件下保持2 min)。
1.2.4 总酚含量测试
采用福林酚法[10]对各皮层中的抗氧化提取物进行定量测试。将0.5 mL提取液置于反应瓶中,加入0.5 mL浓度为0.25 mol/L的福林酚试剂,混合均匀后静置3 min,再加入1 mL质量分数为15%的Na2CO3溶液,显色反应30 min,然后离心,取上清液。以同浓度 Na2CO3溶液为空白对照,测试其在 740 nm 处的吸光度。配制7种不同质量浓度(1.0~15.0 μg/mL)的多酚标准物质——芦丁溶液代替抗氧化提取物重复以上步骤,获得芦丁质量浓度Y与显色反应液吸光度X的线性回归方程,用于总酚定量分析,回归方程为Y=0.037 5X+0.038 3,相关系数R2为0.990 3。
1.2.5 抗氧化活性测试
利用DPPH自由基清除法[6]评价迁移实验后各猪皮组织的抗氧化活性。取1 mL上述提取液加入到0.5 mL浓度为0.06 mmol/L DPPH·溶液中,避光反应1 h后测其532 nm处的吸光度,记为A1。空白对照组为1 mL蒸馏水加入到0.5 mL DPPH·溶液后的混合液,同样静置1 h后测得吸光度,记为A0。根据下式计算提取液对DPPH·的清除率:
2 结果与分析
2.1 皮肤环境的影响
猪皮类似人体皮肤,由表皮层和真皮层组成,2层之间无天然的界限。角质层为皮肤的最外层,是皮肤的重要组成部分。自由基处于皮肤真皮层,因此抗氧化剂需渗入真皮层才能发挥作用[8-9]。图2 和表1分别示出经皮渗透后各皮层抗氧化物提取物的液相色谱图和多酚含量。经过24 h接触,皮肤角质层和真皮层均检测到了多酚的存在,而空白对照组皮肤未检测到。各抗氧化组分的迁移量之间也存在差异,亲水性较强的成分(保留时间为2~5 min)相对容易迁移至皮层中,因而这部分抗氧化组分在皮层中的含量相对较高。而亲水性较弱的抗氧化组分(保留时间为10~25 min)虽然在纤维中的含量远高于亲水性较强的组分,但是其向各皮层迁移的量相对较少,这是由于皮肤组织液是水性性质的。

表1 24 h后天然绿色蚕丝向皮肤各层渗透的多酚含量及其占纤维总酚含量的百分率Tab.1 Content and percentage of polyphenols permeated to skin from naturally green-colored silk after 24 h

图2 天然绿色蚕丝及皮层抗氧化物提取物的液相色谱图Fig.2 Chromatograms of antioxidant extracts of naturally green-colored silk and skin layers. (a) Fiber;(b) Stratum corneum;(c) Dermis;(d) Blank
另外,也并非所有抗氧化组分都能迁移至各皮层中。例如:保留时间为14 min的组分既不能迁移至真皮层也不能进入角质层;保留时间为22和 23 min 的组分能迁移至角质层,但不能进入真皮层。
皮肤湿度环境对纤维中抗氧化成分的迁移量影响很大。如表1所示,干态下的皮肤多酚含量仅为(3.8±2.0) μg/cm2, 约占纤维中总酚含量的3.6%,其中角质层和真皮层中的多酚占比相近。湿态下的皮肤多酚迁移率显著增加,在类似于皮肤微出汗的湿度条件下,皮肤中多酚含量达到(11.7±2.9) μg/cm2, 约占纤维中总酚含量的11.0%。其中,真皮层中的多酚含量约为角质层中的3.2倍。这说明在较长时间的接触后,纤维中的抗氧化组分能迁移深入至皮肤真皮层中。
天然绿色蚕丝的抗氧化成分黄酮类是具有中等极性至极性的一类多酚化合物,具有一定的水溶性[10-11]。这也是其迁移量与皮肤的湿润环境密切相关的根本原因。在更高的皮肤湿度时,多酚迁移量反而略有下降,这可能是因为表皮的液体过多,液体连同溶解在其中的抗氧化成分不能全部被皮肤吸收,反而被样品吸收回去。值得说明的是,在接收池中并未检测到多酚的存在,这说明纤维中的抗氧化成分只是迁移到了皮层中,并未穿透整个皮层。
考虑到人的皮肤环境具有一定的酸碱性,而多酚类物质的溶解性及其抗氧化活性与所处环境的pH值相关,因此评估了酸性及碱性皮肤环境对天然绿色蚕丝抗氧化组分迁移性质及抗氧化活性的影响,结果如图3所示。可以看出,碱性皮肤环境下接触24 h后,角质层和真皮层中的抗氧化组分的含量与中性皮肤环境下相似(见表1),但其抗氧化活性较中性皮肤环境下稍差。这与多酚的结构及其抗氧化活性的构效关系有关:在碱性条件下,酚羟基离解,多酚与自由基的反应活性下降[11];而酸性皮肤环境下,角质层和真皮层中的多酚含量分别是2.9和10.5 μg/cm2。其角质层的多酚含量与中性皮肤环境下情况类似,但真皮层中的含量要明显高于中性皮肤环境的迁移量(8.9 μg/cm2),可能是因为多酚在酸性皮肤中渗透性较好。得益于酸性皮肤中抗氧化组分的含量较高,其皮肤的抗氧化能力也更好。
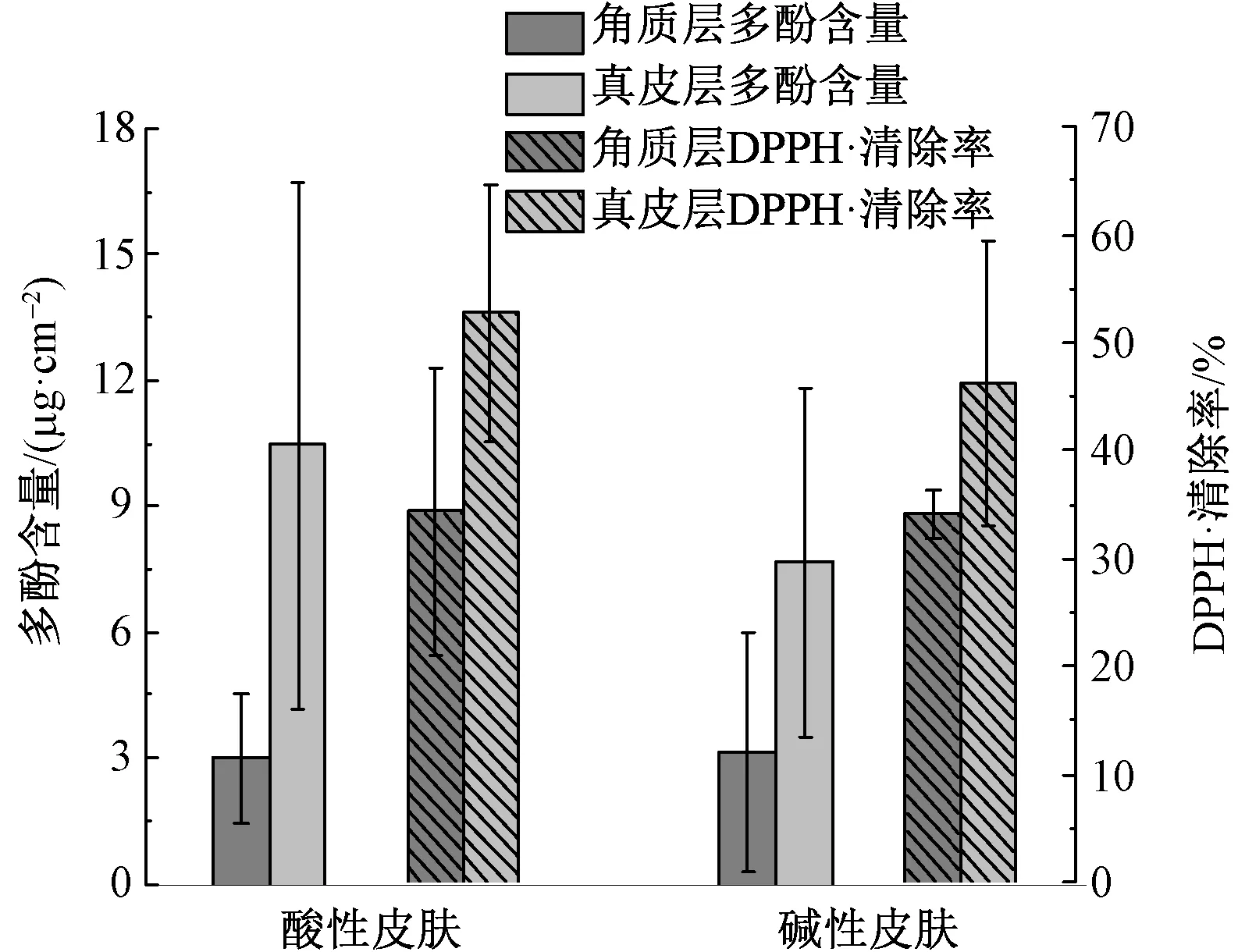
图3 酸碱性皮肤环境对多酚含量及抗氧化活性的影响Fig.3 Effects of alkaline and acidic skin condition on content and antioxidant activity of polyphenols
2.2 接触时间的影响及抗氧化剂量效应
天然绿色蚕丝抗氧化成分向皮肤的迁移量表现出时间依赖性,且在皮肤各层的分布也与时间有关。图4(a)示出在样品与水质量比为1∶5条件下不同时刻皮肤中的多酚含量。在24 h内,各皮层中的多酚含量几乎呈线性增加。24 h后,其迁移量仍在增加,但增加速率有所减缓。以类似于夏季穿着、皮肤微出汗的环境估算,第1次穿着天然绿色蚕丝织物12 h,其大约能向皮肤迁移5 μg/cm2的抗氧化组分。前12 h,抗氧化组分在角质层中的分布比其在真皮层中多;而12 h后,其真皮层中的含量逐渐超过角质层,且含量差随接触时间的延长越来越大。这说明天然绿色蚕丝的抗氧化组分会逐渐透过角质层向真皮层迁移,且会在真皮层中累积。

图4 接触时间对皮肤中多酚含量及其抗氧化活性的影响Fig.4 Effects of contact time on content(a) and antioxidant activity(b) of polyphenols in skin
为评估迁移至皮层中的天然绿色蚕丝抗氧化组分的实际活性,对提取自各皮层中的成分进行了自由基清除能力测试,结果如图4(b)所示。由于皮肤中残存一些内源性抗氧化组分,如超氧化物歧化酶和过氧化氢酶等,空白对照皮肤显示出了微小的抗氧化活性,其角质层和真皮层对0.03 μmol DPPH·的清除率分别为9.7%和16.5%。随着接触时间和皮肤组织中抗氧化组分的增加,皮肤的抗氧化活性显著增加。接触12 h后,皮肤角质层和真皮层对DPPH·的清除率分别达到了24.2%和45.6%;接触24 h后,其清除率进一步增加到了37.8%和62.8%。由此可见,与天然绿色蚕丝接触后皮肤的抗氧化能力得到了显著增强,其抗氧化能力与抗氧化成分的迁移量呈正相关性。
2.3 人体皮肤经皮渗透实验结果分析
为明晰服用过程中天然绿色蚕丝抗氧化组分向皮肤迁移的情况及量效关系,对6位志愿者进行了皮肤接触实验,其皮肤中的多酚含量及抗氧化活性结果如图5所示。
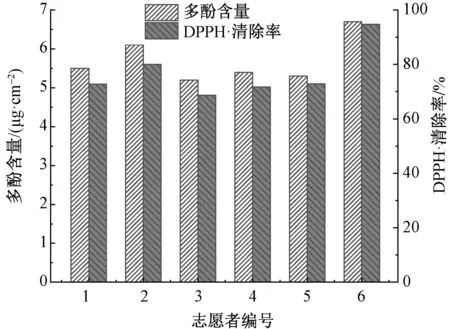
图5 从志愿者皮肤角质层中检测到的多酚含量及其抗氧化活性Fig.5 Content and antioxidant activity of polyphenols in stratum corneum of volunteers′ skin
从图5可看出,志愿者皮肤接触样品24 h后,其皮肤角质层中检测到的多酚含量范围为5.1~6.6 μg/cm2, 平均值为(5.7±0.5)μg/cm2。可见,同样的接触时间和接触面积条件下,天然绿色蚕丝向人体皮肤角质层迁移的抗氧化组分的含量显著高于猪皮角质层((2.8±1.9 )μg/cm2)。这可能是因为人体皮肤与样品之间的相对摩擦有助于抗氧化组分的迁移,且人体皮肤相对较高的温度及组织液的流动性也有利于抗氧化组分经皮渗透。
得益于拥有较高含量的抗氧化组分,各志愿者皮肤角质层对自由基的平均清除率高达(76.7±8.2)%,显著高于同条件猪皮实验组角质层 ((37.8±3.7)%)。这预示着纤维中的抗氧化组分能迁移至人体皮肤中,并赋予皮肤优异的抗氧化能力。
3 结 论
1)天然绿色蚕丝中的抗氧化组分能迁移到猪皮角质层和真皮层中,与人体皮肤实验结果相互印证。相同条件下,抗氧化组分向人体皮肤迁移得更多。皮肤微湿环境下,接触24 h后人体皮肤角质层中抗氧化组分的含量约为5.7 μg/cm2。
2)天然绿色蚕丝的抗氧化组分向皮肤迁移具有时间依赖性。抗氧化组分的迁移量随样品与皮肤接触时间的增加而增加;抗氧化组分在各皮层中分布的差异也与接触时间相关。接触时间少于12 h,抗氧化组分更多地分布于皮肤角质层中;12 h后,抗氧化组分更多地渗透并积累于真皮层中。抗氧化组分只能迁移至皮层中,并不能穿透皮层。
3)抗氧化组分向皮肤迁移的量与皮肤表面的湿度、酸碱性有较大关系。湿润的皮肤环境有利于抗氧化组分向皮肤迁移,但并不是皮肤越湿润迁移量越大,类似于人体微出汗的皮肤环境更优;酸性皮肤环境下抗氧化组分的迁移量最大,且向皮肤深层迁移较多,其次是中性皮肤环境。
4)各皮层的抗氧化活性表现出明显的剂量效应,皮层吸收的抗氧化组分越多,皮层的自由基清除活性越高。
