毛地黄组织培养与再生体系建立研究
2023-12-05马梦宇简丽观李雪
马梦宇 简丽观 李雪


摘要要:【目的】为建立毛地黄组织培养及再生体系。【方法】以毛地黄花梗为外植体进行不定芽诱导,采用正交试验对不定芽增殖进行优化,利用单因素试验探究不同基本培养基对其生根的影响。【结果】适宜毛地黄不定芽增殖的培养基为MS+0.01 mg/L TDZ +2 mg/L 6-BA +0.02 mg/L NAA +30 g/L 蔗糖 +6 g/L琼脂,增殖率达(511.11±7.74)%。适宜生根的培养基为1/2 MS +0.2 mg/L NAA +30 g/L 蔗糖 +6 g/L 琼脂,生根率為(99.44 ±0.96)%,种植后的植株成活率超过95%。【结论】该组织培养与再生体系具有取材方便、流程简单的优点,有效提高了组培效率,可应用于毛地黄的产业化生产。
关键词:毛地黄;花梗;组织培养;再生体系建立
中图分类号:S682.19 文献标识码:A 文章编号:2095-5774(2023)03-0190-06
Study on Establishment of Tissue Culture and Regeneration System of Digitalis purpurea L.
Ma Mengyu, Jian Liguan, Li Xue*
(Quanmei Biotechnology Co.,Ltd.,Quanzhou,Fujian 362012,China)
Abstract:【Objective】The objective of this study is to establish a tissue culture and regeneration system of Digitalis purpurea L.【Method】Peduncles of Digitalis purpurea L. were used as explants for inducing adventitious bud formation. An orthogonal test was conducted to optimize the proliferation of the adventitious buds,and a single-factor test was utilized to explore the influence of different basic media on rooting. 【Result】The results indicated that the optimal medium for adventitious bud proliferation was MS medium supplemented with 0.01 mg/L TDZ,2 mg/L 6-BA,0.02 mg/L NAA,30 g/L sucrose,and 6 g/L agar,achieving a proliferation rate of 511.11±7.74%. The most suitable medium for rooting was 1/2 MS medium supplemented with 0.2 mg/L NAA,30 g/L sucrose and 6 g/L agar,with a rooting rate of 99.44±0.96%,and a post-transplanting survival rate exceeding 95%. 【Conclusion】This tissue culture and regeneration system has the advantages of convenient material collection and simple process,effectively improving tissue culture efficiency,and can be applied to the industrial production of Digitalis purpurea L.
Key words:Digitalis purpurea L.;Peduncle;Tissue culture;Establishment of regeneration system
毛地黄(Digitalis purpurea L.)又称洋地黄、德国金钟、自由钟、山白菜,是一年生或多年生草本药用植物,原产欧洲。据记载,毛地黄的根、叶入药,有强心之效[1,2],毛地黄及其提取物或制剂对心力衰竭、雳型克山病等有良好效果[3-6];分子生物学研究表明地黄皂苷可提高水稻抗稻瘟菌感染能力,用于分离霉形体膜、异形胞等[7,8]。毛地黄也可作为观赏植物,如盆栽密植毛地黄、大花毛地黄、重瓣毛地黄等备受市场欢迎[9-11]。
目前生产中种植的毛地黄多由种子发育而来,存在生产周期较长、发芽率低,大小不一致等问题,而采用组织培养法是有效加快繁殖速度的办法。梁佼等研究了毛地黄优良变异植株嫩茎愈伤组织的诱导、分化及无性系的建立[12],倪德祥、惠月明和刘永宏等进一步探究了毛地黄叶离体培养过程中激素、光质及培养基对器官发生的影响[13-16]。目前已报道的研究中,毛地黄组织培养及再生体系建立大多经过愈伤组织脱分化阶段,本研究以花梗为外植体直接诱导不定芽进而建立再生体系,为毛地黄的工厂化生产提供新途径。
1材料与方法
1.1 无菌材料获得
1.1.1 外植体来源
供试材料为1.5~2 a生毛地黄盆苗,购自漳州百花村,株高28~42 cm(不含花序),具3~5支花梗,且进入开花期,每株约5~7朵花完全开放(图1)。
1.2 试验方法
1.2.1 外植体诱导
选取生长健壮、无病虫害、开花具品种特性的毛地黄植株,取其新抽且未有花朵开放的花梗剪除花苞,切成2~3 cm节段(至少带一个节)作为外植体。于烧杯中用流水冲洗25~30 min。在超净工作台中,先用75%酒精消毒30 s,再置于0.1% HgCl2溶液中浸泡消毒10~20 min,之后无菌水冲洗3~5次,无菌滤纸吸干水分后接种。诱导培养基为MS+1.0 mg/L 6-BA(6-苄氨基腺嘌呤)+0.01 mg/L TDZ(苯基噻二唑基脲)+30 g/L蔗糖+6 g/L 琼脂,pH值5.8,培养周期28 d。本试验的培养条件均为培养基灭菌条件121℃,灭菌30 min,培养温度25±1℃,LED灯光源,光照强度30~65 μmol /(m2·s),光照时长12 h/d,以下同。
1.2.2 增殖正交试验设计
以MS +30 g/L蔗糖+6 g/L琼脂为基本培养基,pH值5.8,采用L9(34)正交设计(表1)探究TDZ、6-BA和NAA(萘乙酸)的不同浓度及其组合对毛地黄不定芽增殖影响。截取长势基本一致毛地黄无菌茎段,1.5~2.0 cm(具生长点)为一个增殖单位,分别接种于9种不同处理的增殖培养基中培养。每个处理接种50~90个增殖单位,重复3次。
1.2.3 生根培养
以0.2 mg/L NAA+20 g/L蔗糖+6 g/L琼脂为培养基,pH值5.8,分别在MS、1/2 MS、1/3 MS基本培养基上进行单因素生根试验,28 d统计生根率。当植株根长至2 cm及以上时进行炼苗,之后移栽到基质为泥炭藓(0~10 mm):珍珠岩=31的105目穴盘中,28 d统计移栽存活率[12]。
1.3 指标测定
观察并记录不同处理组培苗的生长情况,并统计相关数据。增殖芽数(以侧芽长度达到0.5 cm时记为增殖芽)、株高和叶片数等指标。增殖率(%)=(培养后芽数-接种芽数)/接种芽数×100%;生根率(%)=生根株数/接种数×100%。存活率(%)=存活数/种植数×100%。
1.4 数据处理方法
试验数据采用Excel和SPSS 19进行统计分析。
2 结果与分析
2.1 不同消毒时间对毛地黄外植体诱导的影响
不同的外植体消毒时间对无菌材料的获得效果见表2,结果表明0.1% HgCl2消毒15 min或20 min的无菌材料获得率相对较高,存活外植体均诱导出不定芽(图2),持续转代4次后用于增殖试验。
2.2不同培养基组合对毛地黄不定芽增殖的影响
毛地黄在不同增殖培养基中的不定芽增殖效果见表3。分析结果表明,极差(R值)最大对应的试验因素为B,并且B取第三水平时增殖率最高,不同因素对毛地黄组培苗增殖率影响的依次为6-BA浓度(因素B)>TDZ浓度(因素A)>NAA浓度(因素C)。
毛地黄主芽、侧芽、主芽叶片数和长势的分析结果表明(表4),不同因素对毛地黄这些生长指标的影响不明显。进一步的方差分析结果如表5所示,6-BA对毛地黄组培苗的增殖影响显著(P<0.05);而TDZ和NAA的影响均不显著。比较各因素不同水平下增殖率的总和(K值)或平均值(k值)结果表明,各因素不同水平对毛地黄组培苗增殖率影响的最优值排序分别为A2>A3>A1,B3>B2>B1,C2>C1>C3。增殖率的直观分析结果表明:毛地黄增殖的最优组合为A2B3C2,这与表3中增殖试验结果(最优组合为A3B3C2)不一致。故进行各因素优水平验证试验。
取长势基本一致的毛地黄不定芽接种于A2B3C2(MS+0.01 mg/L TDZ+2 mg/L 6-BA+0.02 mg/L NAA+30 g/L蔗糖+6 g/L琼脂,pH值5.8)培养基上进行增殖培养效果验证,每个重复40株,3次重复。试验结果见表6,A2B3C2的增殖率为(511.11±7.74)%,长势如图3,优于各正交试验处理组,为适宜毛地黄增殖培养基。
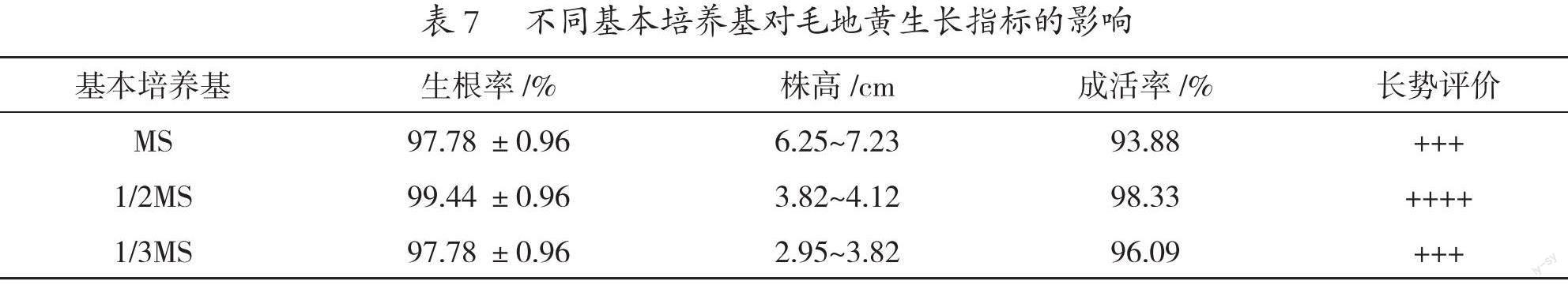
2.3 基本培养基对毛地黄生根与存活的影响
毛地黄生根与存活试验结果见表7,3种处理的毛地黄生根率均在90%以上。结合生根率、成活率及长势评价结果,筛选到1/2 MS+0.2 mg/L NAA+30 g/L蔗糖+6 g/L琼脂为最佳的毛地黄生根培养基,植株的根系多、长势旺(图4)。处理的组培苗移栽穴盘28 d后(图5),进行大田种植,4个月后陆续开花(图6)。
3 结论与讨论
本试验以新抽花梗为毛地黄组培苗诱导的外植体,75%酒精消毒30 s加0.1%HgCl2消毒15 min或20 min时的无菌材料获得率相对较高。正交试验9个增殖培养基组合均能让毛地黄增殖,其中处理6(A2B3C1,0.01 mg/L TDZ + 2 mg/L 6-BA+0.01 mg/LNAA)和处理9(A3B3C2,0.02 mg/L TDZ + 2 mg/L 6-BA+0.02 mg/L NAA)的增殖率達260%以上。倪德祥等[13]利用无菌叶片(含中脉)离体培养探究光质与培养基对器官发生的方差分析表明,含6-BA培养基的效应极显著。惠月明在毛地黄组织培养中器官发生的激素调节研究发现,6-BA浓度在1~5 mg/L 有利于芽的诱导[14]。本研究的正交分析结果亦表明,6-BA浓度对毛地黄生丛芽增殖影响显著。
正交试验获得优水平组合为A2B3C2(0.01 mg/L TDZ +2 mg/L 6-BA + 0.02 mg/L NAA),以MS为基本培养基的不定芽,A2B3C2组合增殖率可达(511.11 ± 7.74)%。综合考量增殖率、主芽高度、主芽叶片数、侧芽高度和长势,A2B3C2组合为不定芽增殖适宜培养基;其增殖率略低于梁佼等[12]通过毛地黄优良变异植株嫩茎愈伤诱导-分化不定芽-增殖所用培养基(MS + 0.2 mg/L 6-BA + 0.2 mg/L IAA)的增殖率(750%),这可能与外植体状态和培养基所选用激素不同有关。
毛地黄生根较容易,其在基本培养基(MS、1/2 MS、1/3 MS)+0.2 mg/L NAA+20 g/L蔗糖+琼脂6 g/L、pH值5.8培养基上的生根率平均在97%以上,株高随着无机盐浓度升高而升高。1/2 MS+ 0.2 mg/L NAA +20 g/L蔗糖+6 g/L琼脂较其他处理略好,这与梁佼等[12]研究基本一致。因此,本实验直接利用毛地黄花梗诱导不定芽进而建立组织培养与再生体系,具取材方便、流程简單的优点,有效提高了组培效率,可应用于毛地黄的产业化生产。
参考文献:
[1]李幸祥,唐迎雪,樊凯芳. 中国常用中草药图典[M]. 青岛:青岛出版社,2013.
[2]杨卫平,夏同珩. 新编中草药图谱及经典配方[M]. 贵阳:贵州科技出版社,2014.
[3]中国植物志编辑委员会. 中国植物志[M].北京:科学出版社,1997.
[4]董正华,顾晓龙,黄军,等. 小剂量洋地黄对急性心肌梗死PCI术后合并心力衰竭患者心率变异性的影响[J]. 现代生物医学进展,2016,16(7):1295 -1298,1344.
[5]戴明红 ,李莉,蔡振华,等. 洋地黄治疗小儿肺炎合并心力衰竭的护理[J]. 中华全科医学,2009,7(2):210 - 211.
[6]凌瑞琴,裴永贤. 毛地黄类治疗痨型克山病的几点体会[J]. 吉林医科大学学报,1960,(7):143 - 149.
[7]王钧,朱群,Christopher J.,等. 毛地黄皂苷诱导的水稻悬浮细胞防卫基因表达的信号传导[J]. 实验生物学报,1997,(2):133 - 145.
[8]逯忠新,邓光明,包慧芳,等. 用毛地黄皂苷分离霉形体膜[J]. 中国兽医科技,1995(6):22-23.
[9] 小古. 盆栽密植毛地黄[J]. 花卉,2020(5):17 - 19.
[10]王意成. 毛地黄[J].花木盆景(花卉园艺),2015(4):29.
[11]刘方农,彭世逞,刘联仁.毛地黄一族[J]. 中国花卉盆景,2010(3):11 - 14.
[12]梁佼,程丽娟,陈莹,等. 毛地黄优良变异植株组织培养及无性系的建立[J]. 山东农业科学,2007(6):11 - 13,20.
[13]倪德祥,曹勇伟,张丕方,等. 毛地黄(Digitalis purpurea)叶离体培养过程中光质与培养基对器官发生的交互作用[J]. 植物生理学报,1987(4):359 - 364.
[14]惠月明. 毛地黄组织培养中器官发生的激素调节研究[J]. 中药通报,1986(6):12 - 13,52.
[15]刘永宏,冯敏,潘熙春,等. 不同激素的培养基对毛地黄的影响[J]. 天水师专学报,1992(2):77 - 81,73.
[16]倪德祥,张丕方,王凯基,等. 植物激素在毛地黄叶离体培养形态发生中的互作效应[J]. 上海农业科技,1988(5):31 - 32.
(责任编辑:冯新)
