荔枝果渣不溶性膳食纤维的结构、体外抗氧化及降血糖活性评价
2023-12-05李依娜余元善胡腾根吴继军肖更生卜智斌
李依娜,余元善,胡腾根,李 璐,吴继军,肖更生,邹 波,卜智斌
(1 广东省农业科学院蚕业与农产品加工研究所 农业农村部功能食品重点实验室广东省农产品加工重点实验室 广州510610 2 华南农业大学食品学院 广州510642 3 仲恺农业工程学院轻工食品学院 广州 510631)
荔枝(Litchi chinensis Sonn.)为热带亚热带常绿乔木植物的果实,含有多种营养和促进健康的生物活性成分,如多酚、膳食纤维、有机酸、氨基酸和维生素等,具有抗氧化、抗肿瘤、降血脂和免疫调节等功效[1]。据报道,荔枝加工过程中产生的皮渣副产物占全果的40%~50%[2],这些加工副产物比整个果实含有更高的膳食纤维含量和酚类含量,具有广泛的生理活性和潜在应用价值[3-4]。荔枝果渣在实际生产中的利用程度不高,常被直接丢弃或填埋,少部分用作饲料或堆肥[5]。
膳食纤维(Dietary fiber,DF)是指天然存在于食物中的可食用碳水化合物或人造碳水化合物的聚合物,能抗人体小肠消化吸收,在大肠中可以部分或全部发酵[6]。根据其溶解性可分为可溶性膳食纤维(Soluble dietary fiber,SDF)和不溶性膳食纤维(Insoluble dietary fiber,IDF),其中IDF 在天然纤维中占比约为2/3~3/4[7]。进入食品市场的膳食纤维主要来自水果、蔬菜、坚果和谷物,可通过物理、酶和化学法从食物原料中获得[8]。相关研究发现,膳食纤维可通过降低餐后血糖水平和餐前胆固醇水平,运输酚类化合物,促进结肠发酵,增加粪便量等机制显著改善人体健康,其独特的生理作用在很大程度上取决于食物来源、提取方法、化学成分和结构,不同的提取方法会影响膳食纤维的理化性质、结构组成,进而对其功能特性产生影响[9-10]。
目前对于荔枝果渣膳食纤维的研究主要是提取工艺及理化性质的测定[11],而不同提取方法制备的荔枝果渣膳食纤维的结构组成及功能性质差异鲜有报道。鉴于此,本试验采用纤维素酶、超声波、高压热水、高静水压4 种方法制备荔枝果渣IDF,比较不同提取方法对荔枝果渣IDF 的单糖组成、结构性质及体外功能特性的影响,为评估荔枝果渣IDF 作为功能性食品原料提供理论依据,从而实现荔枝加工副产物的高值化利用。
1 材料与方法
1.1 材料与试剂
荔枝(怀枝)果渣,由广州顺昌源绿色食品有限公司提供,采用发酵法进行脱糖预处理[12]。α-淀粉酶(2 000 U/mL)、2,2'-联氮-双(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1,1-二苯基-2-三硝基苯肼自由基(DPPH)、1-苯基-3-甲基-5-吡唑啉酮(PMP),上海阿拉丁生化科技股份有限公司;中性蛋白酶(100 U/mg)、单糖标准品(色谱纯),上海源叶生物科技有限公司;纤维素酶(700 EGU/g),诺维信(中国)生物技术有限公司;其它试剂均为国产分析纯级。
1.2 仪器与设备
FDU-2110 型冷冻干燥机,上海爱朗仪器有限公司;Infinite M200pro 型酶标仪,奥地利TECAN公司;LC-20A 型高效液相色谱(HPLC),日本岛津公司;D3024R 型高速离心机,美国赛洛捷克公司;YXQ-LS-5OS 型立式蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;JY88-Ⅱ型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;SHPP-57DZM-600 型高静压设备,山西力德福科技有限公司。
1.3 试验方法
1.3.1 荔枝果渣IDF 的提取 脱糖荔枝果渣与水以1∶20(m/V)的料液比混合,调节pH 值为6.0,在95 ℃下加入100 U/g α-高温淀粉酶反应30 min,冷却后调节pH 值至7.0,加入500 U/g 中性蛋白酶,于55 ℃酶解1.5 h,反应结束后沸水浴灭酶10 min。纤维素酶提取法是在50 ℃下加入50 μL/g 纤维素酶水浴振荡3 h,煮沸10 min 灭酶;超声波提取法是在超声波细胞粉碎机中以250 W 处理20 min;高压热水提取法是在高压蒸汽灭菌锅内(121℃,0.2 MPa)高温、高压处理30 min;高静水压提取法是在超高压容腔内以400 MPa 压力条件保压处理15 min。将经过纤维素酶、超声波、高压热水和高静水压处理的混合物离心,收集沉淀,冷冻干燥,所得荔枝果渣IDF 分别命名为EIDF、UIDF、HIDF 和PIDF。
1.3.2 色差的测定 采用色差仪(反射模式)对4个荔枝果渣IDFs 样品的色泽进行标度(L*=暗/光,a*=红/绿,b*=黄/蓝),色彩饱和度C*按式(1)计算。
1.3.3 粒径分布的测定 采用激光粒度仪测定样品的粒度分布情况,通过软件分析得到累计粒度分布百分数分别达到10%,50%,90%时所对应的粒径参数(D10、D50、D90),以及粒度分布的平均粒径Dav 和比表面积(S/V),粉体径距R 按式(2)计算。
1.3.4 单糖组成分析 参考周廖强等[13]的方法,使用PMP 柱前衍生化HPLC 法分析4 个荔枝果渣IDFs 的单糖组成。色谱分离条件:以磷酸钠缓冲液(0.05 mol/L,pH 6.85)-乙腈(87 ∶17,V ∶V)为流动相,流速1 mL/min,等度洗脱60 min,紫外检测波长250 nm。
1.3.5 结构特性分析
1.3.5.1 傅里叶红外光谱(FTIR)分析 称取5 mg 待测样品与100 mg 溴化钾在研磨钵中充分研磨混合,置于压片机中进行压片处理,用傅里叶红外光谱仪于4 000~400 cm-1范围扫描,分辨率4 cm-1。
1.3.5.2 X 射线衍射(XRD)分析 将待测样品压片后采用X 射线衍射仪测定。检测条件:靶型Cu靶,电压40 kV,电流30 mA,扫描区域(2θ)5°~50°,扫描速度4°/min。
1.3.5.3 扫描电子显微镜(SEM)分析 将待测样品置于双面胶带上并喷涂薄金层,在20 kV 电压下通过扫描电镜进行微观结构观察。
1.3.6 体外抗氧化活性测定 参考种俸亭等[14]的方法并稍作修改。样品处理:称取1.0 g 待测样品,加入30 mL 70%乙醇溶液,混合后置于超声波清洗槽中超声处理30 min,离心,收集上清液,沉淀在相同条件下重复提取至上清液基本无色,合并所有上清液,旋干乙醇,定容50 mL,备用。
1.3.6.1 总酚含量测定 采用福林酚法,以没食子酸为标准品绘制标准曲线,样品的总多酚含量以每克干基中所含没食子酸(GAE)的质量(mg GAE/g)表示。
1.3.6.2 DPPH 自由基清除率测定 配制1,2,4,6,8,10 mg/mL 的样品稀释液。参照Zhang 等[15]方法并稍作修改。取50 μL 待测样品溶液与150 μL 0.2 mmol/L DPPH 溶液混合后,室温避光反应30 min,同时以VC 为阳性对照,在波长517 nm 处用酶标仪测定吸光度。DPPH 自由基清除率按式(3)计算,当清除率达50%所对应的样品浓度用EC50值表示(mg/mL)。
1.3.6.3 ABTS 自由基清除率测定 参照Garzón等[16]方法并稍作修改,取20 μL 不同浓度的待测样品溶液加入200 μL ABTS 溶液,室温避光反应10 min,在波长734 nm 处用酶标仪测定吸光度,VC 为阳性对照,ABTS 自由基清除率按式(4)计算,当清除率达到50%所对应的样品浓度用EC50值表示(mg/mL)。
1.3.7 体外降血糖活性测定
1.3.7.1 α-葡萄糖苷酶抑制率测定 样品处理同1.3.6 节,配制0.25,0.5,1,2,4,6 mg/mL 的样品稀释液,参照Apostolidis 等[17]的方法测定α-葡萄糖苷酶的抑制率,以阿卡波糖为阳性对照,结果用抑制率(%)表示,当抑制率达到50%时所对应的浓度用IC50值(mg/mL)表示。
1.3.7.2 葡萄糖束缚能力测定 参考官印珑等[18]的方法并稍作修改,称取0.5 g 待测样品加到25 mL 100 mmol/L 葡萄糖溶液中,混匀后置于37℃水浴振荡3 h,离心,取上清用DNS 法测定其中的葡萄糖含量。葡萄糖束缚能力以每克膳食纤维样品吸收的葡萄糖物质的量(μmol/g)来表示。
1.3.7.3 葡萄糖透析延迟指数测定 参考官印珑等[18]的方法,称取0.2 g 待测样品加入10 mL 100 mmol/L 的葡萄糖溶液中,将混合物装入透析袋中,置于盛有100 mL 蒸馏水的烧杯中,37 ℃振荡透析,分别在30,60,90 min 时用DNS 法测定透析液中的葡萄糖含量。葡萄糖透析延迟指数按式(5)计算。
1.4 数据统计与分析
所有试验均重复3 次,使用Excel 2010 软件和SPSS 23.0 软件进行数据统计分析,结果以“平均值±标准偏差”表示。采用单因素ANOVA 方差分析进行Duncan's 检验,P〈0.05表示差异显著,使用Origin 2018 作图。
2 结果与分析
2.1 荔枝果渣IDF 的理化性质
2.1.1 荔枝果渣IDF 的色泽 在食品加工中,物料的色泽会显著影响成品的物化指标,进而影响消费者对产品的接受度。由图1 可看出,纤维素酶提取、超声波提取、高静水压提取的荔枝果渣IDF样品为浅褐色、褐色粉末颗粒,而高压热水提取的荔枝果渣IDF 为红褐色粉末颗粒。由表1 可看出,不同提取方法制备的荔枝果渣IDF 样品间色差值均有不同程度的变化,其中EIDF 的亮度最高(63.26±0.75),UIDF 和EIDF 的色彩饱和度无显著性差异,PIDF 的黄度最高(12.50±0.33),而HIDF 的亮度最低(52.50±0.85),红度(8.24±0.28)显著高于其它样品。不同提取方法制备的荔枝果渣IDF 色度有显著性差异,说明不同加工处理条件影响荔枝果渣IDF 的色泽。色泽加深可能是高温、高压以及荔枝果渣本身特有性质造成的。
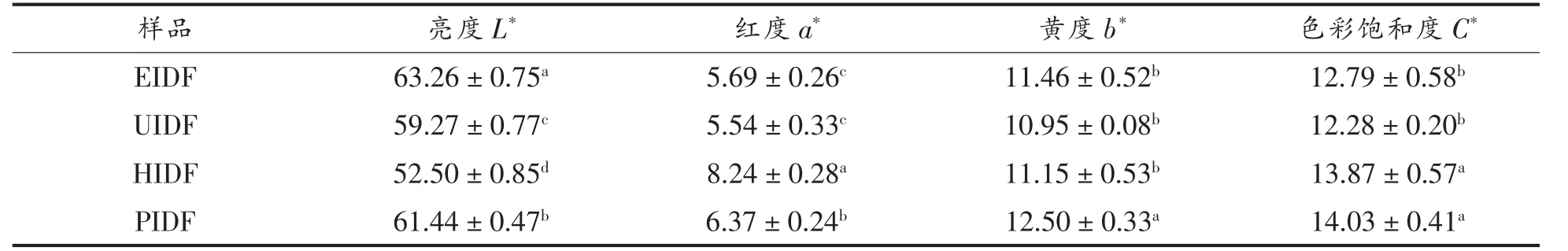
表1 EIDF、UIDF、HIDF 和PIDF 的色差比较Table 1 Comparison of colour differences between EIDF,UIDF,HIDF and PIDF

图1 不同提取方法制备的荔枝果渣IDF 外观形态Fig.1 Appearance of litchi pomace IDF prepared by different extraction methods
2.1.2 荔枝果渣IDF 的粒径分布比较 粒径大小和比表面积在一定程度上反映粉粒在食品体系中的分散性和溶解性,并影响其内部活性基团的暴露和营养活性成分的释放[19]。由表2 可知,各荔枝果渣纤维样品的平均粒径在(11.88~55.14)μm,各样品的粒径分布存在显著性差异,这可能是不同提取方法导致纤维物料颗粒的内部结构发生程度不一的破裂和膨化。EIDF 的平均粒径【(11.88±1.19)μm】 显著小于其它样品,比表面积最大(0.61±0.06)m2/cm3;UIDF 的平均粒径【(36.63±0.33)μm】和比表面积【(0.20±0.01)m2/cm3】次之。UIDF 的径距显著高于另外3 个样品,为(2.61±0.04)μm,说明超声波细胞粉碎法制备的荔枝果渣IDF 的粒径分布最宽。类似的研究显示,米糠IDF[20]和胡萝卜渣IDF[21]分别经超微粉碎后,其粒径相应减小,径距有所增加。4 个荔枝果渣纤维样品的径距分布范围1.69~2.61 μm,径距均大于1,表明不同提取方法制备的荔枝果渣IDFs 粉粒为非对称分布,大颗粒的数量多于小颗粒的数量。膳食纤维的粒径越小,比表面积越大,有利于增加其内部活性基团的暴露,提高其水合性质及吸附能力[22]。

表2 EIDF、UIDF、HIDF 和PIDF 的粒径分布Table 2 Particle size distribution of IDF,UIDF,HIDF and PIDF
2.1.3 荔枝果渣IDF 的单糖组成 从表3 可以看出,不同提取方法制备的荔枝果渣IDF 均检出甘露糖、核糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖、木糖、阿拉伯糖和岩藻糖共9 种单糖组成,各纤维样品单糖组成类型相同,含量存在差异。阿拉伯糖、葡萄糖、甘露糖、木糖和半乳糖是荔枝果渣IDF 的主要中性单糖,其中EIDF 和UIDF 的鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖含量显著高于其它两种IDF 样品,其原因可能是在酶和超声的作用下,荔枝果渣细胞壁中的纤维素水解断裂、纤维分子间的氢键受到机械破坏,进而影响其单糖组成[23]。各单糖组成中,荔枝果渣IDF 的阿拉伯糖含量最高,EIDF、UIDF、HIDF、PIDF 的阿拉伯糖含量范围在51.80~117.51 mg/g,其阿拉伯糖含量分别占其总单糖含量的41.84%,41.13%,32.45%,42.36%。据Hao 等[24]的研究,阿拉伯糖是一种无热量的糖,可显著降低高糖、高脂饮食诱导的大鼠的体质量、Lee's 指数和脏器指数,改善糖脂异常和炎症反应等代谢综合征。综上,荔枝果渣IDF 可能对人体健康有积极的作用。

表3 EIDF、UIDF、HIDF 和PIDF 的单糖组成及含量Table 3 Monosaccharide composition and content of EIDF,UIDF,HIDF and PIDF
2.2 荔枝果渣IDF 的结构特性
由图2a 可看出,各纤维样品在400~4 000 cm-1范围有相似的光谱分布,相应波长上的特征吸收峰强度大致相同。3 450 cm-1附近的吸收峰是游离-OH 基团与氢键缔合而产生的伸缩振动,不同提取方法制备的荔枝果渣IDF 在此处均出现宽而强的吸收带,表明其分子结构存在较多缔合状态的氢键;2 930 cm-1和2 854 cm-1处的弱吸收峰是由甲基、亚甲基上C-H 伸缩振动引起的,表明荔枝果渣IDF 具有纤维素多糖的典型结构特征;1 740 cm-1和1 640 cm-1处是C=O 和-COOH 的伸缩振动所产生的吸收峰,说明荔枝果渣IDF 均含有糖醛酸[25];1 525 cm-1附近的吸收峰是苯环特征吸收峰,表明荔枝果渣IDF 中含有木质素;1 441,1 049 cm-1处出现的两个吸收峰分别对应纤维素和半纤维素中的CH2基团变形振动、C=O 基团伸缩振动[26]。XRD 分析结果如图2b 所示,4 个荔枝果渣IDF 样品在扫描角度2θ 为5°~50°范围呈现弥散衍射,在2θ 为21.3°处均出现一个强衍射峰,该处对应纤维素晶体的002 晶面,表明荔枝果渣IDF 具有典型的纤维素Ⅰ型结构,由结晶区和无定形区组成[27]。由图2c 可看出,所有荔枝果渣IDF样品的超微结构表面粗糙,EIDF 表面带有较多的孔洞和褶皱,并附着少些球形小颗粒;UIDF 整体结构疏松,呈膨化状,表面存在较多的纤维束;HIDF 呈不规则的块状分布,表面凹凸不平,带有粗糙的凹陷;PIDF 表面的孔隙较大,沟壑和凹槽多且深。这些变化表明纤维素酶解、超声波、高压热水和高静水压处理改变了荔枝果渣膳食纤维的内部结构,其粗糙松散的结构有利于形成更大的比表面积,使内部的活性基团更多地暴露在纤维表面,进而对其生理功能产生影响[28]。
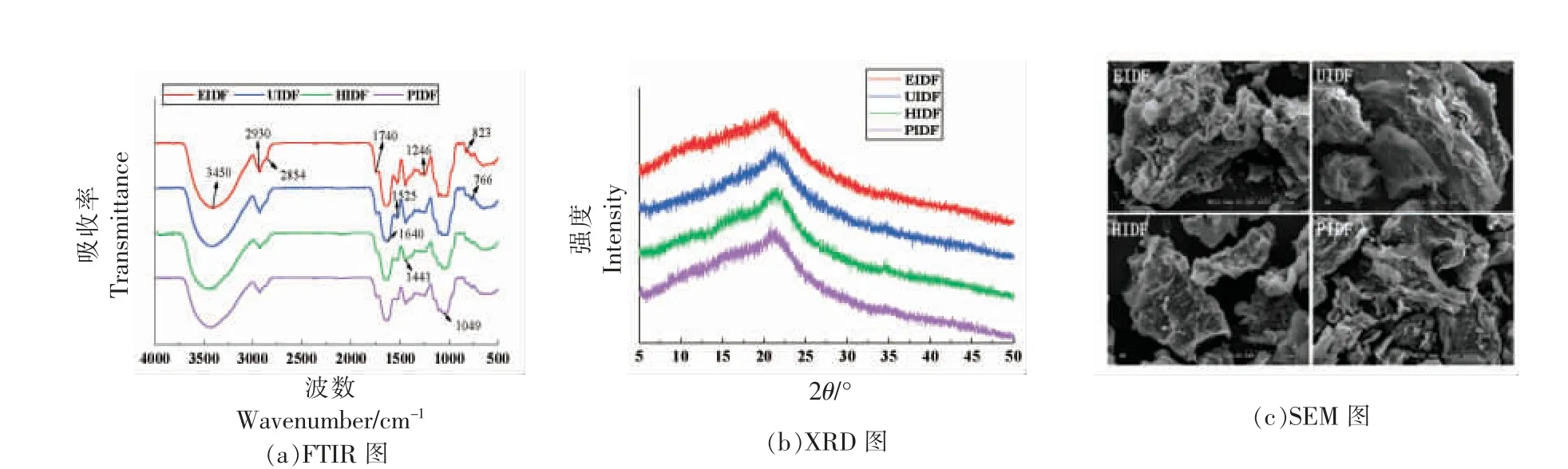
图2 不同提取方法制备的荔枝果渣IDF 的结构分析图Fig.2 Structural analysis diagram of litchi pomace IDF prepared by different extraction methods
2.3 荔枝果渣IDF 的体外抗氧化活性
2.3.1 总酚含量 荔枝含有丰富的纤维素、葡聚糖、多酚类、黄酮类等生物活性物质,这些生物活性物质是天然抗氧化剂,具有较强的清除自由基能力,可保护机体免受自由基攻击而导致的酶失活、脂质过氧化和蛋白质损伤等[29-30]。由图3a 可知,从荔枝果渣中提取的IDF 富含酚类物质,各纤维样品(EIDF、UIDF、HIDF 和PIDF)的总酚含量依次为(7.50±0.15),(7.12±0.18),(13.23±0.32)mg GAE/g 和(7.73±0.08)mg GAE/g,高于其它报道的番茄果皮纤维[31](1.58 mg GAE/g)和米糠膳食纤维(2.10 mg GAE/g)[32]的总酚含量。HIDF 的总酚含量显著高于其它3 种IDFs,这种差异可能归因于高温、高压条件下荔枝果渣IDF 的组织结构受到破坏,促使嵌入纤维基质中的酚类物质释放。相关研究显示,荔枝汁经121 ℃高温热处理后,其酚类物质含量呈现显著性提高[33],与本试验结果一致。
2.3.2 自由基清除能力 DPPH 法和ABTS 法是目前最常用的自由基清除测定方法,被广泛用于测定物质的抗氧化能力。抗氧化物质可与DPPH或ABTS 自由基结合而使反应体系褪色,通过检测反应体系在特定波长下的吸光值间接反应该物质的抗氧化能力[34]。图3b 和图3c 分别显示不同质量浓度的荔枝果渣IDF 对DPPH、ABTS 自由基清除率的影响。可以看出不同提取方法制备的荔枝果渣IDF 样品对DPPH、ABTS 自由基均有一定的清除作用,清除效果弱于VC,呈现明显的剂量依赖性。随着荔枝果渣IDFs 溶液质量浓度的增加,各样品的自由基清除率呈上升趋势,对DPPH自由基清除率范围在(14.82±0.65)%~(83.99±0.97)%之间,对ABTS 自由基清除率范围在(6.11±0.09)%~(81.06±1.62)%之间,与葵花粕IDF 的DPPH、ABTS 自由基清除率的变化趋势类似[28]。此外,在不同浓度下,HIDF 的自由基清除率显著高于其它3 个样品,与图3a 中的总酚含量结果相对应,说明HIDF 表现出较强的抗氧化作用可能与其酚类物质含量有关。由图3d 可看出,HIDF 的DPPH、ABTS 自由基清除率EC50值显著低于其它纤维样品,分别为(2.11±0.04)mg/mL 和(4.67± 0.14)mg/mL,EIDF 和PIDF 的DPPH、ABTS 自由基清除率EC50值则无显著性差异。EC50值越小,样品对于自由基的清除能力越强。Liu等[35]研究发现冷冻干燥后东奎杨梅果肉提取物的DPPH、ABTS 自由基清除率EC50值分别为(5.42±0.13)mg/mL 和(3.53±0.05)mg/mL。种俸亭等[14]报道百香果皮不可溶纤维提取物的EC50值分别为(172.0 ± 0.55)mg/mL 和(169.4 ± 0.33)mg/mL。相较之下荔枝果渣IDF 的EC50值较低,具有较好的抗氧化能力。
2.4 荔枝果渣IDF 的体外降血糖活性
2.4.1 α-葡萄糖苷酶抑制活性 有研究表明,高碳水化合物饮食会导致餐后高血糖反应,α-葡萄糖苷酶抑制剂可通过抑制机体内α-葡萄糖苷酶的活性而减缓碳水化合物消化为可吸收的单糖,被认为是控制餐后血糖水平升高的有效治疗方式之一[36]。由图4a 可知,对照阿卡波糖在0.25~6 mg/mL 范围对α-葡萄糖苷酶抑制率维持在95%以上。各纤维样品(EIDF、UIDF、HIDF 和PIDF)质量浓度为0.25 mg/mL 时,对α-葡萄糖苷酶抑制率分别为(30.67±4.39)%,(17.32±2.34)%,(39.49±0.37)%,(40.94±1.14)%。随着样品质量浓度的增加,各样品对α-葡萄糖苷酶抑制率提高,表现出明显的剂量-效应关系。在样品质量浓度为4 mg/mL 时,各纤维样品对α-葡萄糖苷酶抑制率均在90%以上。由图4b 可知,阿卡波糖的半抑制浓度(IC50)最低,其次是HIDF(0.32 ± 0.02)mg/mL 和PIDF(0.32 ± 0.01)mg/mL,EIDF 的半抑 制浓度(IC50)为(0.42±0.03)mg/mL,显著低于林良美[37]报道的笋壳IDF 的IC50值(0.517 mg/mL)。IC50值越低,该物质的α-葡萄糖苷酶抑制活性越强。阿卡波糖是生物合成药物,有一定的副作用[38],而荔枝果渣IDFs 来源于植物性食物,对α-葡萄糖苷酶呈现积极的抑制效果,具有作为食品体系中α-葡萄糖苷酶抑制剂成分的潜力。

图4 不同提取方法制备的荔枝果渣IDF 的α-葡萄糖苷酶抑制活性(a)和半抑制浓度(IC50)(b)Fig.4 α-Glucosidase inhibitory activity(a)and semi-inhibitory concentration(IC50)(b)of litchi pomace IDF prepared by different extraction methods
2.4.2 葡萄糖束缚能力和葡萄糖透析延迟能力膳食纤维可有效束缚小肠内的葡萄糖,延迟葡萄糖在胃肠道的吸收,从而达到降低血糖的作用[39]。膳食纤维的吸附能力与其化学结构、内在结构和表面性质等有关[40]。由图5a 可看出,在100 mmol/L葡萄糖溶液中,不同提取方法制备的荔枝果渣IDF 均表现出一定的葡萄糖束缚能力,其中UIDF的葡萄糖束缚能力显著高于其它3 个荔枝果渣IDF,达到(657.96±46.37)μmol/g,HIDF 和PIDF 的葡萄糖束缚能力无显著性差异。据其它报道,猕猴桃渣膳食纤维[41]、小麦IDF[39]、川秋葵微粉[42]在100 mmol/L 葡萄糖溶液中葡萄糖束缚能力分别为813.60,555.60,369.06 μmol/g,可见膳食纤维的葡萄糖束缚能力同时受不同食物来源的影响。葡萄糖透析延迟指数可用于表征荔枝果渣IDF 延迟葡萄糖扩散的能力,样品的葡萄糖透析延迟指数越大,表明其对餐后血糖的控制效果越好[14]。图5b可看出,不同提取方法制备的荔枝果渣IDF 对葡萄糖扩散均有抑制作用,在透析时间30 min 时,荔枝果渣IDFs 的葡萄糖透析延迟指数在(22.58±0.40)%~(43.67±0.80)%之间,之后随着透析时间的延长各荔枝果渣IDF 样品的葡萄糖透析延迟指数呈显著下降,说明葡萄糖延迟扩散能力随时间的增加而逐渐减弱,这与王彩虹[43]和官印珑等[18]的研究结果一致。在同一透析时间,UIDF 的葡萄糖透析延迟指数显著大于其它3 个荔枝果渣IDF 样品,这进一步证实UIDF 对葡萄糖具有较好的吸附能力,与图5a 中的葡萄糖束缚能力结果一致。

图5 不同提取方法制备的荔枝果渣IDF 的葡萄糖束缚能力(a)和葡萄糖透析延迟指数(b)Fig.5 Glucose binding capacity(a)and glucose dialysis delay index(b)of litchi pomace IDF prepared by different extraction methods
3 结论
本试验通过酶解法、超声波法、高压热水法和高静水压法制备的4 个荔枝果渣IDF 平均粒径范围为11.88~55.14 μm,主要单糖组成是阿拉伯糖(51.80~117.51)mg/g,占总单糖组分的32.45%~42.36%。各纤维样品均存在典型的纤维素多糖特征吸收峰和纤维素Ⅰ型结构,其微观结构粗糙松散。在功能性质方面,4 个荔枝果渣IDF 总酚含量为(7.12±0.18)~(13.23±0.32)mg GAE/g,对DPPH自由基、ABTS 自由基均有较好的清除作用。各纤维样品均有显著的α-葡萄糖苷酶抑制活性,其α-葡萄糖苷酶抑制率的半抑制浓度(IC50)为(0.32±0.01)~(0.73±0.03)mg/mL,表现出较好的葡萄糖束缚能力和葡萄糖透析延迟能力。不同提取方法制备的荔枝果渣IDF 的理化结构、抗氧化活性和降血糖活性差异显著,其中高压热水法提取的荔枝果渣IDF 呈明显的红褐色,其总酚含量及自由基清除率最高,超声波法提取的荔枝果渣IDF 微观结构呈膨化状,表现出最强的葡萄糖束缚能力和葡萄糖透析延迟能力。综合来看,荔枝果渣IDF 的理化结构和功能性质受其制备方法的影响,从荔枝果渣中提取的IDF 均具有较好的体外抗氧化和降血糖能力。这一研究结果可为荔枝果渣的精深加工和植物源功能性食品的开发提供参考。
