1株高产生物膜发酵乳杆菌抗胁迫特性与全基因组分析
2023-12-05张悦郑砚学贺银凤
张悦,蒋 柠,郑砚学,顾 悦,王 艳,贺银凤*
(1 内蒙古农业大学食品科学与工程学院 呼和浩特010018 2 内蒙古自治区质量和标准化研究院 呼和浩特 010070)
发酵乳杆菌(Lactobacillus fermentum)是一种主要定植于动物肠道中的异型发酵乳酸菌[1],能调节天然免疫与适应性免疫[2],具有抗炎症和降胆固醇等作用[3]。研究发现,发酵乳杆菌不仅可以在发酵驼乳时产生天然新型抗氧化肽[4],在发酵过程中,还可以代替发酵香肠中亚硝酸盐,降低亚硝酸盐在香肠中的残留风险。此外,该菌株通过防止脂肪氧化、蛋白质分解、肌红蛋白氧化和提高游离氨基酸含量,有效提高香肠的品质和营养价值[5]。然而,发酵乳杆菌在人类的肠道[6]或者在用于食物发酵时经常受到不同的胁迫[7],因此,增强其抗逆性变得非常关键。
基因组学时代彻底改变了人们对所有生物基因的理解。这个时代起源于1995 年,Craig Venter和他的同事发表第1 个活的有机体的完整基因组序列——革兰氏阴性细菌流感嗜血杆菌(Haemophilus influenzae)。当时的基因组序列计划,包括人类基因组计划,都是利用定向测序的方法,即以有序的方式对基因组的已绘制区域进行单独测序。Venter 等研究表明,一种鸟枪式测序方法,即构建整个随机剪切的基因组鸟枪库,并使用序列支架组装它们的序列,可以更快地完成这一任务,并改变基因组序列计划的方向[8]。目前在NCBI(https://www.ncbi.nlm.nih.gov/assembly/?term=Lactobacillaceae)数据库中上传的乳酸杆菌(Lactobacillaceae)全基因组共有5 726 组,其中植物乳杆菌(Lactobacillus plantarum)有792 组,德氏乳杆菌(Lactobacillus delbrueckii)有419 组,罗伊氏乳杆菌(Lactobacillus reuteri)有328 组,鼠李糖乳杆菌(Lactobacillus rhamnosus)有230 组,而发酵乳杆菌只有107 组。对发酵乳杆菌全基因组的测定远少于其它乳酸杆菌,这不利于其优异特性及相关作用机制的研究。本文研究1 株高产生物膜发酵乳杆菌的益生和抗逆特性,采用全基因组测序技术分析该菌株的抗性机理,为后续提高其应对不良环境能力的研究提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株 试验菌株为前期分离筛选的1 株高产生物膜发酵乳杆菌733(Lactobacillus fermentum 733),由内蒙古农业大学食品生物技术研究团队提供。
1.1.2 试剂 MRS 肉汤培养基,广东环凯微生物科技有限公司;胰蛋白酶、胃蛋白酶,美国Sigma公司;L-鸟氨酸、L-精氨酸、L-赖氨酸,北京酷来搏科技有限公司;蛋白胨水培养基、吲哚、硝酸盐培养基、碘化钾溶液、淀粉溶液,北京博迈德生物技术有限公司。
1.2 试验方法
1.2.1 供试菌液的制备 将菌株活化二代,取5 mL 菌悬液离心(4 000 r/min,4 min),弃上清,吸取5 mL 生理盐水吹打混匀,洗涤并离心,重复3 次。用紫外分光光度计调整菌悬液OD595nm值在1.0,即供试菌液[9]。
1.2.2 发酵乳杆菌733 生长量与生物膜生成量的测定 取1.2.1 节制得的供试菌液接入新鲜MRS中,接种比例为2%(体积分数),培养25 h,分别在4,7,10,13,16,19,22 h 和25 h 测定菌株生长量和生物膜生成量[10]。
1.2.3 发酵乳杆菌733 对人工胃肠液耐受性的测定 参考钟华晨等[11]的方法配制人工胃肠液,测定发酵乳杆菌733 对人工胃肠液的耐受性[12]。
1.2.4 发酵乳杆菌733 有害代谢产物的测定 参考魏朝治等[13]的方法对菌株进行吲哚、硝酸盐还原和氨基酸脱羧酶试验。
1.2.5 发酵乳杆菌733 抗逆性的测定
1.2.5.1 发酵乳杆菌733 对酸胁迫耐受能力的测定 将1.2.1 节制备的供试菌液分别接入pH 2.5,3.5,4.5,5.5,6.5(对照)的培养基中,37 ℃培养24 h,对处理的菌株进行活菌计数。
1.2.5.2 发酵乳杆菌733 对胆盐胁迫耐受能力的测定 将1.2.1 节制备的供试菌液分别接入胆盐质量浓度为0(对照),1,2 g/L 和3 g/L 培养基中,37 ℃培养24 h,对处理后的菌株进行活菌计数。
1.2.5.3 发酵乳杆菌733 对温度胁迫耐受能力的测定 将1.2.1 节制备的供试菌液分别接入新鲜的MRS 液体培养基中,培养温度分别设为4,10,37(对照),45,55 ℃和70 ℃,培养24 h,对处理后的菌株进行活菌计数。
1.2.5.4 发酵乳杆菌733 对盐胁迫耐受能力的测定 将1.2.1 节制备的供试菌液分别接入NaCl 质量浓度为0(对照),15,30,45 g/L 和60 g/L 的培养基中,37 ℃培养24 h,对处理后的菌株进行活菌计数。
1.2.6 微生物全基因组测序 提取发酵乳杆菌733 的DNA,对其浓度、纯度、样品总量以及样品完整性进行测定。当DNA 质检合格,即质量浓度≥50 ng/μL,OD260nm/280nm1.8~2.0,OD260nm/230nm2.0~2.2,单次建库总量≥5 μg,主带清晰且≥23 kB,无降解且无RNA 污染,方可进行后续试验。
样品检测合格后,进构建文库,质检合格后上机测序。
1.2.7 数据分析 每组试验重复至少3 次,每次设置3 组平行对照,用SPSS 19.0 和Origin 2021进行数据分析和作图。所有数值用“平均值±标准误差”表示,P〈0.05 表示差异显著。
使用Qubit 3.0 对测序文库进行定量;使用Agilent 2100 对文库大小进行检测;SMRT LINK 8.0 软件对下机文库进行数据处理,并采用pb_assembly_microbial(from smrtlink10)、hifiasm 软件和Canu(v2.2)软件对纯三代数据进行组装;Glimmer(v3.02)寻找发酵乳杆菌733 的编码基因。
2 结果与分析
2.1 发酵乳杆菌733 生长量与生物膜形成量
对发酵乳杆菌733 生长量以及生物膜生成量进行测定,结果如图1 所示。

图1 发酵乳杆菌733 生长量与生物膜形成量Fig.1 The growth and biofilm formation of L.fermentum 733
由图1 可知,发酵乳杆菌733 生长量随培养时间的增加呈先上升后持续平稳状态,而生物膜生长量随时间的增加呈先上升后下降再上升的趋势,符合生物膜形成的规律。生物膜的形成是积累的过程,25 h 时生物膜形成量最多,为0.527±0.111。往期研究中将生物膜生成量高于0.500 判定为高产生物膜,因此发酵乳杆菌733 为高产生物膜乳酸菌。
2.2 发酵乳杆菌733 对模拟人工胃肠液耐受性及有害代谢产物试验结果
发酵乳杆菌733 对模拟人工胃肠液耐受以及有害代谢产物分泌情况见表1。

表1 发酵乳杆菌733 在模拟人工胃肠液中存活率及有害代谢产物评价结果Table 1 The survival of L.fermentum 733 in simulated artificial gastric/intestinal fluid and evaluation results of harmful metabolites
测定发酵乳杆菌733 耐受模拟人工胃肠液的能力,结果发现,在模拟人工胃肠液中培养3 h,发酵乳杆菌733 存活率分别为(98.1±0.5)%和(98.1±1.2)%,具有较高活菌数。说明高产生物膜发酵乳杆菌733 可以耐受人工胃肠液,并保持较好活力。
鉴于一些益生菌在发酵过程中会分泌一些有毒的代谢物质,可能导致类似严重过敏反应的症状[14],本试验评估了发酵乳杆菌733 是否存在产生有害代谢产物。该菌株有害代谢产物结果均为阴性,说明其不产生可分解体内色氨酸的色氨酸酶,且代谢产物中不含使硝酸盐还原为亚硝酸盐的硝酸盐还原酶,或者能够分解氨基酸形成胺类物质的氨基酸脱羧酶。
综上所述,发酵乳杆菌733 可以耐受胃肠道环境且不会分泌有害代谢产物,是具有潜在益生特性的乳酸菌。
2.3 发酵乳杆菌733 抗逆性试验结果
对发酵乳杆菌733 耐酸、胆盐、温度、盐以及冷冻胁迫能力进行测定,结果如图2 所示。

图2 不同环境胁迫下发酵乳杆菌733 存活情况Fig.2 The survival of L.fermentum 733 under different environmental stresses
观察图2a 可以发现,在酸胁迫时,随着pH 值的上升,发酵乳杆菌733 活菌数呈上升趋势;pH 2.5 时菌株活菌数最低,说明强酸环境抑制菌株的生长。
胆盐胁迫时(图2b),随着胆盐浓度的增加,发酵乳杆菌733 活菌数呈先下降后轻微上升再下降的趋势;当胆盐质量浓度为2 g/L 时,菌株活菌数显著高于1 g/L 和3 g/L,这可能是由于胆盐的存在,刺激发酵乳杆菌733 生物膜的形成,使其大量分泌胞外多糖和蛋白质,在菌株细胞表面形成保护层,屏蔽胆盐,同时生物膜的存在可能介导物质交换及营养供给,从而提高菌株存活率[15]。当胆盐质量浓度为3 g/L 时,菌株活菌数显著降低,说明胆盐对生物膜的刺激作用有限,超出阈值后会严重抑制菌株的生长。
温度胁迫(图2c)时,菌株活菌数呈先上升后下降的趋势。低温胁迫会抑制菌株的生长,在4 ℃和10 ℃培养24 h 后,两组活菌数无显著差异;与对照组37 ℃相比,45,55 ℃和70 ℃培养均抑制菌株的生长,当培养温度70 ℃时,菌株全部死亡;当培养温度为45 ℃时,除对照组外,菌株活菌数显著高于其它菌株。该试验结果与Haddaji 等[16]的结果一致,推测其作用机理可能是由于在热应激下生长的发酵乳杆菌733 具有饱和脂肪酸和直链脂肪酸,它们可以适当提供膜功能所需的流动性,从而提高菌株对高温胁迫的耐受能力。
盐胁迫(图2d)时,随着NaCl 质量浓度的增加,发酵乳杆菌733 活菌数变化规律与胆盐胁迫时相似,当NaCl 质量浓度为30 g/L 时,菌株活菌数降到最低值,而当NaCl 质量浓度为45 g/L 时,菌株活菌数显著上升,且除对照组外,此浓度下发酵乳杆菌733 活菌数最高,这可能是由于高渗透性介质中生长时,菌株可以调节细胞内的渗透性以维持细胞伸长所必需的膨压。由于高渗环境导致菌株的休克,会激活某些特定的机制(例如,K+或兼容的溶质摄取/合成),防止细胞在含有高浓度盐的介质中死亡,如嗜酸乳杆菌和干酪乳杆菌,产生保护分子(主要是蛋白质),如DnaK 和HtrS操纵子蛋白,保护细胞免受盐诱导的损伤[17]。
综上所述,环境胁迫对发酵乳杆菌的生长有一定抑制作用,然而在一些条件下,环境胁迫会刺激菌株作出应激响应来保证菌株活力,超过一定阈值后,这些应激响应无法继续发挥作用,菌株生长受到严重影响。
为探究高产生物膜发酵乳杆菌733 抗逆性的作用机制,对其全基因组进行测序。
2.4 发酵乳杆菌733 全基因组测序分析
2.4.1 基因组组装与预测 由HiseqX-Ten 下PE150 模式对发酵乳杆菌733 进行测序,测序数据量为521 250,处理后的总序列长度为3 092 416 389 bp,平均序列长度为5 932.69 bp,N50 长度为7 810 bp。对三代数据进行组装,并对组装序列进行基因预测,结果见表2。

表2 最终组装结果序列和编码基因预测统计表Table 2 Table of the sequence statistics of the final assembly results and statistical statistics of coding genes
由表2 可知,发酵乳杆菌733 基因组为环状分子,序列总长度为2 146 209 bp,平均GC 含量为51.55%,腺嘌呤含量为24.50%,胸腺嘧啶含量为23.95%,鸟嘌呤含量为25.91%,胞嘧啶含量为25.64%,不确定碱基为0。同时获得编码基因2 151个,总长度1 852 353 bp,平均长度861.16 bp,占基因组大小的86.31%,GC 含量为52.76%。
2.4.2 基因组圈图分析 基因组圈图能够完整地显示基因在正、反链上的分布、COG 功能分类、GC含量、基因组岛和同源基因等。通过一幅完整的基因组图谱,将多种不同的资讯进行整合(此处表示GC 含量、GC 偏差、tRNA/rRNA、COG 注释、碱基修饰及限制修饰体系有关的酶类),可以更全面、直观地了解该菌的基因特性。发酵乳杆菌733 的基因组圈图例见图3。

图3 发酵乳杆菌733 基因组圈图Fig.3 The circle map of L.fermentum 733 genome
最外层的一圈表示基因组大小,表明发酵乳杆菌733 基因组是一个环形的分子,全长2 146 209 bp;第二和第三圈是正链和负链上的基因,其不同的色彩表示作用不同。COG 数据库,根据基因功能分为25 类。由图3 可知,A、B 和Y类,即RNA 加工与修饰、染色体结构、动力学和细胞核结构在发酵乳杆菌733 中未检出,胞外结构与细胞骨架基因检出数量也很少,可能是由于发酵乳杆菌733 为原核生物,缺乏真正的细胞核结构,且原核生物染色体结构和胞外结构简单,因此相关基因较少[18]。其余21 类中,翻译、核糖体结构和生物发生、氨基酸的转运和代谢、动员组:噬菌体原,转座子和仅一般功能预测基因数目位居前4,分别为188,185,179 和167;剩余类中,基因数目超过100 以上的有6 类,其余类型数量在10~100 之间,说明发酵乳杆菌733 基因组中,不同类型的基因具有不同的拷贝数,这与其执行任务的复杂性有关,也反映随时间的推移而进化的生物灵活性;第4 圈为tRNA 和rRNA,发酵乳杆菌733基因组中有58 个tRNA,15 个rRNA,分别由5 个5S rRNA、5 个16S rRNA 和5 个23S rRNA 组成;第5 圈是GC-skew 值,即G-C/G+C,从生物学角度来说,这个数值为正时,正链更容易转录CDS,为负值时则相反;第6 圈为GC 含量,向外的部分表示该区域GC 含量高于全基因组平均GC含量,峰值越高表示与平均GC 含量差值越大,反之则亦然,发酵乳杆菌733 基因组平均GC 含量为52.76%。
2.4.3 基因组的功能注释 对预测得到的编码基因进行蛋白序列注释(数据库为NR、SwissProt、COG、GO 和KEGG),所得注释结果如图4 所示。

图4 基础数据库共有和特有注释分析统计图Fig.4 Statistical map of the common and specific annotation analysis of the basic database
由图4 可知,在NR 数据库比到2 129 个基因,在SwissProt 数据库比到1 571 个基因,在COG 数据库比到1 817 个基因,在GO 数据库比到1 529 个基因,在KEGG 数据库比到1 237 个基因。下面对GO 和KEGG 数据库注释情况进行介绍。
在GO 数据库中注释情况如图5 所示。GO 数据库将蛋白序列分为三大类:生物过程BP、细胞组分CC 和分子功能MF,其中与BP 相关的基因种类和数量最多,其次是MF,与CC 相关的基因种类和数量最少。与BP 相关的基因共25 种,其中基因数目最多的是细胞过程类的基因,数量多达992 条,其次是代谢过程类的基因,数量也多达931 条。其余数量较多的还有应激反应和生物调节类的基因,数量均为151 条;生物过程调节类,有137 条。与MF 相关的基因共13 种,其中催化活性类基因,数量多达965 条,其次是附着类的基因916 条。CC 相关的基因共有3 种,其中数量最多的是细胞结构体类的基因,有884 条基因。从图5 还可看出,这些基因的作用涵盖了细胞新陈代谢的每个部分,而各基因具有不同的强度,表明细胞中不同生命进程的强度存在差异。
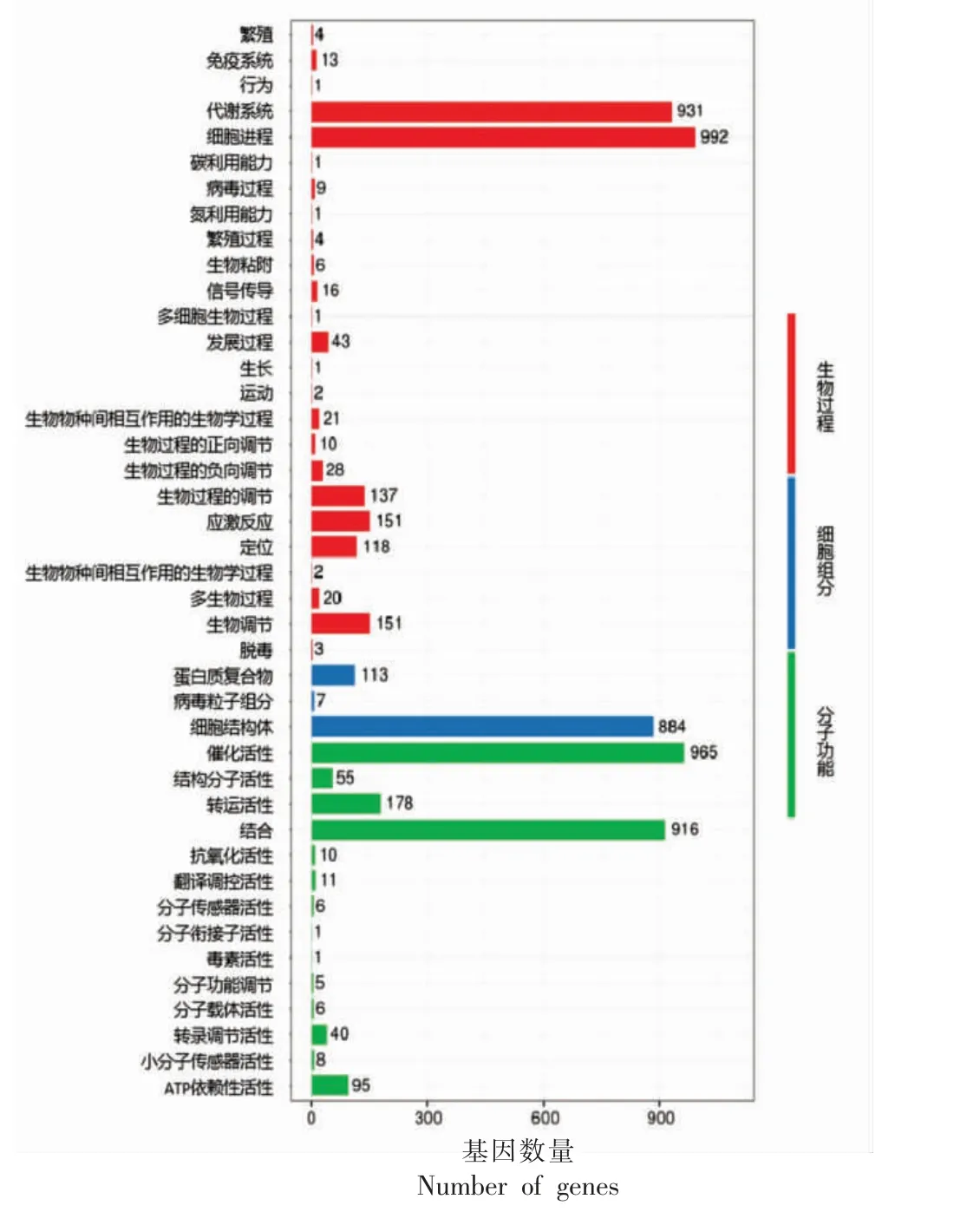
图5 GO Level2 分类水平注释分布图Fig.5 Distribution diagram of the GO Level2 classification-level annotation
在KEGG 数据库中注释情况如图6 所示。发酵乳杆菌733 编码基因在KEGG 功能注释中共分为6 大类,分别为代谢、遗传信息处理、环境信息处理、细胞过程、生物体系统和人类疾病,共有1 064 个基因38 个通路得到功能注释,具体结果如图6 所示。

图6 KEGG 层级二注释结果分类统计图Fig.6 Classification statistical map of KEGG hierarchical secondary annotation results
发酵乳杆菌733 在代谢途径层面特别是氨基酸代谢和碳水化合物代谢得到较多的基因功能注释。其中669 个基因在代谢通路上得到注释,占KEGG 中全部注释基因的62.88%。11 个代谢通路中,与多聚糖的生物合成和代谢通路有关的基因有37 个,脂质代谢有关基因45 个,核苷酸代谢有关的基因有75 个。107 个基因在环境信息处理层面得到注释,其中与膜运输有关的基因为54 个,与信号传导有关的基因53 个。
2.4.4 基于全基因组技术探究发酵乳杆菌733 抗逆性作用机制 前期试验中发现,发酵乳杆菌733 对不良环境有一定耐受能力,因此通过全基因组技术对其抗性机制进行探究。通过检索KEGG 数据库发现,发酵乳杆菌733 在环境胁迫时主要涉及以下基因的变化:trxA(orf00555,K03671)、perR(orf01604,K09825)、ctsR(orf1791,K03708)和argG(orf01908,K01940)。
研究发现,Trx 系统在许多生物中高度保守,由硫氧还蛋白还原酶(TrxR)、NADPH(还原型烟酰腺嘌呤二核苷磷酸)和Trx(硫氧还蛋白)组成[19],是一类广泛存在于原核和真核生物体内的蛋白质,具有维持细胞内硫醇基团的还原状态,参与广泛的细胞过程,包括核苷酸还原、硫同化、氧化应激反应和砷盐解毒。对乳酸乳球菌(Lactococcus lactis)中trxA 和trxD 基因进行敲除后发现这两种硫氧还蛋白在乳酸乳球菌中具有不同的抗逆功能。TrxA 参与菌株对氧化应激的反应,而TrxD 表现出对砷酸盐和碲酸盐的抗性起重要作用,具体机制尚不明确[20]。
PerR,属于Fur 家族(是一种控制铁载体和铁转运蛋白基因表达的铁敏感性阻遏蛋白),其功能主要是细胞的氧化应激应答,同时也能维持细胞内金属离子的稳态。PerR 包含两个金属结合位点,研究表明其中一个位点上的Zn2+可以被激活并与DNA 结合,通过Fe2+或Mn2+作为辅阻遏物可以产生两种形式的perR,分别为PerR:Zn,Fe 或PerR:Zn,Mn。因此大部分PerR 的调节基因会在细胞处于低水平H2O2或同时缺乏铁和锰的情况下发生阻遏效应[21]。
乳酸菌中,受CtsR 抑制因子调控的III 类基因保守性不高。这表明CtsR 是一种广泛的转录抑制因子,参与革兰氏阳性细菌的热休克调节,因此它被认为是细胞蛋白质质量的主要调节者,并控制与蛋白稳态有关的基因表达[22]。对植物乳杆菌WCFS1 中hrcA 和ctsR 基因分别敲除后发现,hrcA 和ctsR 基因的单一突变导致与转录调控、初级代谢、运输、结合和不同化合物的生物合成相关的不同基因的表达发生显著变化[23]。HrcA 和ctsR的缺失表明受压力相关调控基因影响的基因调控网络之间的串扰的复杂性[24]。
精氨酸代谢[25]及精氨酸脱亚胺酶途径[26]的调节作为酸胁迫响应在乳酸菌中被广泛报道。精氨酰琥珀酸合成酶(ASS)由argG 基因编码,可以催化瓜氨酸、天冬氨酸和ATP 产生精氨酰琥珀酸,是精氨酸合成和尿素循环的限速酶[27]。精氨酰琥珀酸裂解酶由argH 基因编码,可以催化精氨酰琥珀酸产生精氨酸[28],是尿素循环相关的重要酶,两个蛋白的合成均受到ArgR 蛋白的调控[29]。研究发现,argG[30]和argH[31]基因的转录和表达上调与干酪乳杆菌的酸胁迫响应有关。据报道,DNA 结合蛋白ArgR 在大肠杆菌(Escherichia coli)[32]、芽孢杆菌(Bacillus)[33]以及乳酸菌的精氨酸代谢调节中发挥重要的作用[34]。
综上所述,发酵乳杆菌733 在经历不同环境胁迫时,主要会对trxA、perR、ctsR 和argR 基因产生影响,然而这些基因通过哪些作用方式调控菌株抗逆性还有待研究。
3 结论
高产生物膜发酵乳杆菌733 在模拟人工胃肠液中有较高的存活率且不分泌有害代谢产物,是1 株具有潜在益生特性的乳酸菌。菌株在酸、胆盐、温度和盐胁迫环境中生长受到抑制。通过对其全基因组测序得出发酵乳杆菌733 基因组经组装后长度为2 146 209 bp,GC 含量为52.76%,共2 151 个编码基因,基因组中包含5 个5S 的rRNA,58 个tRNA。在KEGG 数据库中共注释到4 个与胁迫密切相关的基因,分别为trxA、perR、ctsR 和argG。
