锌离子络合法快速分离纯化荞麦壳黄酮及其抗AGEs 活性
2023-12-05王玥刘子琦聂萌滋李鹏程闫梦华朴春红肖盛元
王玥,刘子琦,聂萌滋,姜 鑫,李鹏程,闫梦华,朴春红*,肖盛元
(1 吉林农业大学食品科学与工程学院 长春130118 2 吉林农业大学中药材学院 长春130118 3 吉林农业大学教育部食药用菌工程研究中心 长春 130118)
荞麦(Fagopyrum esculentum)含有抗糖尿病、降血脂、降血糖和抗氧化等多种生物活性,被普遍加工成食药用产品[1-5]。荞麦壳是荞麦生产中最多的副产物,占据荞麦质量的三分之一[6],然而,其利用途径较少,大多作为废弃物被丢弃,没有得到充分的利用。研究发现,荞麦壳富含多种生物活性成分,如黄酮类化合物、荞麦糖醇、功能性蛋白、膳食纤维等[7-9],是天然产物开发的重要资源。
黄酮类化合物被广泛认为是荞麦壳中的主要活性成分,能够显著减轻糖尿病小鼠的胰岛素抵抗,改善脂质代谢紊乱[10],并抑制晚期糖基化终末产物(Advanced glycation end products,AGEs)形成,可通过调节AGE-RAGE 信号通路保护糖尿病小鼠肾脏[11]。生物活性物质的分离纯化在功能性食品和医药行业至关重要,直接影响产品的品质和价格。目前黄酮类化合物的分离纯化方法包括萃取、大孔树脂、膜分离、高效液相色谱等[12-13],存在纯化周期长、消耗大、成本高等缺点。金属离子络合法操作简单、快捷、成本低、周期短,在黄酮类化合物的分离纯化中具有良好的应用前景[14]。
金属离子络合法分离纯化黄酮类化合物的原理是:在碱性条件下,黄酮类化合物上的羟基易质子化,配合强配位的氧原子以及合适的空间构型,与部分金属盐络合形成稳定的沉淀,从而与其它可溶性杂质分离,利用更强的金属螯合剂,如乙二胺四乙酸二钠盐(EDTA-2Na),将络合态黄酮类化合物转化为游离态黄酮类化合物,达到黄酮类化合物分离纯化的目的[15]。含5-羟基或邻羟基的黄酮类化合物可与铅、铁、铜、锌等多种金属阳离子形成络合物,然而,铅污染环境,铁、铜等氧化能力过强,会破坏黄酮类化合物的结构[16]。锌离子是人体必需的微量元素之一,微量存在不会危害人体健康。残留的锌离子一般以络合态存在,研究发现,络合态的锌离子同样具有抗氧化、抗癌、抗糖尿病等生物活性[17-18]。
亚硝酸钠-三氯化铝(NaNO2-AlCl3)比色法和三氯化铝-乙酸盐(AlCl3-NaAC)比色法是用于总黄酮测定的主要化学方法,反应原理如图1 所示。前者是酚羟基位点,后者是3-羟基或5-羟基位点与铝离子发生显色反应[19]。由于植物提取物组成复杂,总黄酮的测定结果易受非黄酮类化合物的干扰,不同来源提取物的总黄酮测定方法亦有差别[20-21]。研究表明,与NaNO2-AlCl3法相比,AlCl3-NaAC 法更适合表征荞麦壳黄酮[22]。课题组前期研究表明,NaNO2-AlCl3法测定荞麦壳总黄酮含量的结果与高效液相色谱法的结果差异较大[23]。本研究选用AlCl3-NaAC 法,采用锌离子络合法分离纯化荞麦壳黄酮,优化其工艺参数。旨在提供一种快速分离纯化荞麦壳黄酮的方法,为其高效利用以及食药用产品的开发提供一定参考。
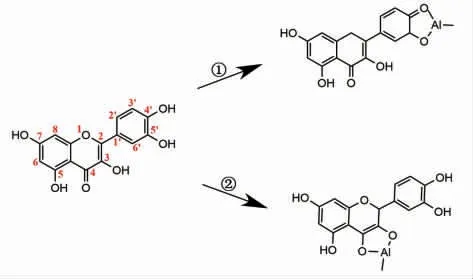
图1 化学比色法测定黄酮的反应原理Fig.1 Reaction principle of determination of flavonoids by chemical colorimetry
1 材料与方法
1.1 材料与试剂
荞麦壳购于内蒙古赤峰市。荞麦壳黄酮的提取参照赵梓瀛等[23]的方法,其荞麦壳黄酮提取物(Buckwheat hull flavonoids,BHF)的总黄酮含量为8.60 g RE/100 g(AlCl3-NaAC 法)和96.61 g RE/100g(NaNO2-AlCl3法),RE 表示芦丁当量。
Super 200 反相聚合物填料,南京亘闪生物科技有限公司;RP-C18 薄层硅胶色谱板,默克化工技术有限公司;甲醇(色谱纯),德国Meker 公司;牛血清白蛋白(Bovine albumin,BSA)、丙酮醛(Methylglyoxal,MGO),美国Sigma 公司;其余所用试剂均为国产分析纯级。
1.2 仪器与设备
Mini BIS Pro 荧光凝胶成像系统,以色列DNR 公司;Agilent 1100 高效液相色谱仪,安捷伦科技有限公司;FLUOstar Omega 荧光酶标仪,德国BMG LABTECH 公司。
1.3 方法
1.3.1 荞麦壳黄酮的分离纯化
1.3.1.1 分离纯化流程
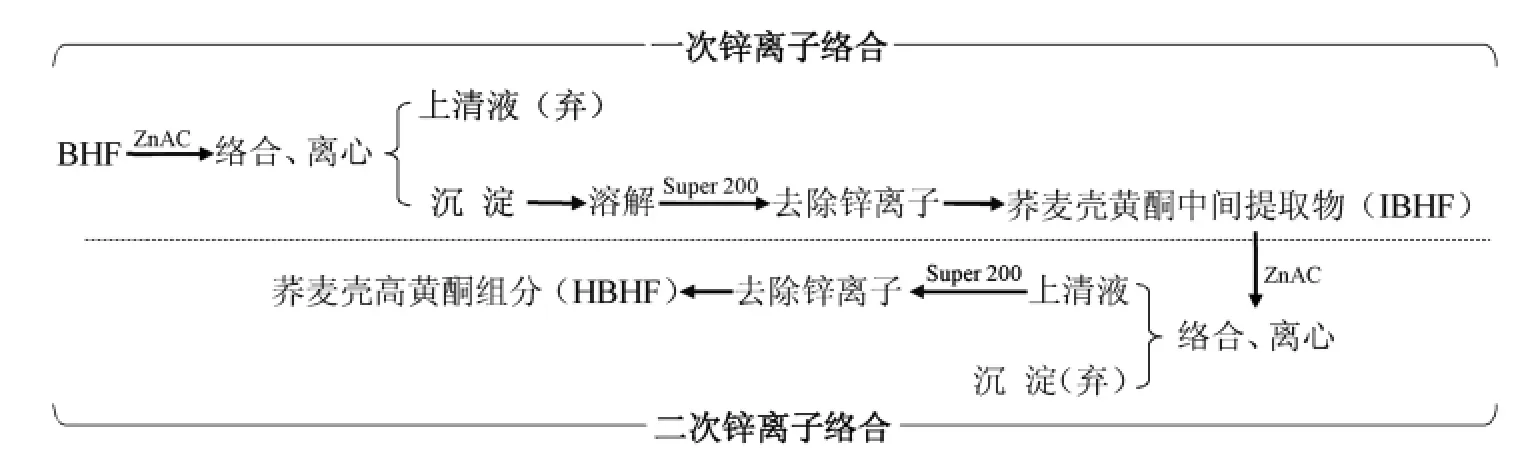
1.3.1.2 操作要点
1)一次锌离子络合 将BHF 溶解于乙醇,与乙酸锌溶液充分混匀,加入适量氨水调节pH,络合反应后,7 000 r/min 离心10 min,以上清液中剩余黄酮量计算黄酮络合转化率。沉淀经3%EDTA-2Na 溶液溶解(含10%乙醇),Super 200 柱层析富集、70%乙醇洗脱后,真空浓缩,冷冻干燥,获得荞麦壳黄酮中间提取物(Intermediates of buckwheat hull flavonoids,IBHF)。
2)二次锌离子络合 将IBHF 溶解于乙醇,与乙酸锌溶液按质量比2∶1,充分混匀,加入氨水调节pH,络合反应后,7 000 r/min 离心10 min,以硅胶薄层色谱检测上清液中的黄酮纯度。上清液经Super 200 柱层析富集、70%乙醇洗脱后,真空浓缩,冷冻干燥,获得荞麦壳高黄酮组分(High purity buckwheat hull flavonoids,HBHF)。
黄酮络合转化率以锌离子络合前、后溶液中的总黄酮含量计算,公式如下:
式中,C0——反应前溶液中的黄酮含量(mg/mL);V0——反应前溶液的体积(mL);C1——反应后上清液中的黄酮含量(mg/mL);V1——反应后上清液的体积(mL)。
1.3.2 IBHF 组分的分离纯化工艺参数优化
1.3.2.1 单因素实验 参照Wang 等[24]的方法,略作修改。分别配制4 mg/mL BHF 溶液与10 mg/mL乙酸锌溶液,络合反应一定时间,以络合转化率为指标,分别考察乙酸锌与样品质量比、氨水体积分数、乙醇体积分数、反应温度、反应时间对荞麦壳黄酮络合转化率的影响。试验因素水平见表1。
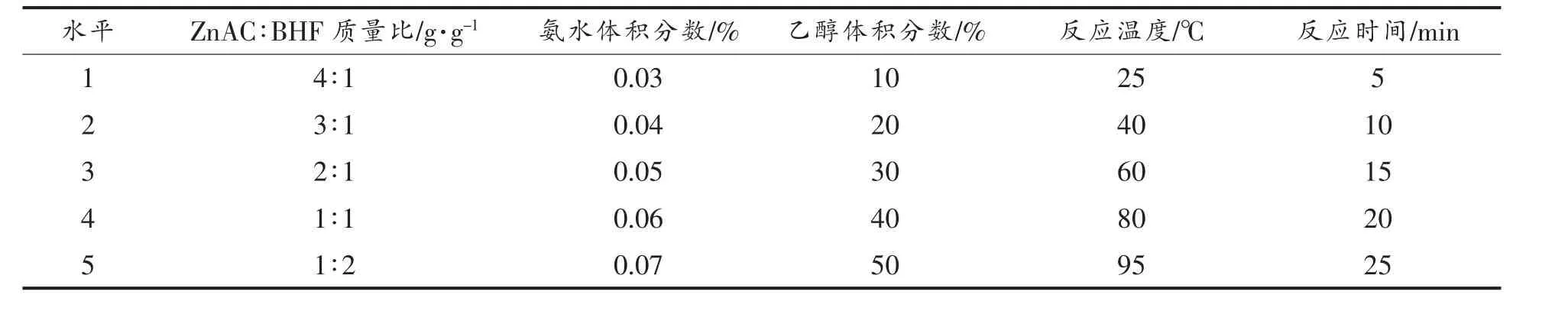
表1 单因素实验因素水平表Table 1 Factor level of single factor test
1.3.2.2 Box-Behnken 响应面优化试验 在单因素实验基础上,选取乙酸锌与样品质量比、氨水体积分数、乙醇体积分数为自变量,黄酮络合转化率为响应值,做Box-Behnken 响应面优化试验,试验因素水平如表2 所示。

表2 Box-Behnken 试验因素水平表Table 2 Factor level of Box-Behnken
1.3.3 荞麦壳黄酮检测方法
1.3.3.1 总黄酮含量测定 采用AlCl3-NaAC 法测定样品中的总黄酮含量,方法参照Sarker 等[25]的方法并略作修改。将500 μL 样品、1 mL 三氯化铝溶液(1 mmol/L)、1.5 mL 醋酸-醋酸钠缓冲溶液(pH 5.5)置于试管中,混匀后室温静置30 min,于417 nm 波长处测定吸光度值。以标准对照品芦丁的质量浓度为横坐标,对应的吸光度值为纵坐标,进行回归方程分析,回归方程y=2.882x+0.0411(R2=0.9993),荞麦壳总黄酮含量结果以g RE/(100g)表示。
1.3.3.2 硅胶薄层色谱 硅胶薄层色谱法是常用于黄酮类化合物鉴定的技术手段之一,分离后的样本经过不同的方法显色,可直观的判断样本中是否存在黄酮类化合物。
将样品用25%乙醇配成1 mg/mL 的溶液,取5 μL 依次点至同一块110 ℃活化30 min 的硅胶板上,展开剂为40%乙醇溶液,显色方式分别为10%的硫酸-甲醇溶液和254 nm 的紫外光,待样品在层析缸中展开完全后,风干,喷以显色剂烘干或直接置于紫外光下观察拍照。
1.3.3.3 紫外光谱 将样品配成0.02 mg/mL 的溶液,以25%乙醇为空白溶剂对照,用酶标仪进行全波长扫描,波长范围250~500 nm,扫描间距1 nm,扫描次数3。以波长为横坐标,对应的吸光度值为纵坐标,绘制紫外光谱。
1.3.3.4 HPLC 色谱柱:XTerra MS C18(3.9 mm×150 mm,5 μm);流动相A:0.5%甲酸铵和0.5%(体积分数)甲酸(pH 4.4~4.5),现用现配;流动相B:纯甲醇;流速0.5 mL/min,柱温25 ℃,检测波长280 nm,进样量20 μL。梯度洗脱程序:0~3 min,30%B;3~20 min,30%~85%B;20~23 min,85%~95%B,然后2 min 内恢复到初始状态,持续5 min。
1.3.4 AGEs 生成抑制能力 参照赵梓瀛等[23]的方法。制备Glu-BSA 体系与MGO-BSA 体系的AGEs,在激发波长360 nm 和发射波长460 nm 处检测荧光强度,考察荞麦壳黄酮样品对不同体系AGEs 的生成抑制能力。抑制率的计算公式:
式中,F0——空白组荧光值;F1——试验组荧光值;F2——对照组荧光值。
1.4 数据分析
试验结果用“x¯±SD”表示,所有数据均做3 个平行试验。用Excel 软件处理试验数据,用GraphPad Prism 7.0 制图与方差分析,P〈0.05 差异显著,具有统计学意义。
2 结果与分析
2.1 IBHF 组分的分离纯化工艺参数优化
以黄酮络合转化率为指标,选取乙酸锌与样品质量比、氨水体积分数、乙醇体积分数、反应温度和反应时间做单因素实验,结果如图2 所示。不同的乙酸锌与样品质量比、氨水体积分数和乙醇体积分数在测定范围内,络合转化率均呈先增长后下降的趋势(图2a~2c)。温度40 ℃以下时,络合转化率均可以维持在95.6%,而高于40 ℃时络合转化率反而下降(图2d)。络合反应5 min 内基本反应完全(图2e)。综合考虑,选择室温下反应10 min,以乙酸锌与样品质量比(A)、氨水体积分数(B)和乙醇体积分数(C)为自变量,络合转化率为响应值,做Box-Behnken 响应面优化试验。各因素交互作用响应面结果如图3 所示。使用Design-Expert 8.0.6 软件对试验数据进行回归分析,二次多项式回归方程为Y=0.97+0.13A+0.48B-0.31C-0.058AB+0.19AC+0.55BC-0.76A2-0.57B2-0.41C2,R2=0.9875。从表3 可看出,模型的F 值为61.64,P〈0.0001,达到极显著的水平。失拟向P=0.4307〉0.05,不显著,表明方程拟合良好,可用于荞麦壳黄酮络合过程参数的模型分析。
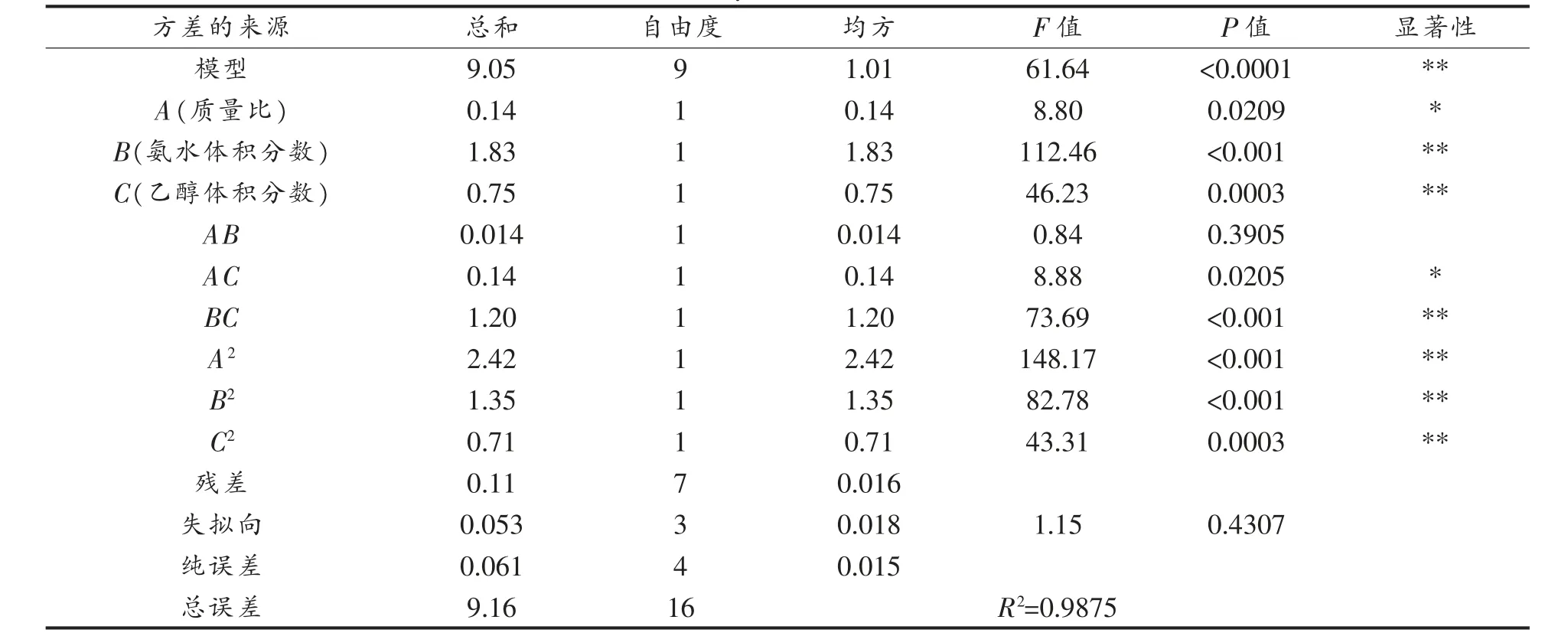
表3 方差分析结果Table 3 Analysis of variance results
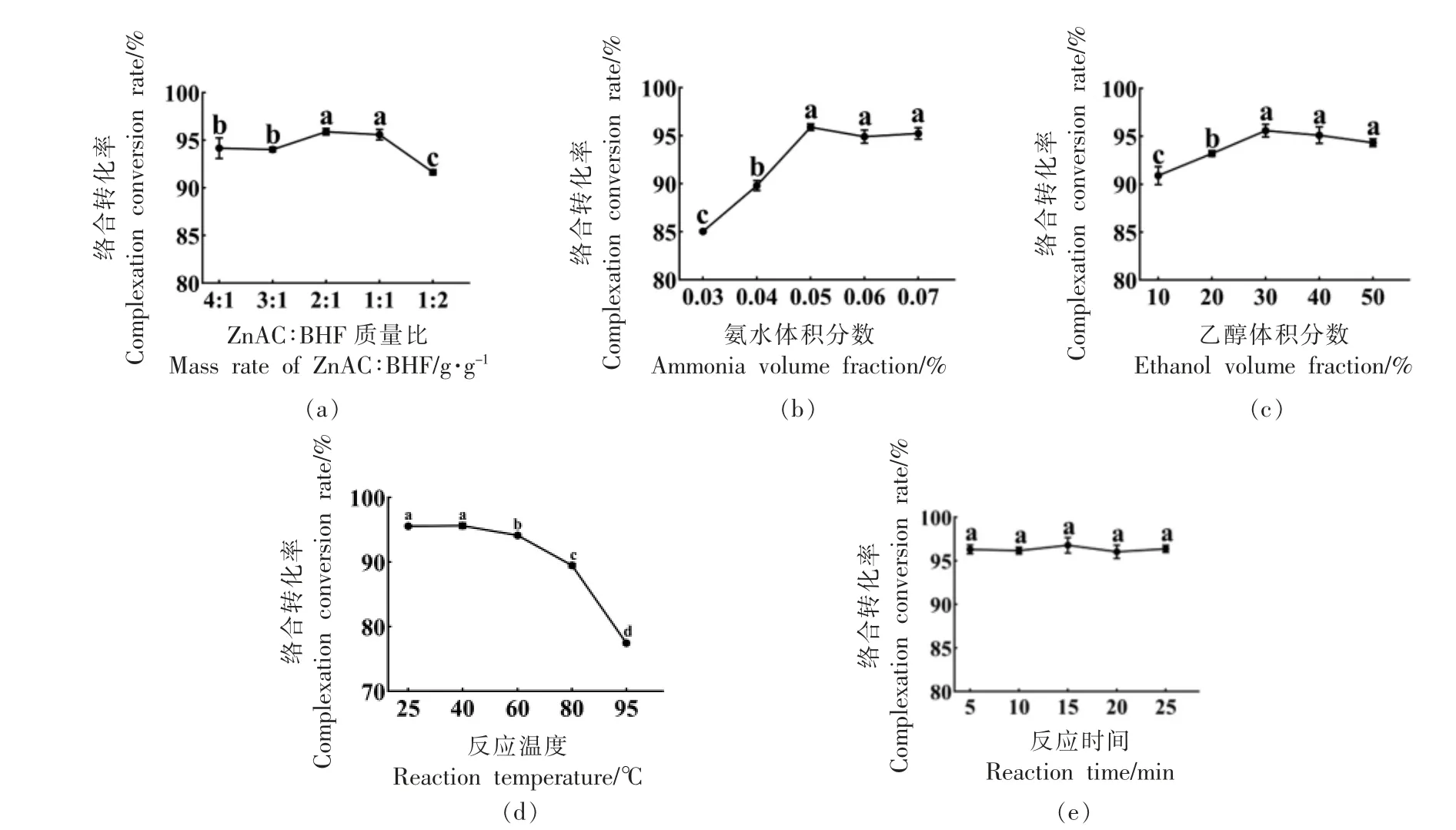
图2 不同质量比(a)、氨水体积分数(b)、乙醇体积分数(c)、反应温度(d)、反应时间(e)对荞麦壳黄酮络合转化率的影响Fig.2 Effect of mass ratio(a),ammonia volume fraction(b),ethanol volume fraction(c),reaction temperature(d),reaction time(e)on complex conversion rate of buckwheat hull flavonoids

图3 两因素交互作用对荞麦壳黄酮络合转化率的影响Fig.3 Effect of interaction between two factors on complex conversion rate of buckwheat hull flavonoids
由上述模型可知,荞麦壳黄酮中间提取物IBHF 的最佳络合条件为乙酸锌与样品质量比2 ∶1,乙醇体积分数30%,氨水体积分数0.05%,室温反应10 min。此条件下黄酮络合转化率为97.44%,验证试验得到黄酮络合平均转化率为97.51%,表明试验结果与模型吻合良好,Box-Behnken 响应面优化的工艺参数可行。在该条件下黄酮类化合物基本与锌离子络合并产生沉淀。林华婷等[26]报道乙酸锌络合鼠曲草黄酮的络合转化率为89.09%。雷永平等[27]报道刺玫果黄酮的络合转化率为96.94%。本研究黄酮络合转化率在97%以上,高于目前的报道。
2.2 IBHF 组分的二次锌离子络合
硅胶薄层色谱是鉴定黄酮类化合物较为简单的方法。在化学显色剂作用下,黄酮类化合物会出现黄色斑点。IBHF 组分的硅胶薄层色谱(图4a)结果显示,IBHF 组分中除黄酮类化合物外,还存在一类具有金属络合活性的非黄酮类化合物,严重干扰了荞麦壳黄酮类化合物的纯化。通过控制乙酸锌与样品质量比对IBHF 组分进行二次络合,从而使黄酮类化合物的分离。图4b 结果显示荞麦壳非黄酮类化合物与锌离子的络合强度大于黄酮类化合物,在锌离子量不足的情况下,非黄酮类化合物首先出现于沉淀中,而黄酮类化合物大部分留在上清液中。随着乙酸锌与样品质量比的增大,越来越多的黄酮类化合物出现于沉淀中。乙酸锌与样品质量比1∶2 是二者分离的关键点,此条件下只有少量黄酮类化合物与锌离子生成沉淀,黄酮类化合物与非黄酮类化合物可基本分离。

图4 IBHF 组分(a)及不同乙酸锌与样品质量比条件下二次锌离子络合IBHF 组分(b)的硅胶薄层色谱图Fig.4 Silica gel TLC of IBHF(a)and IBHF separated through secondary zinc ion complexation at different zinc acetate to sample mass ratios(b)
图5a 为HBHF 组分的锌离子络合程序,可呈现锌离子络合法对荞麦壳黄酮的纯化效果。一次锌离子络合后,IBHF 组分颜色与BHF 组分相近,为荞麦壳特有的棕褐色,而二次锌离子络合后,HBHF 组分颜色发生明显变化,呈黄酮类化合物特有的黄色。分离纯化过程中各组分的得率如图5b 所示,IBHF 组分得率为66.77%,去除了33.34%不具有金属络合活性的可溶性杂质,而HBHF 组分得率为18.23%,说明IBHF 组分中黄酮类化合物占比较少,其主要成分为具有金属络合活性的非黄酮类化合物。以上结果表明,通过二次锌离子络合,IBHF 组分中黄酮类化合物与非黄酮类化合物达到成功分离。

图5 BHF 组分的锌离子络合程序(a)及得率(b)Fig.5 Zinc ion complexation procedure(a)and yield(b)of BHF
2.3 HBHF 组分的黄酮鉴定分析
紫外光谱与硅胶薄层色谱是常用于黄酮类化合物鉴定的技术手段,不同结构的黄酮类化合物具有不同的紫外光谱,且在硅胶薄层色谱板上有不同的吸附位置。图6a 为紫外光谱结果,HBHF组分主要有291 nm 和349 nm 两个最大吸收波长处,与芦丁289 nm 和359 nm 处的两个特征吸收峰相近,表明HBHF 组分为黄酮类化合物。BHF组分与IBHF 组分的最大吸收波长仅出现在287 nm 处,属于非黄酮类化合物。吸附在硅胶薄层板上的黄酮类化合物在特定紫外光下会出现荧光点。图6b 显示BHF 组分中仅有一个微弱荧光点,而HBHF 组分中显现3 个突出的荧光点,说明BHF 组分中低丰度的黄酮类化合物在HBHF 中得到显著的富集。
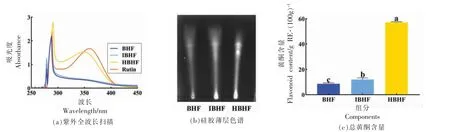
图6 HBHF 的黄酮鉴定分析Fig.6 Identification and analysis of flavonoids in HBHF
总黄酮含量(图6c)数值再次证明锌离子络合法纯化荞麦壳黄酮的适用性。BHF 组分的总黄酮含量为8.60 g RE/100g,IBHF 组分为12.09 g RE/100 g,HBHF 组分为57.08 g RE/100 g。一次锌离子络合虽受到具有金属络合活性非黄酮类化合物的干扰,但IBHF 组分的总黄酮含量仍提高了1.41 倍;二次锌离子络合分离获得荞麦壳高黄酮组分HBHF,总黄酮含量较BHF 组分提高了6.64倍。Wang 等[28]使用金属离子络合法纯化甘草黄酮,黄酮含量由36.47%增到63.56%,提高了1.74倍;Zhang 等[14]采用乙酸锌分离纯化银杏叶黄酮,黄酮含量由24%增到55%,提高了2.29 倍;Sun等[16]采用锌离子可快速有效地分离黄芩与干血斑(DBS)中的黄酮类化合物,成功去除背景物质。然而,金属离子络合法在纯化黄酮类化合物的应用中,未发现受到具有金属络合活性非黄酮类化合物干扰的报道。荞麦壳中除黄酮类化合物外,还含有单宁、膳食纤维、植酸、多糖等多种非黄酮类化合物[29-32],因存在羟基、羧基等活性基团,故与金属离子发生络合反应。
2.4 HBHF 组分的黄酮组成及其含量分析
荞麦壳高黄酮组分HBHF 的HPLC 分析结果见图7 和表4。HPLC 图谱结果(图7)显示HBHF组分中黄酮类化合物分离效果良好,主要观察到5 种黄酮化合物,分别为异荭草素、牡荆素、异牡荆素、芦丁和山奈酚-3-O-芸香糖苷,这与文献[33]提到的甜荞麦壳中黄酮组成相似。黄酮含量如表4 所示,芦丁是HBHF 中主要的成分,占比63.42%,其次是牡荆素、异牡荆素,异荭草素和山奈酚-3-O-芸香糖苷的含量较少。

表4 HPLC 法分析HBHF 组分的黄酮组成及含量(g/100 g)Table 4 Determination of flavonoids in HBHF by HPLC(g/100 g)
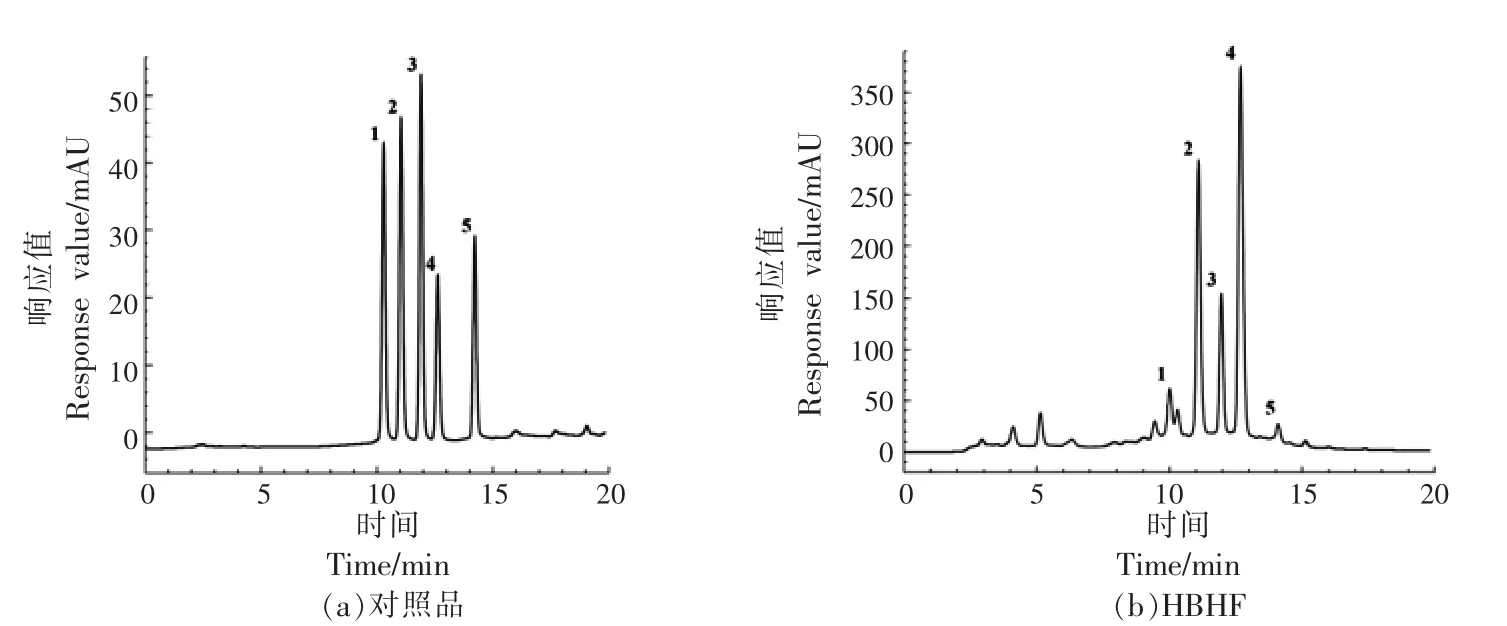
图7 对照品(a)与HBHF 组分(b)的HPLC 图谱Fig.7 HPLC chromatogram of standard(a)and HBHF(b)
黄酮类化合物与锌离子的结合位点主要以羟基和羰基为主,锌离子络合后黄酮的富集程度与其结构中活性基团的位置与数量有关[34]。HBHF 组分中主要包括黄酮化合物与黄酮醇化合物两种,牡荆素、异牡荆素、异荭草素为黄酮化合物,芦丁和山奈酚-3-O-芸香糖苷为黄酮醇化合物,黄酮醇化合物的基本结构较黄酮化合物多一个3-羟基取代位点,且取代基多为糖苷类化合物,提供了大量的羟基[35]。芦丁作为典型的黄酮醇化合物,较强的金属络合活性使其得到显著的富集,而山奈酚-3-O-芸香糖苷含量低可能与其在荞麦壳中含量较低有关[36]。
2.5 HBHF 组分的抗AGEs 活性
因AGEs 在内源性蛋白质糖基化和美拉德反应期间不可逆转地形成并与糖尿病密切相关,故抑制AGEs 生成对糖尿病的预防有重要意义[37]。Glu-BSA 与MGO-BSA 两个体系的AGEs 生成抑制能力如图8 所示,两个体系中,所有组别的AGEs 生成抑制率均呈剂量依赖性增长,荞麦壳高黄酮组分HBHF 显示较强的AGEs 生成抑制能力,且显著优于阳性对照氨基胍(Amino guanidine,AG)。当质量浓度为200 μg/mL 时,在Glu-BSA 体系中HBHF 组分的抑制率为63.16%,AG为46.94%;MGO-BSA 体系中,HBHF 组分的抑制率为42.98%,AG 为26.87%。天然植物的黄酮类化合物对AGEs 活性具有普遍的抑制作用,竹叶黄酮提取物能有效抑制体外AGEs 的形成,尤其是荧光AGEs,荭草素、异荭草素、牡荆素和异牡荆素等黄酮单体化合物在200 μg/mL 时,对Glu-BSA 体系AGEs 的抑制率均超过60%[38]。长叶多花植物黄酮也可显著抑制晚期糖基化终末产物的形成[39]。

图8 HBHF 组分对Glu-BSA 体系(a)、MGO-BSA 体系(b)AGEs 的生成抑制能力Fig.8 Inhibition of HBHF on the formation of AGEs in Glu-BSA system(a)and MGO-BSA system(b)
有趣的是,总黄酮含量为8.60 g RE/100 g 的BHF 组分同样显示较强的AGEs 生成抑制能力,且显著优于阳性对照AG,当质量浓度为200 μg/mL 时,Glu-BSA 体系的抑制率为58.49%,生成抑制能力略低于HBHF 组分,差异不显著;MGOBSA 体系的抑制率为38.16%,生成抑制能力显著低于HBHF 组分。以上结果表明,荞麦壳黄酮类化合物具有较强的抗AGEs 活性,然而,黄酮类化合物不是荞麦壳中唯一的活性物质,荞麦壳非黄酮类化合物同样具有较强的AGEs 生成抑制能力。今后对非黄酮类化合物的深入探究可为提高荞麦壳的附加值提供新的思路。
3 结论
首次应用二次锌离子络合法纯化荞麦壳黄酮,确定HBHF 组分的AGEs 生成抑制能力。采用Box-Behnken 响应曲面分析法获得荞麦壳黄酮中间提取物IBHF 的最佳工艺参数条件下的络合转化率为97.44%。IBHF 组分经二次锌离子络合分离获得荞麦壳高黄酮组分HBHF,其纯度较分离纯化前提高了6.64 倍,主要包含异荭草素、牡荆素、异牡荆素、芦丁、山奈酚-3-O-芸香糖苷5 种黄酮,其中芦丁占比62.34%。HBHF 组分对Glu-BSA 和MGO-BSA 两个体系中AGEs 生成的抑制能力均显著优于阳性对照氨基胍。本研究提供了一种快速分离纯化荞麦壳黄酮的方法,并对荞麦壳黄酮组成及AGEs 生成抑制能力进行分析,为荞麦壳活性成分与功能的开发提供了理论依据。
