不同蛋白酶对红娘鱼蛋白水解物的结构特性和生物活性的影响
2023-12-05胡学佳戴志远金仁耀张晓頔
胡学佳,戴志远,金仁耀,张晓頔,董 烨
(浙江工商大学海洋食品研究院 杭州 310035)
随着现代化捕捞技术的推广普及,大中型鱼类被大量捕获,导致生物链中的小杂鱼迅速繁殖起来[1]。2020 年世界水产总量达2.14 亿t,其中小杂鱼占捕捞量的49%[2]。如何处理这些量大质低的渔获物成为长期困扰水产加工业的主要问题。红娘鱼为小杂鱼的典型代表,具有体型小,生长繁殖速度快,蛋白质含量丰富等特点,其主要被制作成生鱼粉,用以水产养殖和陆地畜禽养殖[1],然而,由于加工技术落后,产品不仅得率和附加值低,还造成了严重的环境污染。近年来,越来越多的人开始利用生物活性肽改善身体健康或辅助治疗慢性疾病。海洋蛋白源成为开发生物活性肽的原料宝库,这也为解决杂鱼利用问题提供了新思路。
21 世纪是研究开发生物活性肽的黄金时代,各种具有特殊功效的活性肽被从不同食物蛋白质中分离出来,这些生物活性肽通常是由2~20 个氨基酸组成的短氨基酸链[3],并具有各种活性,其中抗氧化活性和降血压活性最受关注[4-5]。抗氧化肽可有效抑制自由基活性,人体内的自由基容易与DNA、RNA、脂质和蛋白质反应并破坏细胞结构,从而造成各种疾病[6]。有研究表明,癌症、冠心病和阿尔茨海默氏症与体内自由基有一定关系[7],因此抗氧化肽成为研究生物活性肽的重点。高血压影响着全世界约30%的成年人[8],其与心血管疾病,如心力衰竭、心肌梗死和过早死亡均有关系,每年因高血压死亡的人数高达940 万之多[9]。血管紧张素转换酶(ACE)抑制剂是治疗高血压最有效的方法[10]。目前临床常用的ACE 抑制剂有依那普利、赖诺普利、福辛普利等,然而其副作用明显,如炎症反应和皮肤疹等[11]。从食物蛋白水解物中获得高效安全的ACE 抑制剂受到人们的追捧。
制备生物活性肽的方法主要分为直接提取法、化学合成法和酶解法3 种。直接提取法产物产率低,费时费力且难以产业化;化学合成法操作复杂、成本昂贵;酶法水解法反应条件温和、可控、产物产率高且能耗低,是提取蛋白质水解物最常用的方法。目前很多蛋白酶均被用于制备生物活性肽,例如:木瓜蛋白酶、碱性蛋白酶、胃蛋白酶、中性蛋白酶、复合蛋白酶等。在酶解过程中,不同蛋白酶会特异性识别不同的酶切位点,释放出不同序列、大小和功能的多肽。因此蛋白酶的选择是影响酶解产物生物活性最主要的因素。
本研究以红娘鱼为原料,利用木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、风味蛋白酶和复合蛋白酶对其进行酶解,分析不同蛋白酶对水解产物的影响,包括其分子结构变化情况,如分子质量和二级分子结构组成等,以及其生物活性的变化,如ACE抑制活性和抗氧化活性,以期为红娘鱼的多元化生产应用中提供理论支持。
1 材料与方法
1.1 材料与试剂
1.2 仪器与设备
E2695 高效液相色谱,美国Waters 公司;HITACHI L-8900 氨基酸全自动分析仪,日本日立公司;EVOLUTION 60S 紫外分光光度计,美国Thermo Fisher 公司;DSHZ-300A 旋转式恒温振荡器,太仓市实验设备厂;400Y多功能粉碎机,永康市铂欧五金制品有限公司;Fresco 21 冷冻高速离心机,美国Thermo Fisher 公司;DGG-9123A 电热恒温鼓风干燥箱,上海森信实验仪器有限公司;QL-8bb-253 旋涡振荡器,海门市其林贝尔仪器制造有限公司。
1.3 试验方法
1.3.1 红娘鱼蛋白水解物的制备 将新鲜红娘鱼去除鱼骨、鱼皮及其结缔组织。将鱼肉切成小块并使用绞肉机搅碎,冷冻干燥至恒重并粉碎成粉末。向225 mL 蒸馏水中加入30 g 鱼肉粉,然后以8 000 r/min 均质60 s 后,分别以8 000 U/g 的比例加入木瓜蛋白酶、中性蛋白酶、复合蛋白酶、碱性蛋白酶和风味蛋白酶。酶解过程中通过0.1 mol/L HCl 和NaOH 来保持酶解液的最佳pH。反应结束后,95 ℃加 热10 min 灭 酶,8 000 r/min 离 心10 min。取上清液冷冻干燥并储存在-20°C,待用。
1.3.2 分子质量分布 根据蒋腾川等[12]的方法测定分子质量分布,并稍作修改。利用高效液相色谱仪测定红娘鱼水解物的分子质量分布。其中,色谱柱 为TSKgel G2000-SWx1(7.8 mm×300 mm,Tosoh),检测器为UV/Vis,进样量10 μL,流动相由体积比为45∶55 的A 液和B 液组成,其中A 液为乙腈,B 液为0.1%TFA,等度洗脱,流速0.5 mL/min。待测样品质量浓度为10 mg/mL,0.45 μm 的滤膜过滤,按照上述分析条件进行检测,根据校准曲线计算样品相对分子质量及其分布范围。称取适量标准品抑肽酶(6 500 u)、细胞色素C(12 400 u)、碳酸酐酶(29 000 u)和HHL(429 u)配制成质量浓度为5 mg/mL 的溶液,进行检测并绘制标准品谱图。
1.3.3 氨基酸组成 称取样品10~20 mg,加入6 mL/min 盐酸,110 ℃水解24 h,制得水解液,将其过滤离心,用自动氨基酸分析仪L-8900 型分析上清液的氨基酸组成[13]。
1.3.4 水解物结构表征
1.3.4.1 紫外全波长扫描 将待测样品用0.01 mol/L PBS(pH 7.0)配制为1.0 mg/mL 的溶液,将其加入狭缝比色皿至体积的2/3,在扫描波长200~500 nm,采样间隔1 nm 的条件下进行紫外全波长扫描[14]。
1.3.4.2 傅里叶变换红外(FTIR)光谱 称取10 mg 的样品粉末与0.1 g 的KBr 混合研磨放入模具中,利用油压机加压成透明薄片,在扫描范围400~4 000 cm-1,分辨率4 cm-1的采集条件下测定傅里叶变换红外光谱,并使用Omnic 和Peakfit 软件处理谱图[15]。
1.3.4.3 内源荧光光谱测定 将样品溶解于0.01 mol/L pH 7.0 的PBS 中,制得质量浓度为1.0 mg/mL 的溶液,进行荧光光谱测定。荧光光谱的分析参数为激发波长290 nm,扫描波长范围300~500 nm,狭缝宽度5 nm[16]。
1.3.5 ACE 抑制率测定 取40 μL 的样品溶液,与100 μL 6.5 mmol/L HHL 混合均匀并于37 ℃孵育10 min,随后加入20 μL 的ACE,混合均匀并于37 ℃反应30 min,最后加入85 μL 的1 mol/L盐酸,终止反应,用0.45 μm 滤膜过滤,制得最终反应产物,于HPLC 系统自动进样分析[17]。色谱条件:色谱柱SunFire C18(4.6 mm × 250 mm,5 μm);检测器UV/Vis;进样量10 μL;流动相70%TFA 水溶液(0.1%,V/V)-30%乙腈,流量为0.8 mL/min,按式(1)计算ACE 抑制率:
式中,A——用纯水代替酶解物参与反应条件下所产生的HA 的峰面积(mAU·min);B——酶解物参与反应的条件下所产生的HA 的峰面积(mAU·min)。
1.3.6 抗氧化活性测定
1.3.6.1 ·OH 清除能力的测定 采用水杨酸法测定不同蛋白酶水解物的·OH 清除能力。取0.1 mL样品分别加入0.05 mL 的9 mmol/L FeCl2溶液和9 mmol/L 水杨酸-乙醇溶液,最后加入0.05 mL 8.8 mmol/L H2O2溶液启动反应,振荡混匀后于37℃条件下,反应30 min,测定510 nm 波长处的吸光值[14]。根据式(2)计算·OH 清除率:
式中,A1——样品的吸光值;A2——50 μL 超纯水代替FeCl2溶液测得的吸光值;A3——200 μL 超纯水代替样品溶液测得的吸光值。
1.3.6.2 DPPH 自由基清除率的测定 取1.5 mL样品溶液与DPPH 溶液(1 mL,1 mmol/L,溶于95%乙醇)混合均匀,室温反应30 min,于517 nm波长处测定吸光值。样品的吸光度越低说明其自由基清除率越高[18]。根据式(3)计算DPPH 自由基清除率:
式中,A1——样品的吸光度;A2——95%乙醇与样品反应的吸光度;A3——蒸馏水与DPPH 溶液反应的吸光度。
1.3.6.3 Fe2+螯合活性的测定 取3.7 mL 样品溶液与FeCl2溶液(0.1 mL,20 mmol/L)混匀,室温反应3 min,加入Ferrozine(0.2 mL 5 mmol/L)已停止反应,室温孵育10 min 后,在562 nm 波长处测定吸光值[19]。根据式(4)计算Fe2+螯合活性:
式中,A1——样品的吸光值;A2——超纯水代替样品溶液测得的吸光值。
1.4 数据处理
每组试验重复3 次,将试验结果用“平均值±标准偏差”表示,使用Design Expert 8.0 和Origin 2017 软件对数据进行分析处理。
2 结果与分析
2.1 分子质量分布
图1a 是标准品相对分子质量分布图,其标准曲线方程为y=-0.2025x+6.8751,R2=0.9758。5种蛋白酶水解产物的分子质量分布如图1b 所示。对照组的分子质量91.06%分布在〉10 000 u 的范围内,与其相比,酶解后的分子质量分布范围显著下降。研究表明,低分子质量肽比高分子质量肽具有更强的生物活性[17],因此分子质量分布〈1 000 u范围的肽段较其它分子质量的肽段生物活性要高。如图1 所示,木瓜蛋白酶、中性蛋白酶、复合蛋白酶、风味蛋白酶和碱性蛋白酶水解产物中〈1 000 u 的分子质量分布比例分别为33.29%,59.11%,66.11%,65.9%,88.2%。综上所述,碱性蛋白酶水解产物中低分子质量肽所占比例最多,推测红娘鱼蛋白中含有大量碱性蛋白酶特异识别的序列。根据酶解产物的分子质量分布,红娘鱼蛋白的酶解效率从大到小依次为碱性蛋白酶〉风味蛋白酶〉复合蛋白酶〉中性蛋白酶〉木瓜蛋白酶。
2.2 氨基酸组成
水解物的氨基酸组成直接影响其生物活性。不同酶水解产物的氨基酸含量如表1 所示,不同蛋白酶水解产物的氨基酸含量差异显著,对照组氨基酸含量为393.47 mg/g,木瓜、中性、碱性、复合和风味蛋白酶组的氨基酸含量分别为521.743,528.2,551.524,539.705,492.53 mg/g,试验组的氨基酸含量明显高于对照组,试验组又以碱性蛋白酶组氨基酸含量最高,碱性蛋白酶的切割位点有广泛特异性,可水解红娘鱼蛋白释放大量的氨基酸。蛋白酶种类不同其切割位点也会发生变化,因此水解产物中氨基酸的组成和含量也有所不同,其中碱性蛋白酶酶解产物中芳香族氨基酸(51.66 mg/g)、疏水性氨基酸(200.50 mg/g)含量较高,芳香族氨基酸是影响抗氧化能力的关键因素之一[20],疏水性氨基酸被认为显著提高ACE 抑制率[21]。
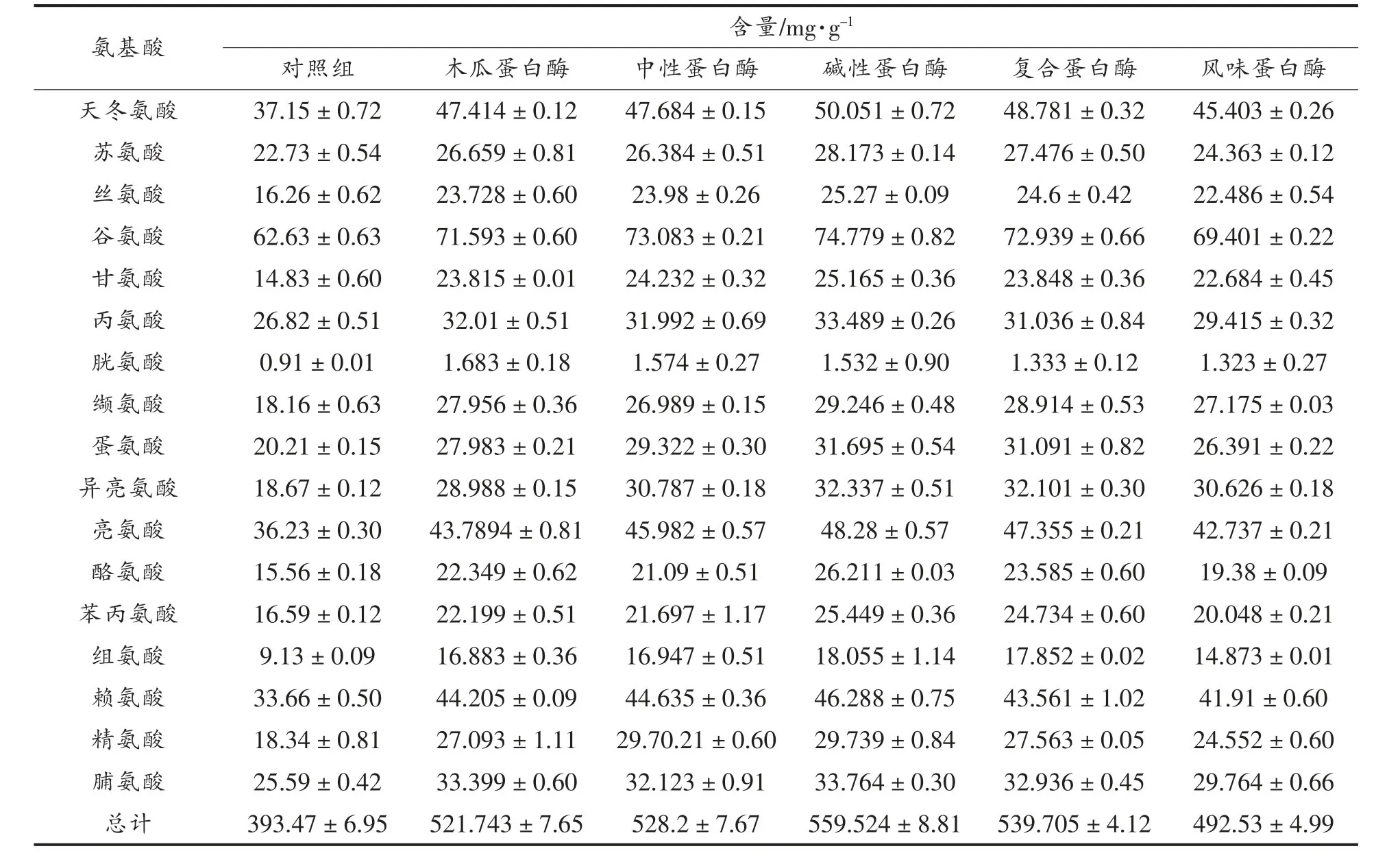
表1 不同蛋白酶水解产物的总氨基酸组成Total 1 Amino acid compositions of hydrolysates with different proteinases
2.3 水解物结构表征
2.3.1 紫外全波长扫描 用紫外光谱法检测了不同蛋白酶水解物,其吸收光谱如图2a 所示。6 组样品在275 nm 波长附近均有吸收峰,未处理、木瓜蛋白酶、中性蛋白酶、风味蛋白酶、碱性蛋白酶和复合蛋白酶组最大吸收峰值分别为0.63,0.81,0.93,0.84,0.97,0.86。有研究表明,Tyr 和Trp 的吸收峰在280 nm 附近[22],而各组酶解产物的峰值波长均小于280 nm,说明部分Tyr、Trp 与水解产物中肽形成了偶联双键,增加了275 nm 波长附近的紫外吸收。Tyr 和色氨酸经常存在于蛋白质的疏水内部[23],酶解过程通过暴露更多的疏水基团,改变了水解物的最大吸收波长偏移。碱性蛋白酶组的吸光度强度显著高于其它组,这表明蛋白酶不同则其酶切位点不同,进而影响酶解产物的一级结构。
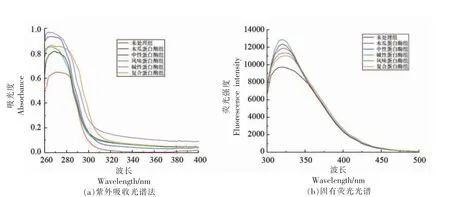
图2 红娘鱼酶解产物的结构特征Fig.2 The structural characteristics of Lepidotrigla microptera hydrolysates
2.3.2 内源荧光光谱 荧光光谱主要用来反映蛋白质中芳香族氨基酸的含量,通过测定水解产物中色氨酸残基在348 nm 波长处产生荧光强度的变化来反映不同蛋白酶水解产物三级结构的变化。如图2b 是不同蛋白酶水解产物的荧光光谱,荧光强度由大到小是碱性蛋白酶组〉中性蛋白酶组〉木瓜蛋白酶组〉风味蛋白酶组〉复合蛋白酶组〉未处理组。碱性蛋白酶水解液的荧光强度均高于其它组,说明碱性蛋白酶水解物有更多的蛋白分子结构展开并将包埋在蛋白中的色氨酸残基暴露在水解液中,同时有更多蛋白酶结合位点显露出来,导致酶解速度加快。
2.3.3 傅里叶变换红外(FTIR)光谱 FTIR 可以直观的反映待测物质的分子结构,光谱图中的吸收峰和分子中各官能团振动相对应[24]。5 种蛋白酶水解产物在4 000~400 cm-1范围内的特征吸光度带如图3 所示。6 组样品在范围3 650~3 200 cm-1内均有吸收峰,其中对照组和木瓜蛋白酶水解物的峰形最宽,说明其分子聚合物中可能存在大量的分子内或分子间氢键力[25]。对照组在2 926 cm-1有一条吸收带,这由-CH 拉伸振动产生。不同蛋白酶水解物在2 938 cm-1处均有一条吸收带,说明脂肪链的组成发生了变化,这表明在酶水解过程中,水解物内部的疏水区发生了变化。
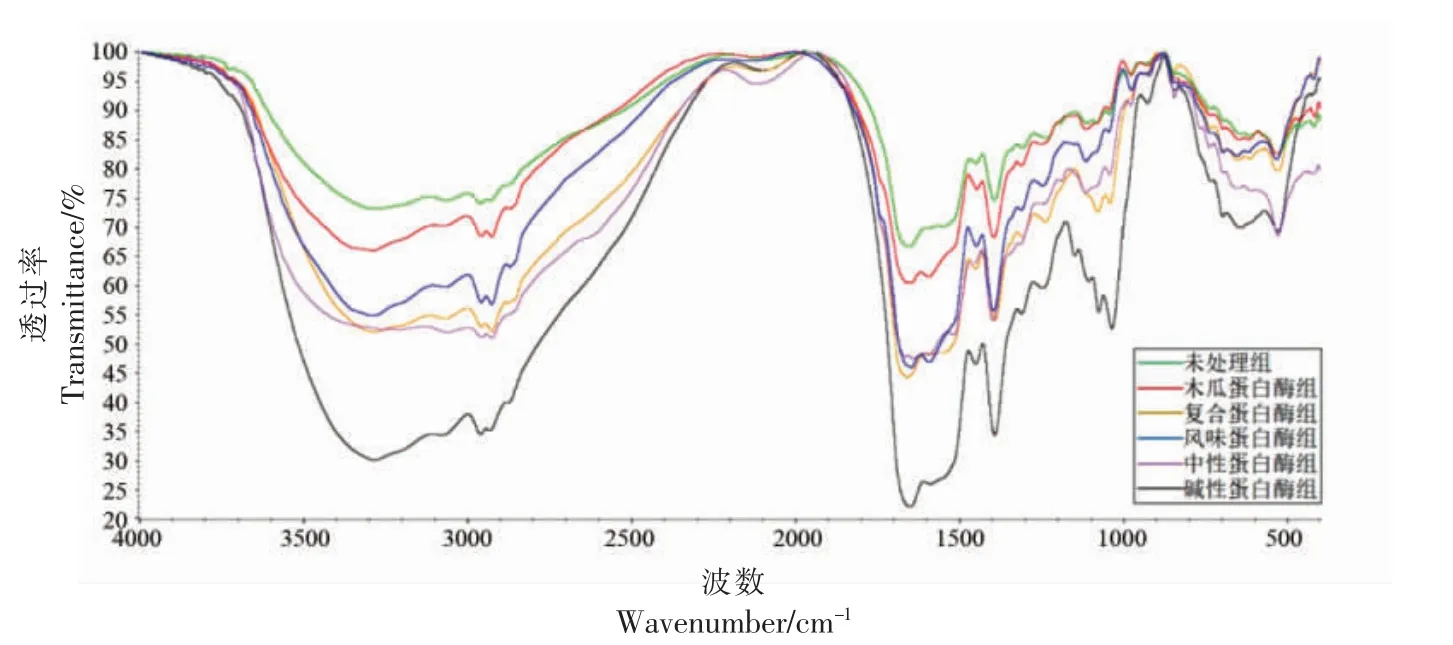
图3 红娘鱼酶解物的傅里叶变换红外(FTIR)分析光谱Fig.3 Fourier transform infrared(FTIR)spectroscopy of Lepidotrigla microptera hydrolysates
通过软件分析不同蛋白酶水解产物的二级结构组成,结果如表2 所示。与对照组相比,经不同蛋白酶处理后各组水解产物的β-转角比例均增加且所占比例较高,分别是57.13%(木瓜蛋白酶)、56.09%(中性蛋白酶)、62.58%(复合蛋白酶)、69.68(碱性蛋白酶)和61.76(风味蛋白酶),各组水解产物的α-螺旋比例降低分别为19.67%(木瓜蛋白酶)、18.73%(中性蛋白酶)、18.65%(复合蛋白酶)、16.62%(碱性蛋白酶)和17.11%(风味蛋白酶)。各组蛋白酶水解物的二级结构中β-转角和无规则卷曲所占比例均有所增加,且是主要组成部分。Yong 等[26]报道β-转角和无规则卷曲与α-螺旋和β-折叠相比稳定性及结构紧密性较差,这说明蛋白酶破坏了红娘鱼蛋白的有序结构,进而使分子结构疏松开放。碱性蛋白酶组β-转角和无规则卷曲是各组中所占比例最高的,因此碱性蛋白酶更容易和红娘鱼蛋白结合,从而水解出更多生物活性肽。
2.4 ACE 抑制率
为了研究红娘鱼酶解产物的ACE 抑制率,本研究在样品不同浓度下检测ACE 抑制率,由表3可知,ACE 抑制率与样品浓度成正相关,既ACE抑制率随着样品浓度的增大而增加。ACE 抑制活性从大到小依次为碱性蛋白酶组〉中性蛋白酶组〉复合蛋白酶组〉风味蛋白酶组〉木瓜蛋白酶组,其IC50分别为0.77,0.98,1.4,1.8,2.31 mg/mL。

表3 红娘鱼酶解产物的ACE 抑制活性Table 3 ACE inhibitory activity of Lepidotrigla microptera hydrolysates
2.5 抗氧化活性
以·OH 清除能力、DPPH 自由基清除率的测定和Fe2+螯合活性为指标评价红娘鱼水解产物的体外抗氧化活性。如图4 所示,6 组样品的抗氧化能力与其浓度呈正比例增长,其中碱性蛋白酶组的抗氧化活性显著高于其它组,其·OH 清除能力、DPPH 自由基清除率和Fe2+螯合活性的IC50值分别为1.88,1.92,1.76 mg/mL。分析原因是碱性蛋白酶的酶切位点是C 末端疏水氨基酸,使大量疏水氨基酸暴露出来,因此其抗氧化活性高于其它组。Zhang 等[27]以鲢鱼鳍为原料,利用胰蛋白酶、碱性蛋白酶、中性蛋白酶和木瓜蛋白酶对其进行酶解,结果发现碱性蛋白酶产物具有显著的Fe2+螯合活性;Sinthusamran 等[28]将鲑鱼骨酶解后,碱性蛋白酶水解物的抗氧化活性和水解度显著优于其它组,这与本研究结果相一致。风味蛋白酶的抗氧化活性最低,表明其对红娘鱼蛋白特异性较低。
3 结论
本研究以红娘鱼为原料,研究5 种蛋白酶水解产物的结构特性、抗氧化活性和ACE 抑制活性。碱性蛋白酶水解物的低分子质量占比最高,疏水氨基酸含量最高,并且比其它组具有更强的抗氧化活性和ACE 抑制活性。综上所述,碱性蛋白酶水解红娘鱼制备生物活性肽可以作为功能性食品的潜在成分,此外,可分离纯化探索与抗氧化活性和ACE 抑制活性相关的肽序列,进一步研究其作用机制。
