玉米赤霉烯酮降解菌的筛选、培养条件优化及降解酶挖掘
2023-12-04熊东炜
文 钧 熊东炜 龙 淼
(沈阳农业大学动物科学与医学学院,重要家畜疫病研究教育部重点实验室,沈阳 110161)
玉米赤霉烯酮(zearalenone,ZEA)是由Stob等[1]从玉米中发现的一种由镰刀菌属真菌产生的次级代谢产物。ZEA作为一种常见的饲料及粮食污染物,不仅会给畜牧业带来巨大的经济损失,还会通过农产品对人体健康造成极大危害。因此,对ZEA污染的饲料和粮食进行脱毒非常重要。
脱毒的方法一般包括物理脱毒法、化学脱毒法和生物脱毒法,其中生物脱毒法包括微生物吸附、微生物降解和酶降解,该方法有效规避了物理脱毒法和化学脱毒法的缺点,并因其高效、稳定、安全环保和对食品品质影响小的特点,已成为目前公认的最优脱毒法。研究表明,有些微生物细胞壁中的特殊结构和物质使它们能够吸附ZEA,例如其中的碳水化合物(肽聚糖、甘露糖和葡聚糖)、蛋白质和脂质等,同时由于它们可能存在各种不同的吸附中心,因此可能涉及到各种吸附机制,包括氢键、离子相互作用或疏水相互作用[2]。微生物降解是指微生物在其生命活动的过程中产生某种产物,这些物质会改变ZEA的原始结构,并将其转化为低毒或完全无毒的物质[3]。目前已经发现了许多可以脱去ZEA的真菌和细菌,包括黑曲霉[4]、酵母菌[5]、芽孢杆菌、乳酸菌[6]和不动杆菌[7]等。此外,酶对ZEA的降解具有出色的特异性和较高的安全性,它的反应温和可控,效率比菌体吸附高,是未来ZEA脱毒应用中最具商业价值和最有效的技术手段。不过,对ZEA的酶促降解研究仍处于初级阶段,在发现和优化新降解酶方面仍然有很长的路要走[8]。
因此,本研究的主要目的是分离出一株可高效降解ZEA的菌株,通过对其生长特性和降解条件进行优化,初步分离鉴定降解酶,并探究该菌株降解毒素的可能反应,为后续纯化ZEA降解酶并应用于生产实践奠定基础。
1 材料与方法
1.1 试验菌株来源
本试验菌株选择来自沈阳农业大学动物科学与医学学院临床兽医实验室-80 ℃保存的25株菌,代号分别如下:A-1、A3、A10、B2、B4、B-7、B8、C-2、C253、C257、D-1、F6、FC、WY19、XY15、XY19、XY32、XY96、XY125、XY126、XY129、XY130、XY132、XY133和XY137。
1.2 试验材料与试验设备
试验试剂:ZEA,武汉瀚香生物科技有限公司提供;甲醇(分析纯),上海麦克林生化科技股份有限公司提供;LB肉汤、LB固体培养基、MRS培养基、NB培养基、BHI培养基、革兰氏染色试剂盒、磷酸盐缓冲液(PBS)干粉,北京索莱宝科技有限公司提供;TaKaRa Mini BEST Bacteria Genomic DNA Extraction Kit Ver 3.0,宝日医生物技术(北京)有限公司提供;2×Accurate Taq Master Mix(Dye Plus),湖南艾科瑞生物工程有限公司提供;聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)快速制备试剂盒(12.5%),上海雅酶生物医药科技有限公司提供。
试验仪器:LDZX-75KBS型高压蒸汽灭菌锅,SorvallTMLegendTMMicro 21R微量离心机,UltiMate 3000快速分离双系统液相色谱仪,ZORBAX SB-C18色谱柱,HZQ-B恒温培养摇床,Mini-PROTEAN®Tetra Biorad伯乐电泳仪,ChemiDOCXRS凝胶成像仪。
1.3 试验方法
1.3.1 ZEA降解菌株的筛选
将25种待测菌接种到LB肉汤中进行复苏培养。将复苏好的菌株加入含有ZEA的LB肉汤中,ZEA终浓度为5 μg/mL,进行菌株-ZEA共培养试验。样品在37 ℃、160 r/min的恒温摇床中孵育96 h,每组重复3次。样品中的ZEA残留量通过高效液相色谱(HPLC)法进行检测[9],色谱柱为ZORBAX SB-C18,流动相为80%甲醇,流速为1.0 mL/min,进样量20 μg/mL,柱温为30 ℃,波长为274 nm[3]。计算ZEA降解率,公式如下:
ZEA降解率=100×(对照样品ZEA浓度-
共培养样品ZEA浓度)/
对照样品ZEA浓度。
1.3.2 降解菌株的鉴定
形态学鉴定:将复苏好的降解菌菌液稀释106倍,取50 μL均匀涂布于LB固体培养基中,在37 ℃恒温培养箱中培养16 h,观察菌落形态;挑取培养好的单菌落进行革兰氏染色。
16S rDNA鉴定:使用DNA提取试剂盒提取降解菌株的DNA;降解菌株DNA扩增选用16S rDNA通用引物进行,上游引物为27F(5′-AGAGTTTGATCCTGGCTCAG-3′),下游引物为1492R(5′-ACGGCTACCTTGTTACGACTT-3′);反应体系为模版DNA 2.0 μL、27F 1.0 μL、1492R 1.0 μL、Taq Master Mix 25 μL以及ddH2O 21 μL;扩增程序为94 ℃预变性30 s,98 ℃变性10 s,55 ℃退火30 s,72 ℃延伸90 s,循环34次,72 ℃终延伸5 min。PCR产物经1.2%琼脂糖凝胶电泳120 V、40 min进行验证,将阳性条带的PCR样品送至生工生物工程(上海)股份有限公司进行测序,测序的结果在美国国家生物技术信息中心(NCBI)上进行序列比对,并利用MEGA-X构建系统发育树进行分析。
1.3.3 蔬菜芽孢杆菌(Bacillusoleronius)GX01培养条件优化
培养基条件优化:将复苏好的蔬菜芽孢杆菌GX01按1%接菌量分别接种至装有20 mL LB肉汤、20 mL MRS培养基、20 mL NB培养基和20 mL BHI培养基的50 mL锥形瓶中,在pH 7.0、37 ℃条件下160 r/min培养12 h。
生长曲线:将复苏好的蔬菜芽孢杆菌GX01按1%接菌量接种至装有20 mL LB肉汤的50 mL锥形瓶中,在pH 7.0、37 ℃条件下160 r/min培养45 h,分别在0、3、6、9、12、15、18、21、24、27、30、33、36、39、42和45 h取菌液样品。
pH:将复苏好的蔬菜芽孢杆菌GX01按1%接菌量接种至装有20 mL LB肉汤的50 mL锥形瓶中,将培养基的pH分别调整为3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0,并在37 ℃条件下160 r/min培养12 h。
温度:将复苏好的蔬菜芽孢杆菌GX01按1%接菌量接种至装有20 mL LB肉汤的50 mL锥形瓶中,将恒温培养箱的温度分别调整为25、30、37、40和45 ℃,并在pH 7.0条件下160 r/min培养12 h。
取上述菌液200 μL至96孔板中,通过酶标仪测定菌液的吸光度(OD)值,并进行记录。
1.3.4 蔬菜芽孢杆菌GX01降解ZEA条件优化
将复苏好的蔬菜芽孢杆菌GX01以1%接菌量接入250 mL LB肉汤中,在160 r/min、37 ℃下培养72 h。将ZEA加入活化菌液中,ZEA终浓度为5 μg/mL。
降解时间优化:上述样品用涡旋振荡器混合后放入37 ℃、160 r/min恒温摇床中,共同孵育24、48、72和96 h。
降解温度优化:上述样品用涡旋振荡器混合后放入160 r/min恒温摇床中,共同孵育72 h,恒温摇床温度分别设置为25、30、37、40和45 ℃。
降解pH优化:上述样品用涡旋振荡器混合后放入37 ℃、160 r/min恒温摇床中,共同孵育72 h,pH分别设定为3.0、4.0、5.0、6.0、7.0、8.0、9.0和10.0。
降解毒素浓度优化:将ZEA加入活化菌液中,ZEA终浓度分别为5、10、15和20 μg/mL,后用涡旋振荡器混合后放入37 ℃、160 r/min恒温摇床中,共同孵育72 h。
设立LB肉汤替代菌液的对照组,通过HPLC法检测ZEA残留量(峰面积),计算ZEA降解率,公式如下:
ZEA降解率=100×(对照样品ZEA浓度-
孵育样品ZEA浓度)/对照样品ZEA浓度。
1.3.5 蔬菜芽孢杆菌GX01降解ZEA活性物质定位
将活化好的蔬菜芽孢杆菌GX01菌液在8 000 r/min下离心10 min,上清液用0.22 μm针式滤器过滤后,取一部分备用,另一部分放入水浴锅100 ℃ 15 min备用。沉淀菌体用PBS冲洗后,取一部分菌体进行破碎,8 000 r/min离心10 min,破碎菌体上清液用0.22 μm针式滤器过滤,破碎菌体用PBS冲洗,另一部分放入高压蒸汽灭菌锅121 ℃ 30 min高压后备用。上述样品中加入ZEA(5 μg/mL)孵育72 h,检测ZEA残留量(峰面积),计算ZEA降解率。在上述试验的基础上,取降解率最高的部位添加十二烷基硫酸钠(SDS)(终浓度1%)和蛋白酶K(1 mg/mL),并与ZEA(5 μg/mL)共同孵育72 h,检测ZEA残留量(峰面积),计算ZEA降解率。
1.3.6 粗酶液降解效果
将复苏好的蔬菜芽孢杆菌GX01以1%接菌量接入3份含有250 mL LB肉汤的锥形瓶中,在160 r/min、37 ℃条件下培养72 h。采用硫酸铵(80%)沉淀法提取蔬菜芽孢杆菌GX01上清液中的粗酶液,透析和超滤后进行蛋白质浓度检测。将粗酶液与ZEA(5 μg/mL)共同孵育。此外,还对粗酶液进行100 ℃煮沸15 min和蛋白酶K(1 mg/mL)处理。上述样品充分混匀后放入37 ℃、160 r/min的恒温摇床中孵育72 h。通过HPLC法检测ZEA残留量(峰面积),计算ZEA降解率。
1.3.7 金属离子对粗酶液降解ZEA的影响
样品中分别加入钠离子(Na+)、亚铁离子(Fe2+)、铁离子(Fe3+)、铜离子(Cu2+)、钾离子(K+)、锰离子(Mn2+)、镁离子(Mg2+)、钙离子(Ca2+)、锌离子(Zn2+)和乙二胺四乙酸(EDTA),终浓度为100 mmol/L,充分混匀后放入37 ℃、160 r/min恒温摇床中,共同孵育72 h。通过HPLC法检测ZEA残留量(峰面积),计算ZEA降解率。
1.3.8 粗酶液液相色谱-串联质谱(LC-MS/MS)蛋白条带检测
取20 μL粗酶液点入胶板的凹槽中,将电泳仪设定为80 V 60 min、120 V 60 min。电泳结束后通过考马斯亮蓝染色与脱色显示蛋白条带,并将全蛋白条带切下装入含有ddH2O的EP管中,委托深圳华大基因科技有限公司进行LC-MS/MS氨基酸测序。
2 结果与分析
2.1 ZEA降解菌株的筛选
如图1所示,在25种菌株中,B4、F6和XY133对ZEA的脱毒效果较好,其中F6脱毒效果最优,ZEA降解率为75.9%(图1-A),因此,后续试验选择降解率最高的F6进行研究。HPLC法检测的结果表明,对照组中ZEA的检测峰出现在5.21 min(图1-B);而在相同的出峰时间内,F6共培养组ZEA的检测峰面积明显减小(图1-C)。以上结果证明F6对ZEA具有良好的降解作用。
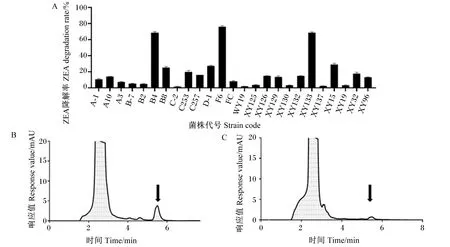
A:25种菌株对ZEA的降解率;B:对照组高效液相色谱图;C:F6共培养组高效液相色谱图。A: degradation rates of ZEA by 25 strains; B: HPLC chromatogram of control group; C: HPLC chromatogram of the F6 co-culture group.图1 降解菌株筛选Fig.1 Degradative strain screening
2.2 降解菌株的鉴定
如图2所示,F6菌株在LB固体培养基上为乳白色圆形菌落,边缘整齐,表面光滑,菌落中心有圆形凸起,不透明(图2-A)。显微镜下革兰氏染色为阳性菌,菌体成杆状,排列不规则(图2-B)。序列系统发育进化分析发现,F6与蔬菜芽孢杆菌55N3-2、30N2-10、PD3、C13DMVR和PCSB2菌株属于同一分支(图2-C),序列同源性最高,且与蔬菜芽孢杆菌GX01(GenBank登录号为KP297896.1)的16S rDNA相似度为99.86%。综上结果确定,该菌株为实验室前期分离的蔬菜芽孢杆菌GX01。
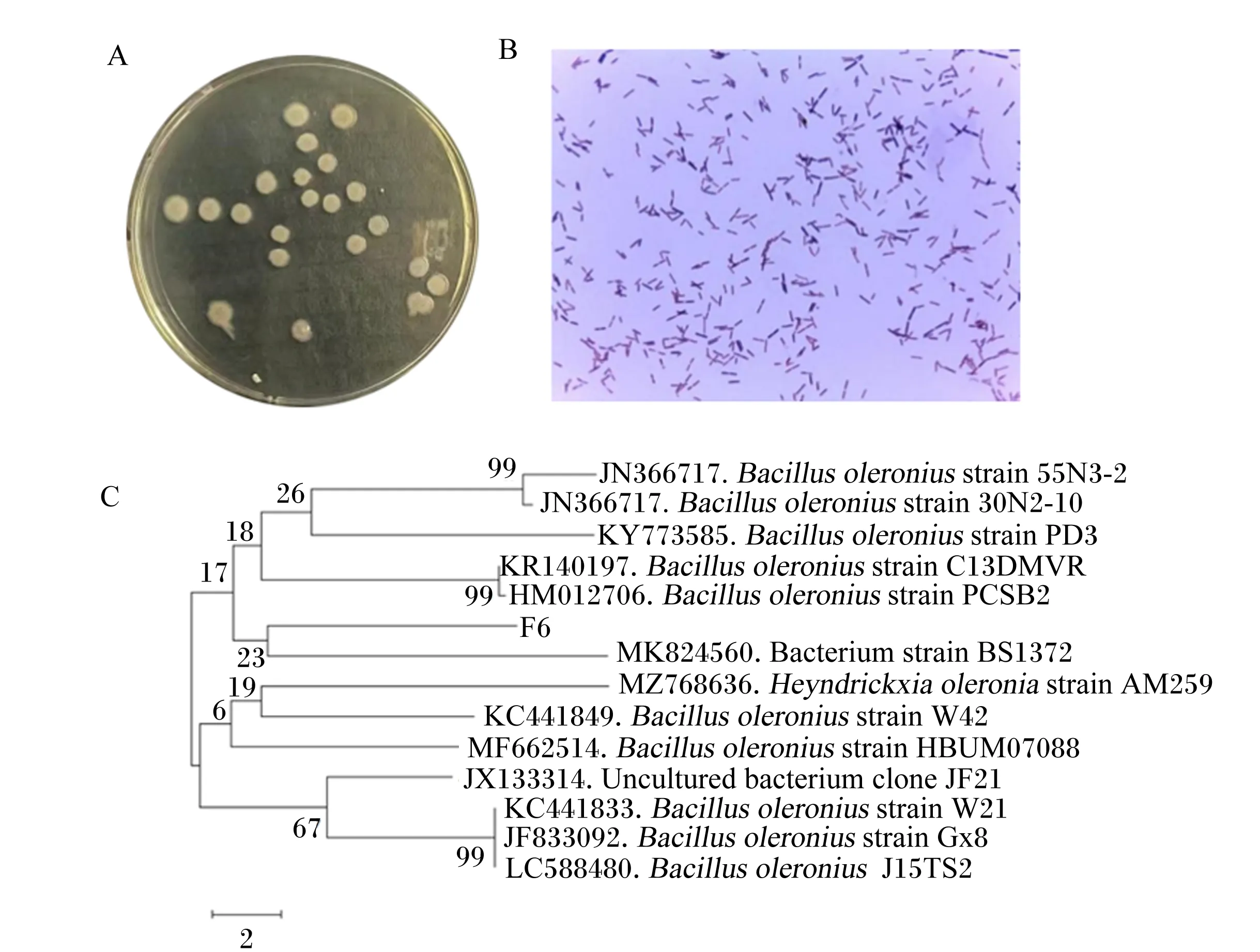
A:F6菌落形态(48 h);B:F6细菌革兰氏染色(10×100);C:F6序列系统发育进化树。A: F6 colony morphology (48 h); B: F6 bacterial gram stain (10×100); C: F6 sequence phylogenetic evolutionary tree.Bacillus oleronius strain:蔬菜芽孢杆菌株;Bacterium strain:细菌株;Uncultured bacterium clone:未培养菌克隆;Bacillus oleronius:蔬菜芽孢杆菌。图2 F6菌株鉴定Fig.2 F6 strain identification
2.3 蔬菜芽孢杆菌GX01培养条件优化
如图3所示,蔬菜芽孢杆菌GX01的对数生长期为3~12 h(图3-A);其在LB肉汤中的OD值最高(图3-B),说明LB肉汤是蔬菜芽孢杆菌GX01的最适培养基,后续试验均选择LB肉汤为研究培养基。当pH为3.0~5.0时,蔬菜芽孢杆菌GX01没有生长;当pH为6.0~9.0时,蔬菜芽孢杆菌GX01生长良好;当pH为10.0时,蔬菜芽孢杆菌GX01没有生长繁殖;其中,当pH为9.0时,OD值最高,说明pH 9.0是蔬菜芽孢杆菌GX01的最适生长pH(图3-C)。当温度为25、30和37 ℃时,OD值稳步上涨,蔬菜芽孢杆菌GX01生长繁殖能力逐渐增强;当温度为40和45 ℃时,OD值明显下降,菌株生长受到抑制;当温度为37 ℃时,OD值最高,说明37 ℃为蔬菜芽孢杆菌GX01的最适生长温度(图3-D)。
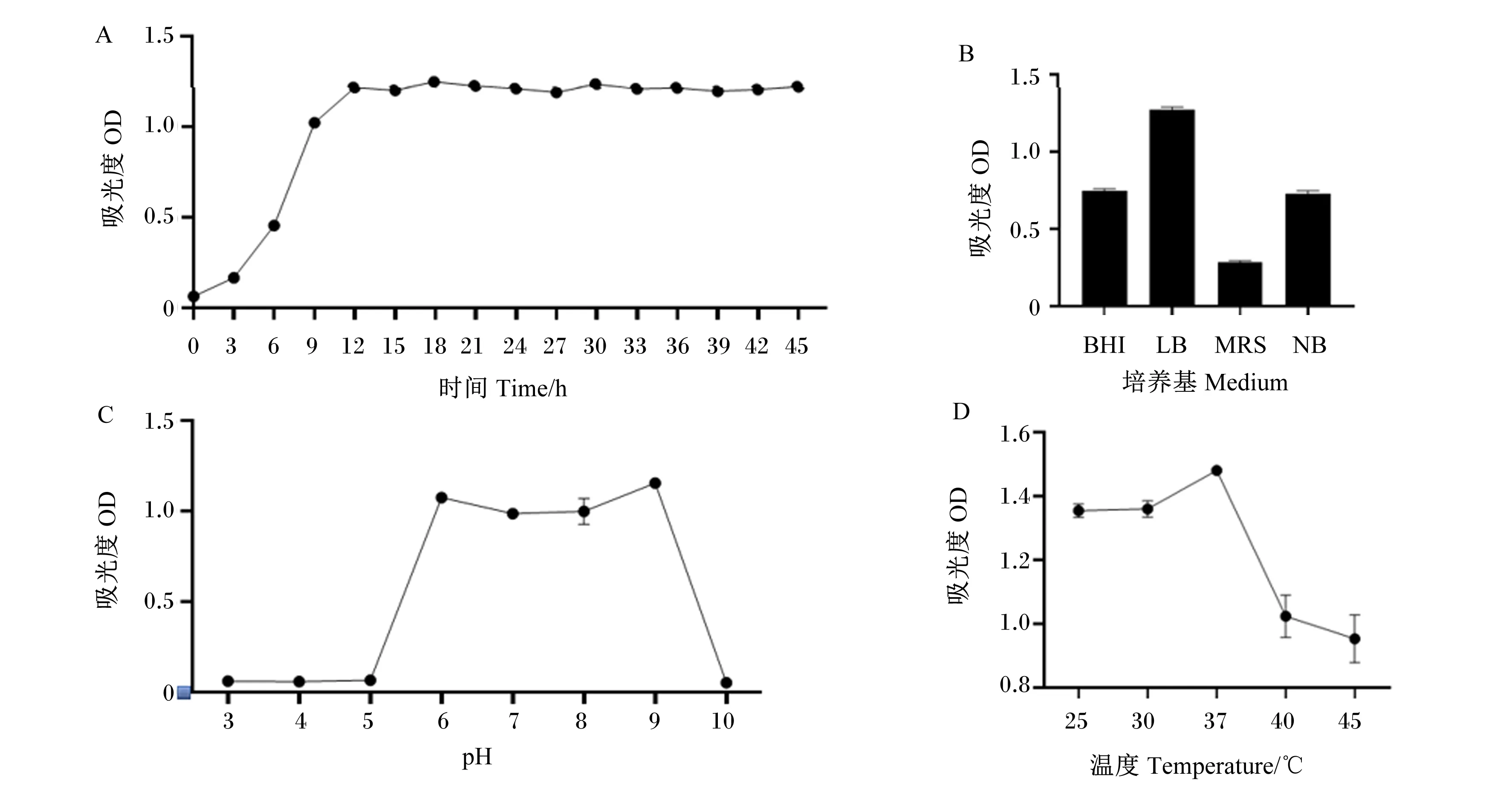
A:蔬菜芽孢杆菌GX01生长曲线;B:培养基优化;C:pH优化;D:温度优化。A: Bacillus oleronius GX01 growth curve; B: medium optimization; C: pH optimization; D: temperature optimization.图3 蔬菜芽孢杆菌GX01培养条件优化Fig.3 Optimization of culture conditions for Bacillus oleronius GX01
2.4 蔬菜芽孢杆菌GX01降解ZEA条件优化
如图4所示,蔬菜芽孢杆菌GX01在48 h时,ZEA降解率为85.39%;在48 h后,ZEA降解率上升趋势趋于平缓;在96 h时,ZEA降解率为91.07%(图4-A)。当温度为25~45 ℃时,蔬菜芽孢杆菌GX01对ZEA的降解率处于先升高后降低的变化趋势,最适温度为37 ℃,ZEA降解率为83.32%;其次为40 ℃,在此温度下的ZEA降解率为83.01%。由此可知,当温度为37~40 ℃时,蔬菜芽孢杆菌GX01产生的降解ZEA的物质活性较高(图4-B)。当pH为4.0~10.0时,ZEA降解率呈先升高后降低的趋势;当pH为9.0时ZEA降解率达到最高,为84.28%。由此可见,降解ZEA的活性物质在强酸和强碱条件下活性明显降低,在弱酸和中性条件下活性良好,在弱碱环境下活性最高,降解率最高(图4-C)。当毒素浓度为5~20 μg/mL时,ZEA降解率呈缓慢下降趋势;当毒素浓度为5 μg/mL时,ZEA降解效果最优,降解率为82.30%;当毒素浓度为20 μg/mL时,蔬菜芽孢杆菌GX01依然有很强的降解ZEA的能力,ZEA降解率为71.47%(图4-D)。
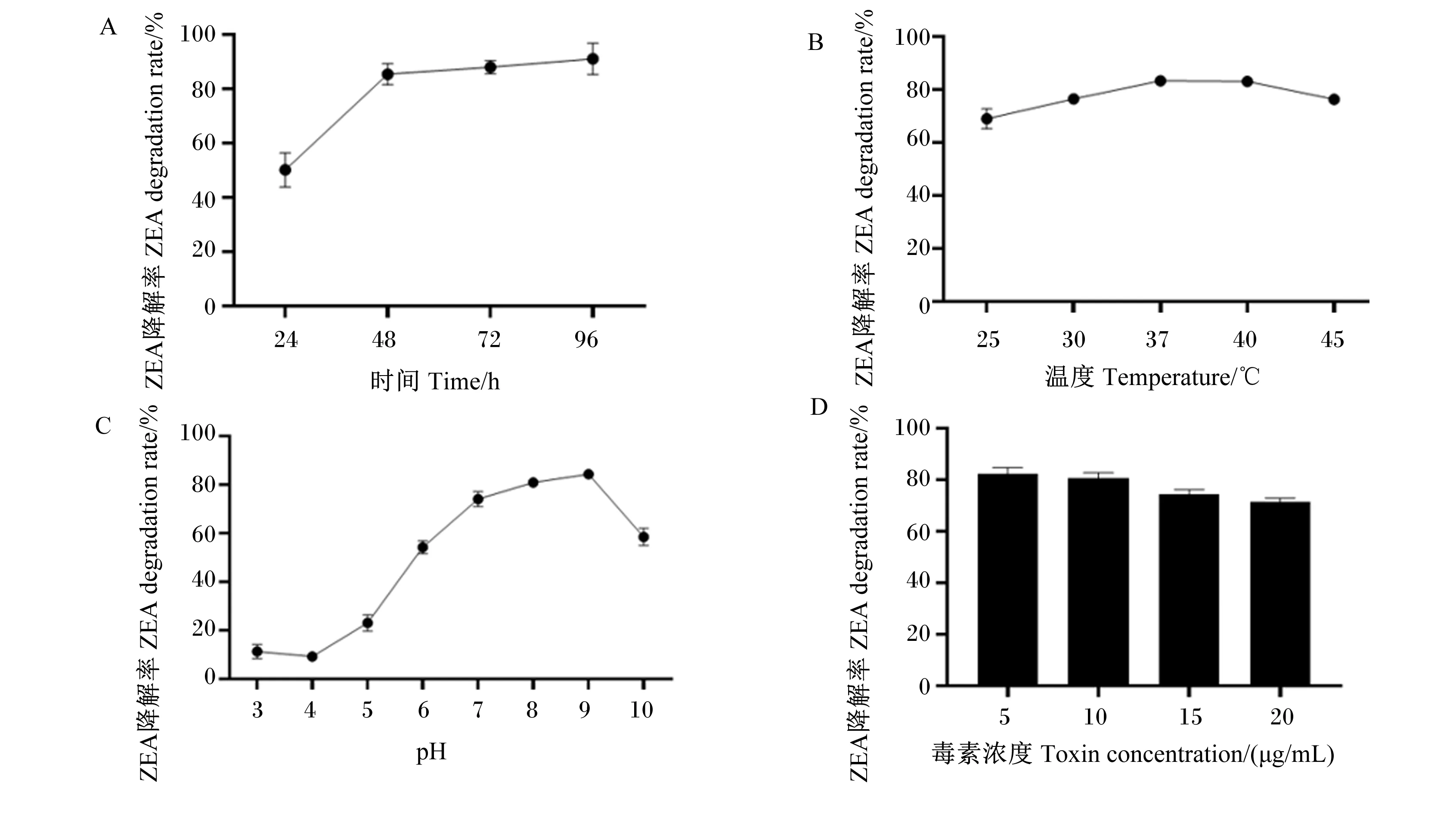
A:时间优化;B:温度优化;C:pH优化;D:毒素浓度。A: time optimization; B: temperature optimization; C: pH optimization; D: toxin concentration.图4 蔬菜芽孢杆菌GX01降解ZEA条件优化Fig.4 Optimization of ZEA degradation conditions by Bacillus oleronius GX01
2.5 蔬菜芽孢杆菌GX01降解ZEA活性物质定位
如图5所示,蔬菜芽孢杆菌GX01上清液降解ZEA的效果最佳,ZEA降解率为87.53%;其次为破碎菌体上清液,ZEA降解率为50.70%;活菌体、灭活菌体和破碎菌体沉淀的ZEA降解率分别为31.47%、35.79%和35.13%;此外,上清液煮沸15 min后的ZEA降解率为42.54%,这说明活性物质随着温度的升高而降低(图5-A)。在上清液中单独添加SDS和蛋白酶K,ZEA降解率均有下降,分别为53.51%和58.69%,而SDS和蛋白酶K一同添加,ZEA降解率下降为10.09%;由此推断,蔬菜芽孢杆菌GX01对ZEA的降解活性物质为胞外降解酶(图5-B)。

A:蔬菜芽孢杆菌GX01不同组分对ZEA降解率的影响;B:SDS与蛋白酶K对蔬菜芽孢杆菌GX01上清液降解ZEA的影响。A: effects of different components of Bacillus oleronius GX01 on degradation rates of ZEA; B: effects of SDS and protease K on ZEA degradation in Bacillus oleronius GX01 supernatant.图5 蔬菜芽孢杆菌GX01降解ZEA活性物质定位Fig.5 Localization of ZEA active substances degraded by Bacillus oleronius GX01
2.6 粗酶液降解效果
如图6所示,通过二喹啉甲酸(BCA)蛋白质浓度检测试剂盒得出,后续试验粗酶液蛋白质浓度为2.60 mg/mL,且2.60 mg/mL的粗酶液在72 h时可降解48.76%的ZEA(5 μg/mL)。在粗酶液经过高温处理后,ZEA降解率降低到13.16%;而经过蛋白酶K处理后,ZEA降解率降低到22.17%,这进一步说明了降解ZEA的物质为胞外酶。

图6 高温和蛋白酶K对降解酶降解ZEA的影响Fig.6 Effects of high temperature and proteinase K on ZEA degradation by degradative enzymes
2.7 金属离子对粗酶液降解ZEA效果的影响
如图7所示,与其他金属离子相比,Fe2+和Mn2+对粗酶液的ZEA降解率影响不明显;Fe3+和Cu2+轻微抑制了粗酶液的ZEA降解率,分别下降了9.92和7.10个百分点;Ca2+和Zn2+严重抑制了粗酶液对ZEA的降解能力,ZEA降解率分别下降了18.11和17.49个百分点;Na+、K+和Mg2+促进了粗酶液对ZEA的降解,ZEA降解率分别上升了20.12、6.31和10.67个百分点。此外,EDTA的引入也会影响粗酶液对ZEA的降解效果,ZEA降解率下降了24.94个百分点。EDTA是一种金属螯合剂,当引入EDTA时,体系溶液中的金属离子减少。由此可见,蔬菜芽孢杆菌GX01中的降解酶对金属离子较为敏感,并且会因为金属离子的减少导致降解活性降低。

图7 金属离子对粗酶液降解ZEA效果的影响Fig.7 Effects of metal ions on ZEA degradation in crude enzyme solution
2.8 LC-MS/MS检测结果及降解酶分析
胶条切下后,进行LC-MS/MS检测,检测总离子流色谱图见图8。蛋白粗提物测序后,根据数据库进行比对,选择可能性高的蛋白进行信息罗列和基因本体(GO)分析,结果如表1所示,结果显示,降解酶以水解酶和脱羧酶为主,还包括一些硫酯酶。

表1 降解酶分析结果Table 1 Analysis results of degradative enzymes

图8 LC-MS/MS检测降解酶的总离子流色谱图Fig.8 Total ion chromatograms of degradative enzymes by LC-MS/MS detection
3 讨 论
ZEA作为一种常见的饲料及粮食污染物,不仅会给畜牧业带来巨大损失,还会通过蓄积对人体健康造成极大危害。因此,对污染的饲料和粮食进行脱毒的研究已经变成国内外热门趋势。芽孢杆菌拥有厚而含水量低的多层结构,具有优秀的稳定性。在对ZEA脱毒的研究中,已被证实可脱毒的芽孢杆菌有枯草芽孢杆菌[10-11]、地衣芽孢杆菌[12-13]、贝莱斯芽孢杆菌[3,14]和解淀粉芽孢杆菌[15-16]等。吴宗芮等[17]从霉变的土壤和饲料中发现解淀粉芽孢杆菌G-6对ZEA(1 μg/mL)的降解率最高为81.19%。Lee等[15]在发霉的玉米样品中分离出解淀粉芽孢杆菌LN,并通过试验证明,解淀粉芽孢杆菌LN可以作为一种饲料添加剂来降低饲料中ZEA的浓度。耿海荣等[18]在酸性、高温的温泉环境下筛选出枯草芽孢杆菌Y-33,该菌对2 μg/mL的ZEA的降解率高达93.79%。段锦等[19]分离发霉饲料和动物粪便等样品中的菌株,筛选出解淀粉芽孢杆菌NA-J21和枯草芽孢杆菌MLS-H32,对ZEA均有一定降解效果。Hsu等[12]发现地衣芽孢杆菌CK1具有益生菌的特性,并且可以去除ZEA,其在开发去除ZEA的饲料添加剂方面具有很大的潜力。邓凤如等[20]从微生态制剂中筛选出能高效降解ZEA的菌株,鉴定为贝莱斯芽孢杆菌PA26-7。本试验通过菌株-ZEA(5 μg/mL)共培养的方法筛选出了1株ZEA降解率为75.9%的菌株F6,通过16S rDNA鉴定其为蔬菜芽孢杆菌GX01。此外,本试验对该菌的生长条件和降解ZEA条件进行优化,在48 h时可降解85.39%的ZEA(5 μg/mL),其对数生长期为3~12 h,最适培养基为LB肉汤,最适培养和降解的温度和pH分别为37 ℃和9.0。
为了确定蔬菜芽孢杆菌GX01对ZEA的脱毒方法,挖掘其降解酶,本试验对蔬菜芽孢杆菌GX01降解ZEA的活性物质进行定位。这种活性物质定位的方法也被刘晨等[21]用过,该试验发现菌株A.lwoffi.Haut.1的上清液、菌悬液和胞内提取物对ZEA的降解率分别为82.31%、21.33%和6.67%,由此确定菌株活性物质在上清液中。本试验的菌液上清液对ZEA的降解效果最优,这表明菌体外的活性物质起到主要的降解作用,同时这种活性物质的活性会被高温破坏从而降低降解率,证明了这种活性物质的成分可能是胞外酶。为了进一步确认活性物质是酶的可能性,本试验通过采用化学变性和生物变性的方法,分别向上清液中加入SDS和蛋白酶K,发现在上清液中单独添加SDS或蛋白酶K降解率均有下降,而SDS和蛋白酶K一同添加,与对照组相比降解率降低了77.44个百分点。
微生物分泌的酶对真菌毒素的生物降解是减少其负面影响的一种有吸引力的方法。降解酶通过改变ZEA的结构,降低或去除ZEA的毒性。ZEA及其衍生物的化学结构与天然雌激素相似,因此表现出雌激素活性。ZEA内酯环中的酯基容易被酯酶或酸碱水解,然后开环,从而改变ZEA现有的内酯结构,使其不再具有雌激素作用[22]。内脂水解酶ZHD101是一种由Takahashi-Ando等[23]发现的ZEA乳酸水解酶,这种酶破坏了ZEA结构中的内酯键,将其环形结构打开变成直链结构,最后进行脱羧反应[24-25]。本试验对上清液中的粗酶液进行提取,并通过LC-MS/MS检测,筛选和鉴定出了一些水解酶和脱羧酶。笔者推测,这些水解酶可以对大环内酯环进行水解,并通过脱羧酶进行脱羧,最后产生低毒或无毒的产物。硫酯酶存在于所有活细胞中,通过催化存在于各种细胞底物中的硫酯键的裂解来执行广泛的重要生物学功能[26]。已有研究表明,在解淀粉芽孢杆菌H6中筛选出了一种硫酯酶,这种硫酯酶可以裂解ZEA的内酯键,破坏大环内酯,从而起到降解ZEA的作用[16]。在本试验中,同样也筛选出了一种硫酯酶,这可能是ZEA降解的关键酶。
4 结 论
本研究筛选出的蔬菜芽孢杆菌GX01是一株新的ZEA降解菌,其在48 h时可降解85.39%的ZEA,该菌的胞外酶是降解ZEA的关键;根据LC-MS/MS检测结果,推测蔬菜芽孢杆菌GX01降解ZEA的关键酶为水解酶、脱羧酶和硫酯酶。
