分离乳酸菌对金黄色葡萄球菌ATCC29213株的抑菌作用
2023-12-04麦迪乃姆米尔阿迪力古哈尔尼萨吾布力董鹏林努尔买买提阿卜杜瓦伊提
吉 果 麦迪乃姆·米尔阿迪力 古哈尔尼萨·吾布力 董鹏林 努尔买买提·阿卜杜瓦伊提 陈 伟
(塔里木大学动物科学与技术学院,塔里木畜牧科技兵团重点实验室,阿拉尔 843300)
金黄色葡萄球菌是奶牛乳房炎最主要的病原菌,它所引起的奶牛乳房炎占所有细菌性乳房炎的30%~50%。据统计,美国每年由于奶牛乳房炎造成15亿~30亿美元的牛奶损失,占其牛奶总量的11%[1]。细菌、真菌和支原体等都能引起奶牛乳房炎,常见的奶牛乳房炎致病菌主要有葡萄球菌、无乳链球菌和大肠杆菌等[2]。抗生素在饲料添加剂中的不合理使用以及临床治疗奶牛乳房炎导致的细菌耐药性增加,“饲料禁抗”已成为国际畜牧业发展的必然趋势。
目前,乳酸菌至少可分为18个属200多个种,主要包括乳杆菌属(Lactobacillus)、肠球菌属(Enterococcus)等[3]。乳酸菌可产生多种抑菌物质,如乳酸、短链脂肪酸、过氧化氢(H2O2)、一氧化氮(NO)和细菌素等,这些物质帮助其竞争性抑制致病菌的黏附和定植,发挥益生功能[4]。乳酸菌具有益生特性,主要体现在调节肠道菌群[5]、缓减肠道疾病[6]、增强机体免疫力[7]和抗氧化[8]等方面。Espeche等[9]对从健康奶牛乳腺中分离的数百株乳酸菌的益生特性进行了评价,表明乳酸菌能够有效抑制金黄色葡萄球菌(Staphylococcusaureus)和大肠杆菌(Escherichiacoli)等病原菌的生长,为防治奶牛乳房炎提供了丰富的选择。目前关于羊瘤胃内容物和牛粪中是否存在能有效抑制奶牛乳房炎性金黄色葡萄球菌的乳酸菌的研究较少。因此,本试验从羊瘤胃内容物和牛粪中分离出乳酸菌菌株,并验证其中是否存在能有效抑制奶牛乳房炎性金黄色葡萄球菌的菌株,同时探究相关菌株发挥作用的主要成分和最适pH环境,以期为奶牛乳房炎的防治提供参考。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株
从新疆阿克苏市新和县某肉牛场(饲养少量羊只)采集5头健康肉牛的新鲜粪便(每头肉牛各取1份粪便样品),对屠宰的1只健康羊无菌采集其瘤胃内容物7份,同时采集2份青贮饲料样品。将采集的样品装于50 mL灭菌离心管中,冷藏后送回实验室进行菌株分离,并按照如下方法对分离的菌株进行命名:N代表自羊瘤胃内容物中分离;F代表自牛粪中分离;S代表自青贮饲料中分离。第1个阿拉伯数字代表样品编号;第2个阿拉伯数字代表所使用的菌株为纯化的菌株类型;圆圈内阿拉伯数字代表该菌株类型的第几株克隆。金黄色葡萄球菌ATCC29213株由塔里木大学动物科学与技术学院陈伟教授实验室吴自豪提供,屎肠球菌(Enterococcusfaecium)5号株由塔里木大学动物科学与技术学院郭雪峰教授惠赠,戊糖乳杆菌(Lactobacilluspentosus)12号株由塔里木大学生命科学学院任晓镤副教授提供。
1.1.2 主要试验用品
MRS肉汤培养基、胰蛋白大豆琼脂(tryptic soy agar,TSA)培养基、琼脂粉(agar powder)、过氧化氢酶(CAT,400 000 U/g)购自北京索莱宝有限责任公司,胰蛋白大豆肉汤(tryptic soy broth,TSB)培养基购自青岛高科园海博生物技术有限公司,乳酸链球菌素(Nisin,900 IU/mg)购自北京酷来搏科技有限公司,MRA琼脂培养基是在MRS肉汤培养基中添加1.5%的琼脂粉经121 ℃高压灭菌20 min后制成。
1.1.3 主要仪器设备
实时微生物生长分析系统(型号MicroScreen-HT),由森灵仪器制造(天津)有限公司生产;冻干机(型号FDU-1200),由日本东京理化有限公司生产。
1.2 试验方法
1.2.1 乳酸菌的分离与纯化
参考王利红[10]的试验方法,对从牛场采集的牛粪和羊瘤胃内容物以及青贮饲料样品进行乳酸菌菌株分离。首先对牛粪样品采用TSB培养基进行富集,然后在TSA平板上进行划线分离,在37 ℃进行培养,直至长出单克隆,反复纯化3次,得到18株细菌(F3-1①、F3-1②、F3-2①、F3-2②、F3-3①、F3-3②、F3-5①、F3-5②、F4-1①、F4-1②、F4-2①、F4-2②、F4-3①、F4-3②、F4-5①、F4-5②、F4-2③、F4-2④)。将羊瘤胃内容物样品用MRS肉汤培养基富集后,首先在MRS琼脂培养基的平板上划线分离,在含5%二氧化碳(CO2)培养箱中培养,直至长出单克隆后用接种环无菌挑取白色黏液样单克隆接种到3 mL MRS肉汤培养基中,继续在含5% CO2培养箱中培养12 h以上;如此重复3次,直至划线出形态相似,均一大小,边缘整齐不透明,具有白色黏液样的单克隆,做革兰氏镜检,得到9株疑似乳酸菌(N1-1①、N1-1②、N2-1①、N3-1①、N4-1①、N4-1②、N5-1①、N5-1②、N7-1①)。按照羊瘤胃内容物菌株分离方法处理青贮饲料样品,分离得到2株细菌(S1-1①、S2-1①)。对上述29株分离细菌分别扩增16S rDNA,由生工生物工程(上海)股份有限公司进行测序。
1.2.2 16S rDNA测序鉴定
PCR扩增体系:5.0 μL 10×PCR Buffer,1 μL正向引物27F,1 μL反向引物1492R,2 μL模板基因组DNA,0.5 μL 5 U/μL Pfu DNA聚合酶,加ddH2O至50 μL。反应程序:95 ℃预变性5 min,94 ℃变性30 s,48 ℃退火30 s,72 ℃延伸1 min 30 s,72 ℃延伸10 min,扩增34个循环。PCR扩增产物采用1%琼脂糖凝胶电泳检测后送生工生物工程(上海)股份有限公司测序。
1.2.3 乳酸菌生长特性及产酸能力测定
参照崔棹茗等[11]的试验方法进行乳酸菌生长特性及产酸能力测定。对分离纯化并经16S rDNA测序的疑似乳酸菌的4株分离菌N3-1①、N4-1①、N5-1①、N7-1①活化后按照995 μL MRS肉汤培养液加5 μL菌液的接种量接种,37 ℃恒温培养36 h,每个样品制备3管,以空白培养基为对照,通过实时微生物生长分析系统连续测定600 nm波长下的吸光度(OD600 nm)值,同时测定菌液在培养0、2、4、6、8、12、24、36 h时的pH,以菌液培养时间为横坐标,OD600 nm值和pH为纵坐标分别绘制生长曲线和产酸曲线。同时对上述菌株进行革兰氏染色和过氧化氢酶接触试验。
1.2.4 Nisin效价标准曲线绘制
参照文献[12]的方法,准确称取1.00 g的Nisin标准品,溶于1 mL灭菌蒸馏水中,配成1 000 mg/mL的母液。再用灭菌蒸馏水稀释成500、250、100、50、25 mg/mL的Nisin标准液。采取牛津杯双层琼脂平板法测定稀释后的各浓度Nisin标准液对金黄色葡萄球菌ATCC29213株的抑菌圈直径,以抑菌圈直径为纵坐标,以Nisin浓度的对数为横坐标,绘制标准曲线。
1.2.5 乳酸菌抑菌试验及抑菌物质效价测定
参照文献[13]的方法制备1.5%的琼脂平板,等间距放入4个经过高温灭菌后的牛津杯。将金黄色葡萄球菌ATCC29213株接种在TSB培养基中37 ℃恒温培养过夜。制备200 mL含0.7%琼脂的金黄色葡萄球菌培养基(0.7% TSA培养基),冷至50 ℃左右,将过夜培养的金黄色葡萄球菌ATCC29213株调整至0.5麦氏比浊(1.5×108CFU/mL),按1%的接种量接种2 mL稀释后的金黄色葡萄球ATCC29213株菌液,混匀。在放置牛津杯的素琼脂平板上倒入15 mL含有金黄色葡萄球菌ATCC29213株的0.7% TSA培养基,晾干后用无菌镊子取出牛津杯,在孔中加入100 μL分离的乳酸菌无菌发酵上清液(按照1.2.6中原液组的方法制备),在超净工作台中鼓风扩散3 h后,放置于37 ℃恒温培养箱培养16~24 h观察,并用游标卡尺测定抑菌圈直径,计算抑菌物质效价。
1.2.6 不同处理下的抑菌试验
原液组:将分离纯化后的N3-1①以1%接种量接种于100 mL MRS肉汤培养基中,在含5%CO2培养箱中37 ℃培养至稳定期(OD600 nm值≥1.9),4 ℃下12 000×g离心15 min,收集上清液(即无菌发酵上清液[13]),对上清液采用0.22 μm滤膜无菌过滤,在-50 ℃条件冷冻干燥过夜。冻干后的固体用1 mL灭菌蒸馏水吹悬(浓缩至1/10体积),放置于-20 ℃冰箱中备用。采用1.2.5中所述牛津杯法进行抑菌试验。
氢氧化钠(NaOH)处理组:将分离纯化后的N3-1①以1%接种量接种于100 mL MRS肉汤培养基中,在含5%CO2培养箱中37 ℃培养至稳定期(OD600 nm值≥1.9),4 ℃下12 000×g离心15 min,收集上清液,用6 mol/L NaOH溶液调pH至6.5,以中和上清液中有机酸的干扰。后续步骤同上述原液组。
NaOH+CAT处理组:用pH为6.5的0.02 mol/L的醋酸钾将CAT配成50 mg/mL的母液,在NaOH处理组所得无菌发酵上清液的基础上,将母液加入到上清液中进行10倍稀释,使上清液中CAT的终浓度为5.0 mg/mL,37 ℃水浴2 h。后续步骤同上述原液组。
1.2.7 不同pH乳酸抑菌试验
将具有一定抑菌活性的分离乳酸菌N3-1①、N4-1①、N5-1①、N7-1①、屎肠球菌5号株按1%的接种量接种于MRS肉汤培养基中,在37 ℃培养24 h后,不经过1/10体积浓缩,测定无菌发酵上清液的pH。用NaOH溶液将1/2的无菌发酵上清液调整至pH为6.5,另1/2不作处理。经牛津杯法检测上述2份无菌发酵上清液对金黄色葡萄球菌ATCC29213株的抑菌作用。将乳酸溶液用无菌蒸馏水调整到pH分别为1.4、2.1、3.0、3.8,参照步骤1.2.5制备含有金黄色葡萄球菌ATCC29213株的0.7%TSA培养基平板,在对应的牛津杯孔中分别加入上述不同pH的乳酸溶液100 μL,37 ℃培养16 h,测量抑菌圈直径,并计算抑菌物质效价。
1.3 数据处理与分析
采用Excel 2019整理数据并绘制图片。采用CurveExpert 1.4 汉化版软件进行线性方程的拟合。
2 结 果
2.1 疑似乳酸菌16S rDNA测序鉴定
将从牛粪中分离的18株、从羊瘤胃内容物中分离的9株和从青贮饲料中分离的2株共29株细菌的16S rDNA进行扩增,扩增产物的电泳图见图1。将这29株分离菌株的16S rDNA序列在NCBI数据库进行Blast序列比对,选取序列同源性最高的菌株作为测序菌株的疑似菌株,其中有11株疑似乳酸菌(表1)。

1:F3-1①;2:F3-1②;3:F3-2①;4:F3-2②;5:F3-3①;6:F3-3②;7:F3-5①;8:F3-5②;9:F4-1①;10:F4-1②;11:F4-2①;12:F4-2②;13:F4-3①;14:F4-3②;15:F4-5①;16:F4-5②;17:F4-2③;18:F4-2④;19:N1-1①;20:N1-1②;21:N2-1①;22:N3-1①;23:N4-1①;24:N4-1②;25:N5-1①;26:N5-1②;27:N7-1①;28:S1-1①;29:S2-1①;M:DL2000 Marker。图1 29株分离菌的16S rDNA扩增电泳图Fig.1 16S rDNA amplification electrophoretogram of 29 isolated strains
2.2 疑似乳酸菌的生长特性与产酸能力
如图2所示,N3-1①、N4-1①、N5-1①、N7-1①均呈现白色黏液样菌落,符合乳酸菌菌落的典型形态。革兰氏染色镜检发现,除N3-1①、N5-1①由于伊红复染充分,颜色偏红以外,N4-1①、N7-1①均呈蓝色,显微镜下形态均呈短杆状或棒状球菌,直径0.5~2.0 μm,以单个或成对分布为主,部分成短链状或成团状分布。上述菌株革兰氏染色均呈阳性,同时过氧化氢酶接触显示阴性,可初步确定为乳酸菌。

图2 4株疑似乳酸菌的菌落及革兰氏染色Fig.2 Bacterial colonies and Gram staining of 4 strains of suspected lactic acid bacteria
由生长曲线(图3)可知,N3-1①达到平台期为16.15 h;N4-1①达到平台期为16.53 h,在4株菌中最晚到达平台期;N5-1①达到平台期为15.77 h,在4株菌中最早到达平台期;N7-1①达到平台期为16.15 h,与N3-1①相同,表明这2株菌的生长特性比较接近。

A:N3-1① 28 h内OD600 nm值变化;B:N4-1① 28 h内OD600 nm值变化;C:N5-1① 28 h内OD600 nm值变化;D:N7-1① 28 h内OD600 nm值变化。A: change of OD600 nm value of N3-1① within 28 h; B: change of OD600 nm value of N4-1① within 28 h; C: change of OD600 nm value of N5-1① within 28 h; D: change of OD600 nm value of N7-1① within 28 h.图3 4株疑似乳酸菌的生长曲线Fig.3 Growth curve of 4 strains of suspected lactic acid bacteria
产酸曲线(图4)表明,N3-1①、N4-1①、N5-1①、N7-1①接种在MRS肉汤培养基中,0 h时pH均为6.2,培养24 h后,pH均在3.5左右,此时各菌株产酸能力已到达平台期;继续培养至36 h,pH没有发生变化,表明乳酸菌生长达到稳定期后,其产酸能力不再随时间的延长而增加。
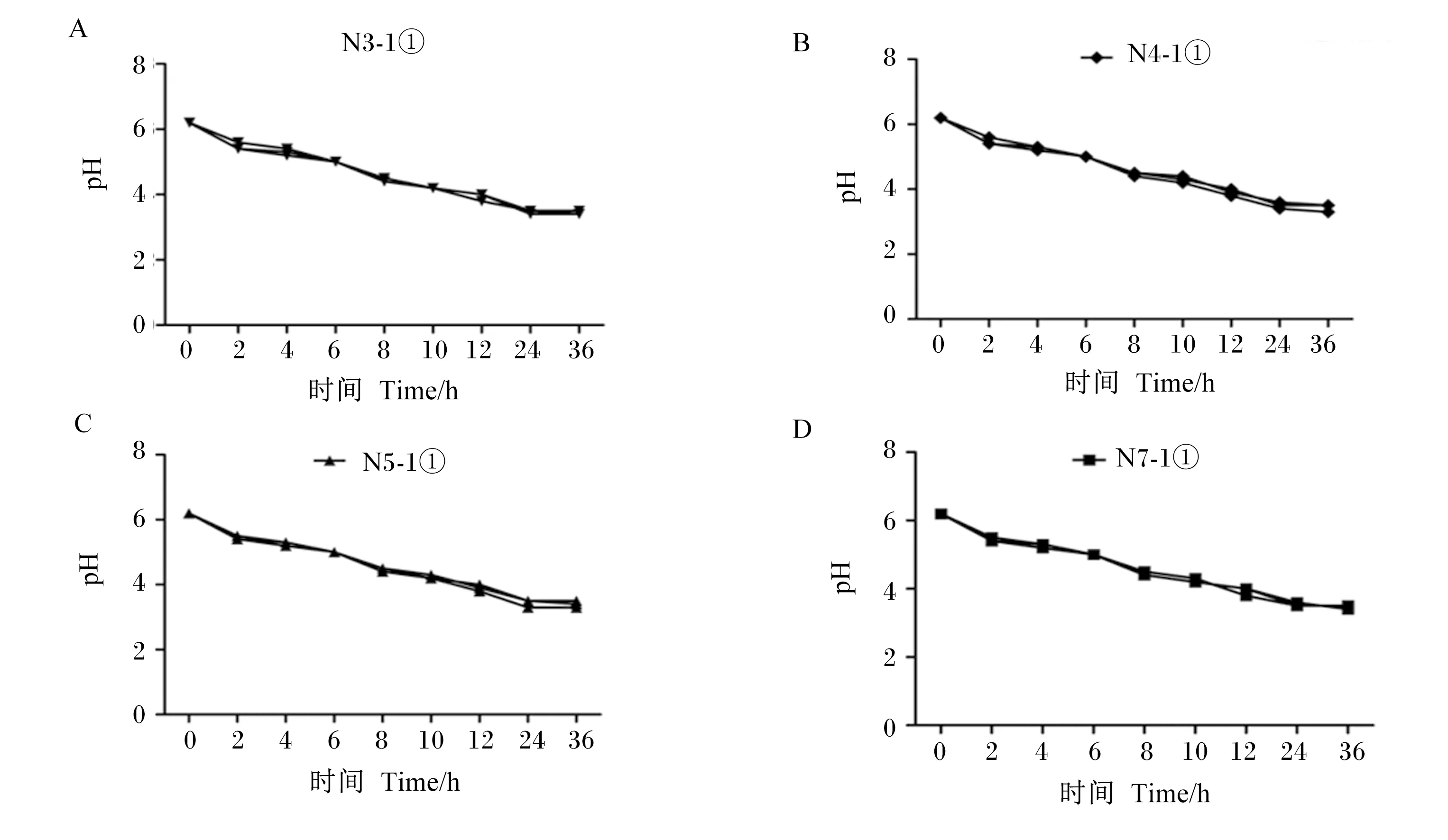
A:N3-1① 36 h内pH变化;B:N4-1① 36 h内pH变化;C:N5-1① 36 h内pH变化;D:N7-1① 36 h内pH变化。A: pH change of N3-1① within 36 h; B: pH change of N4-1① within 36 h; C: pH change of N5-1① within 36 h; D: pH change of N7-1① within 36 h.图4 4株疑似乳酸菌的产酸曲线Fig.4 Acid production curve of 4 strains of suspected lactic acid bacteria
2.3 抑菌物质效价计算公式
Nisin浓度的标准曲线如图5所示,线性拟合方程为:Y=1.179 3+5.177 1X(R2=0.928)。根据此方程可计算抑菌试验中乳酸菌无菌发酵上清液所对应的细菌素当量对数值[lg(mg/mL)]。由于乳酸菌无菌发酵上清液经过10倍浓缩,且商品化Nisin效价单位为900 IU/mg,最终计算公式为:
乳酸菌无菌发酵上清液抑菌物质效价(IU/mL)=10X/10×Nisin效价单位(900 IU/mg)。
2.4 分离乳酸菌的抑菌活性及抑菌物质效价
对分离的乳酸菌F3-1①、N3-1①、N4-1①、N5-1①、N7-1①以及屎肠球菌5号株、戊糖乳杆菌12号株,通过牛津杯法对金黄色葡萄球菌ATCC29213株进行抑菌试验。由图6可知,在相同条件下,N3-1①产生的抑圈菌直径最大,达到了22.68 mm,具有最强的抑菌活性;F3-1①、屎肠球菌5号株、戊糖乳杆菌12号株、N4-1①、N5-1①、N7-1①具有一定的抑菌活性。根据抑菌物质效价公式,计算出各菌株所产抑菌物质效价,见表2。结果表明,粪肠球菌N3-1①具有最高的抑菌物质效价,数值为1.28×106IU/mL;其次为戊糖乳杆菌12号株,抑菌物质效价达到了1.21×105IU/mL;再次为屎肠球菌5号株,抑菌物质效价达到了3.58×104IU/mL。

F3-1①:粪肠球菌;N3-1①:粪肠球菌;N4-1①:屎肠球菌;N5-1①:屎肠球菌;N7-1①:未知菌株;5:屎肠球菌5号株;12:戊糖乳杆菌12号株;MSR:MSR肉汤培养基;ddH2O:双蒸水。下图同。F3-1①: Enterococcus faecalis; N3-1①: Enterococcus faecalis; N4-1①: Enterococcus faecium; N5-1①: Enterococcus faecium; N7-1①: unknown strain; 5: Enterococcus faecalis No.5; 12: Lactobacillus pentosus No.12; MSR: MRS broth medium; ddH2O: double distilled water. The same as below.图6 不同乳酸菌抑菌作用观察Fig.6 Observation of antibacterial effects of different lactic acid bacteria
2.5 不同处理下抑菌试验结果
牛津杯试验表明,在分离的乳酸菌中N3-1①对金黄色葡萄球菌ATCC29213株具有最强的抑菌活性。在此基础上,通过制备不同处理下的N3-1①无菌发酵上清液,开展进一步抑菌试验,探究乳酸菌所产抑菌物质的种类。由图7和表3可知,N3-1①的无菌发酵上清液经冷冻干燥、1/10体积浓缩后表现出较强的抑菌活性,抑菌圈直径达23.36 mm;经NaOH调pH至6.5左右,抑菌圈消失,表明发挥抑菌作用的活性物质可能为有机酸类等酸性物质;本试验未观察到H2O2在NaOH对无菌发酵上清液的处理中发挥进一步的作用。

表3 N3-1①在不同处理下的抑菌效果比较Table 3 Comparison of antibacterial effects of N3-1① under different treatments
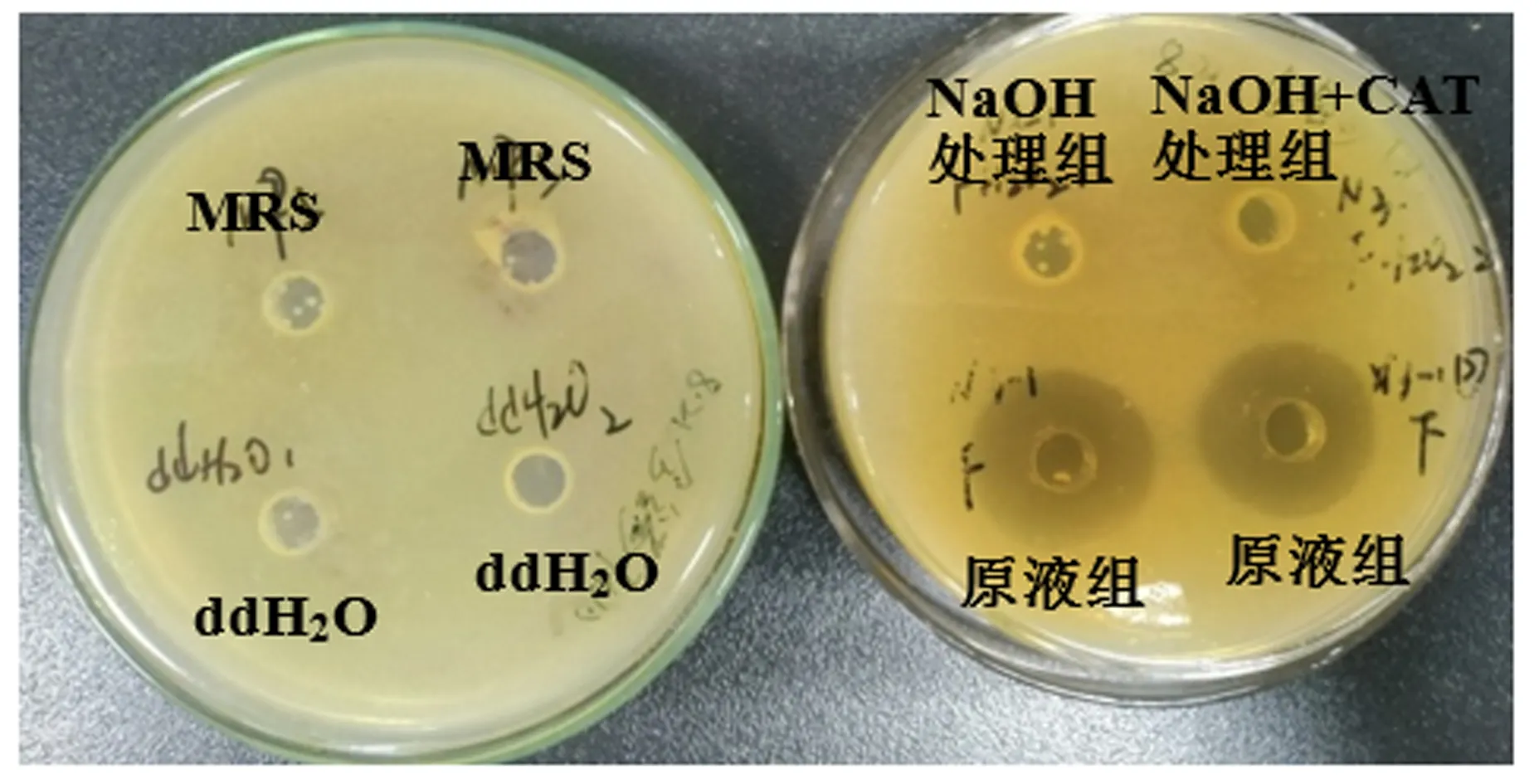
图7 N3-1①在不同处理下的抑菌作用观察Fig.7 Observation of antibacterial effects of N3-1① under different treatments
2.6 不同pH乳酸抑菌试验结果
抑菌试验结果显示,N3-1①、N4-1①、N5-1①、N7-1①、戊糖乳杆菌5号株按1%的接种量接种于MRS肉汤培养基中,在37 ℃培养24 h后,无论是否经过NaOH处理,上述乳酸菌无菌发酵上清液(未经过1/10体积浓缩)经牛津杯检测未能观察到抑菌现象(图8)。由表4可知,除N3-1①无菌发酵上清液pH为4.1外,其余4株乳酸菌无菌发酵上清液pH均为3.8,该结果表明乳酸菌无菌发酵上清液pH高于3.8时,不能有效抑制指示菌金黄色葡萄球菌ATCC29213株的生长。将乳酸溶液采用灭菌蒸馏水稀释至4个不同的pH,分别为1.4、2.1、3.0、3.8,采用牛津杯法进行抑菌试验,结果(表5)显示,当pH为1.4时,乳酸溶液对金黄色葡萄球菌ATCC29213株表现出强抑制作用;当pH为2.1时,乳酸溶液对指示菌表现出一定的抑制作用;当pH为3.0和3.8时,没有观察到乳酸溶液对指示菌的抑制作用。

表4 5株乳酸菌在NaOH处理下的抑菌作用Table 4 Antibacterial effect of 5 strains of lactic acid bacteria under NaOH treatment
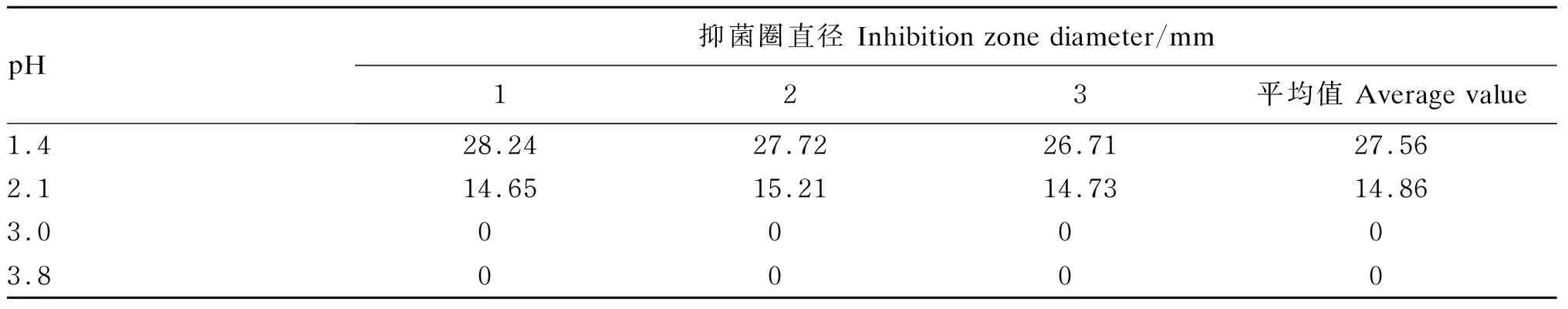
表5 不同pH乳酸抑菌试验结果Table 5 Results of different pH lactic acid antibacterial test

F:未经NaOH处理;C:经NaOH处理。F: not treated with NaOH; C: treated with NaOH.图8 NaOH处理及乳酸抑菌试验结果Fig.8 Results of NaOH treatment and lactic acid antibacterial test
3 讨 论
本试验从牛粪、羊瘤胃内容物及青贮饲料中总计分离出了29株细菌,其中来自牛粪的疑似大肠杆菌18株,来自羊瘤胃内容物的疑似乳酸菌9株,来自青贮饲料的疑似乳酸菌2株。我们通过NCBI序列比对鉴定出细菌的种属,挑选生长性能较好的4株疑似乳酸菌N3-1①、N4-1①、N5-1①、N7-1①分离纯化后对菌株进行革兰氏镜检,显示均为革兰氏阳性菌株,过氧化氢酶接触试验均为阴性。
牛津杯双层平板法试验结果表明,从羊瘤胃内容物中分离的粪肠球菌N3-1①具有最强的抑菌活性,其他试验菌株培养24 h后的无菌发酵上清液所形成的抑菌圈直径较小,具有一定的抑菌活性。何江波等[14]从羊瘤胃内容物中分离出22株乳酸菌(包括戊糖乳杆菌、粪肠球菌、蒙氏肠球菌、海氏肠球菌等),在排除酸效应后,所有菌株发酵上清液均未检测到抑菌活性。本试验所得结果与上述研究结果相似。
Korhonen等[15]证明,乳酸菌中发挥主要抑菌作用的是乳酸和醋酸,与本研究的结果有相似之处。研究显示,乳酸菌产酸能力强,能快速产生大量乳酸等有机酸,形成低pH环境,抑制有害菌的生长[16-17]。陈宏伟等[12]研究表明,乳酸菌通过细菌素发挥主要抑菌作用,在乳酸形成的有机酸性环境中,细菌素发挥的效果更好。有研究表明,乳酸菌可通过细菌素、H2O2等发挥抑菌效果[18]。
有机酸可以通过酸(未电离形式)的扩散穿过细胞膜,解离和酸化细胞质[19-20]。此外,解离的有机酸也会使细菌的酶、蛋白质和DNA变性,从而抑制细菌生长[21]。李雪莉等[22]研究表明,乳酸菌主要通过有机酸来发挥抑菌作用。叶青[23]对云南建水酸浆豆腐中是乳酸菌进行了分离与鉴定,研究发现酸浆中主要微生物自然发酵后的有机酸产物主要为L-乳酸。我们后续将对上述有抑菌活性的乳酸菌作进一步研究,以明确其主要抑菌物质。
4 结 论
本试验从羊瘤胃内容物中分离出了1株对金黄色葡萄球菌ATCC29213株有良好抑菌活性的乳酸菌——粪肠球菌N3-1①,其发挥抑菌活性的物质为有机酸类。通过不同pH乳酸抑菌试验得出乳酸对金黄色葡萄球菌ATCC29213株发挥抑菌作用的最适pH为1.4~2.1。
