小鼠乳腺炎模型的建立及褪黑素对小鼠乳腺炎的防治作用
2023-12-04仇娅琪尹海娜王生月臧长江余英英李云梦南冰禹杨开伦谭世新米热古丽依马木
仇娅琪 尹海娜 王生月 臧长江* 余英英 李云梦 刘 拓 南冰禹 杨开伦 谭世新 米热古丽·依马木
(1.新疆农业大学动物科学学院 新疆肉乳用草食动物营养重点实验室,乌鲁木齐 830052;2.莎车县科学技术局,莎车 844700;3.新疆天山畜牧生物工程股份有限公司,昌吉 831100)
乳房炎即乳腺组织的炎症,是由于物理损伤、化学刺激或某些病原体感染引起的乳腺组织炎症[1],它是奶牛场中危害最大、投入最多、且难防治的疾病。其复杂的病因和多因素的性质使其难以控制,最常见的因素是病原体感染,其中大肠杆菌、链球菌和金黄葡萄球菌是最常见的感染细菌,它们可以引发免疫反应或者生理损伤[2]。褪黑素(melatonin,MT)是由松果体以及其他组织器官分泌合成的一种吲哚胺杂环类化合物[3],具有抗炎[4]、抗氧化[5]、调节免疫[6]和抗凋亡[7]等多种生物学功能。研究发现,脂多糖(lipopolysaccharide,LPS)是大肠杆菌等革兰氏阴性菌细胞壁的主要成分,乳导管单独灌注LPS能够诱导乳腺炎的发生[8]。研究证明,MT可以提高LPS诱导小鼠的肝脏和脾脏组织中超氧化物歧化酶(SOD)、谷胱甘肽氧化物酶(GSH-Px)活性,并降低丙二醛(MDA)含量[9]。也有研究表明,MT可以对腹腔注射LPS诱导的小鼠神经管缺损以及新生大鼠的脑损伤有保护作用[10-11],并且MT可以抑制LPS诱导巨噬细胞产生一氧化氮(NO)和白细胞介素-6(IL-6)[12]。因此,利用MT的抗炎及抗氧化效应来缓解机体炎症反应成为研究热点。相对于奶牛,小鼠具有体积小、易操控、差异低等特点。前人通过建立小鼠乳腺炎模型,探究了蒲公英提取物[13]、丹参多糖[14]、胆酸[15]等对小鼠乳腺炎的减轻作用。因此,本试验在灌胃MT的同时通过乳腺导管注射LPS构建小鼠乳腺炎模型,检测小鼠血清中炎性因子及抗氧化指标的变化,旨在探究MT在体内对乳腺炎小鼠的防治作用,为MT防治奶牛乳腺炎提供参考。
1 材料与方法
1.1 试验动物
选择体重为30 g左右、6~8周龄的无特定病原体(SPF)雌、雄ICR系小鼠(购自新疆医科大学动物中心)为试验动物。适应性饲喂7 d之后,将雄、雌鼠按照1∶2的比例进行合笼,自然交配怀孕后,单笼进行饲养。
1.2 试验材料
LPS(来源于大肠杆菌055∶B5,L2880)购自美国Sigma公司;MT(分析纯,纯度≥98%,E120134)购自上海安耐吉化学有限公司;肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、IL-6、白细胞介素-10(IL-10)、SOD、GSH-Px、过氧化氢酶(CAT)、MDA检测试剂盒均购自北京华英生物技术研究所;微型注射针(32G,4 mm)购自衢州舒克特医疗器械有限公司;眼科显微镊子、显微剪刀、小鼠灌胃针(12号,55 mm)均购自中科生命生物科技(北京)有限公司;其他常规试剂均为国药产品分析纯。
1.3 试验设计
1.3.1 小鼠乳房炎模型的建立
选取14只健康的产后7~14 d的母鼠,随机分为对照组和LPS组,每组7只。母鼠腹腔注射4%水合氯醛溶液进行麻醉,完全麻醉后,使用眼科手术镊夹住乳头,并用眼科手术剪剪去第4对乳腺的乳尖1 mm左右,从而暴露出乳腺导管。用微型注射器吸取50 μL浓度为0.2 mg/mL的LPS溶液,分别注入两侧的乳腺导管,注入时针头插入深度为3~4 mm[10]。LPS诱导24 h后,先采用眼球摘除法取血,然后使用断颈法致小鼠死亡,采集第4对乳腺组织于4%多聚甲醛中保存,用于制作病理组织学切片。
1.3.2 MT对小鼠乳腺炎的防治作用
选取56只健康的产后3~5 d母鼠,随机分为4组,每组14只。空白对照组和模型组每日灌胃0.2 mL生理盐水,MT低、高剂量组每日分别按照1、2 mg/kg BW的剂量灌胃MT(溶于0.2 mL生理盐水)。共灌胃14 d,分别于第7、14天灌胃4 h后,从模型组与MT低、高剂量组各挑选7只小鼠采用1.3.1中方法构建乳腺炎模型,LPS诱导24 h处死并采取血液及乳腺组织样品。
1.4 乳腺组织切片制作
首先将在4%多聚甲醛中保存的乳腺组织取出,然后依次进行冲洗、脱水、透明、浸蜡、包埋,随后切成4~5 μm的切片,平铺于干净的载玻片上,45 ℃烘4~5 h,最后进行苏木精-伊红(HE)染色,中性树脂封片,显微镜下观察乳腺组织病理变化。
1.5 小鼠血清及乳腺组织中炎性细胞因子含量、抗氧化指标的测定
将采取的血液放入离心管中,静置4 h后离心收集血清;在乳腺组织中加入磷酸盐缓冲液进行研磨,离心取上清。样品处理后,用试剂盒测定炎性细胞因子(TNF-α、IL-1β、IL-6、IL-10)的含量与抗氧化指标(SOD、GSH-Px、CAT、MDA)的活性或含量。
1.6 数据统计与分析
试验数据采用Excel 2021进行初步整理,然后用SPSS 25.0软件进行统计分析。对小鼠乳腺炎模型建立中血清、乳腺组织中TNF-α、IL-1β和IL-6含量数据进行独立样本t检验;对MT对小鼠乳腺炎的防治作用中相关指标数据进行单因素方差分析,并采用Duncan氏法进行多重比较。结果以平均值±标准差表示。以P<0.05表示差异显著,P<0.01表示差异极显著,P>0.05表示差异不显著。用GraphPad Prism 9.0软件进行绘图。
2 结果与分析
2.1 小鼠乳腺炎模型的建立
2.1.1 LPS诱导后小鼠乳腺组织眼观病理结果
如图1所示,小鼠的乳腺经过LPS刺激后,有明显的发红、出血的症状。
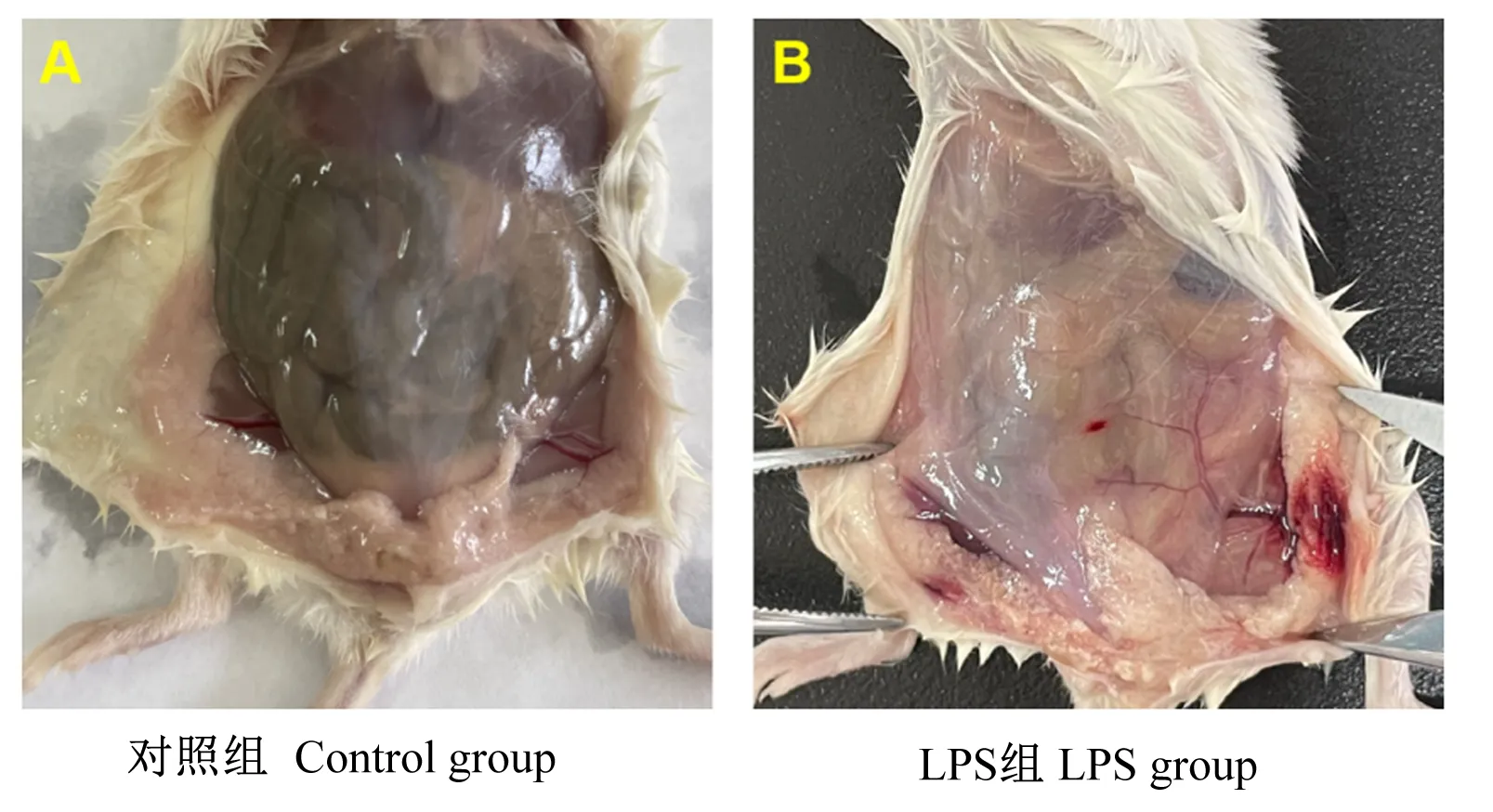
图1 肉眼观察剖检后的乳腺组织变化Fig.1 Changes of mammary tissue after autopsy by naked eye
2.1.2 LPS诱导后小鼠乳腺组织病理组织学变化
如图2所示,对照组乳腺腺泡分布均匀,形态结构完整,无炎性细胞浸润;LPS组乳腺腺泡分布不均匀,腺泡遭到破坏,腺泡壁有明显的水肿、增厚等变化,泡腔中产生了大量的嗜中性粒细胞、炎性细胞。

图2 乳腺组织病理组织学变化Fig.2 Histopathological changes of mammary tissue (100×)
2.1.3 LPS诱导对小鼠血清中TNF-α、IL-1β和IL-6含量的影响
如图3所示,与对照组相比,LPS组小鼠血清中促炎细胞因子TNF-α、IL-1β和IL-6的含量均极显著升高(P<0.01)。

LPS组数据柱标注##表示与对照组相比差异极显著(P<0.01)。图4同。Date column of LPS group with ## represents extremely significant difference compared with control group (P<0.01). The same as Fig.4.图3 LPS对小鼠血清中TNF-α、IL-1β和IL-6含量的影响Fig.3 Effects of LPS on TNF-α, IL-1β and IL-6 contents in serum of mice (n=7)
2.1.4 LPS诱导对小鼠乳腺组织中TNF-α、IL-1β和IL-6含量的影响
如图4所示,与对照组相比,LPS组小鼠乳腺组织中促炎细胞因子TNF-α、IL-1β和IL-6的含量均极显著升高(P<0.01)。
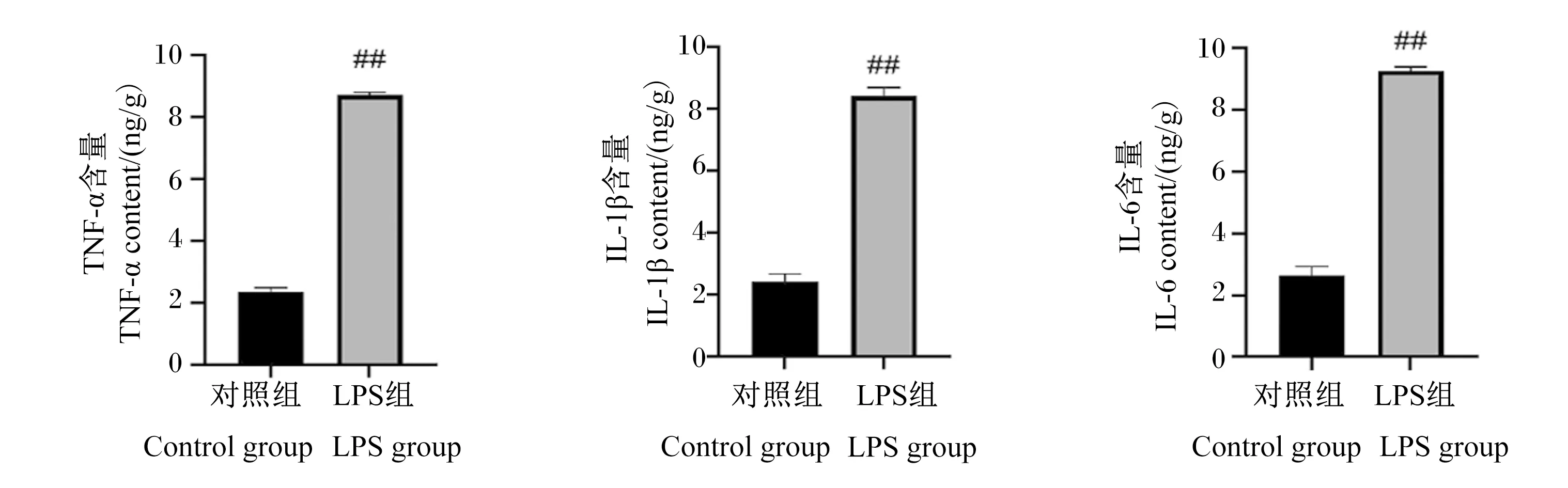
图4 LPS对小鼠乳腺组织中TNF-α、IL-1β和IL-6含量的影响Fig.4 Effects of LPS on TNF-α, IL-1β and IL-6 contents in mammary tissue of mice (n=7)
2.2 MT对LPS诱导的小鼠乳腺组织病理组织学变化的影响
MT对LPS诱导的小鼠乳腺组织病理组织学变化的影响见图5。试验第7和14天,空白对照组小鼠乳腺腺泡分布均匀,形态结构完整,无炎性细胞(图5-A、图5-E);而模型组小鼠乳腺腺泡分布不均匀,并且腺泡遭到了破坏,腺泡壁有明显水肿、增厚等变化,同时泡腔中浸润了大量的嗜中性粒细胞、炎性细胞(图5-B、图5-F)。灌胃MT 7 d后,小鼠乳腺组织腺泡中的嗜中性粒细胞、炎性细胞数量减少,但是不明显,MT高剂量组的效果略大于MT低剂量组(图5-C、图5-D)。灌胃MT 14 d后,乳腺组织细胞壁结构逐渐恢复完整,炎性症状得到缓解,嗜中性粒细胞、炎性细胞大大减少(图5-G、图5-H),MT高剂量组的效果略大于MT低剂量组。
2.3 MT对LPS诱导的小鼠血清中炎性细胞因子含量的影响
如图6所示,试验第7和14天,经过LPS诱导后,模型组小鼠血清中促炎细胞因子TNF-α、IL-1β、IL-6的含量与空白对照组相比均极显著升高(P<0.01),而抗炎细胞因子IL-10的含量则极显著降低(P<0.01)。灌胃MT 7 d后,与模型组相比,MT低、高剂量组小鼠血清中促炎细胞因子TNF-α、IL-1β、IL-6的含量极显著降低(P<0.01),而抗炎细胞因子IL-10的含量极显著升高(P<0.01),且MT高剂量组的变化幅度略大于MT低剂量组,但差异不显著(P>0.05);灌胃MT 14 d后,小鼠血清中促炎细胞因子TNF-α、IL-1β、IL-6和抗炎细胞因子IL-10含量的变化趋势与灌胃MT 7 d后相同。
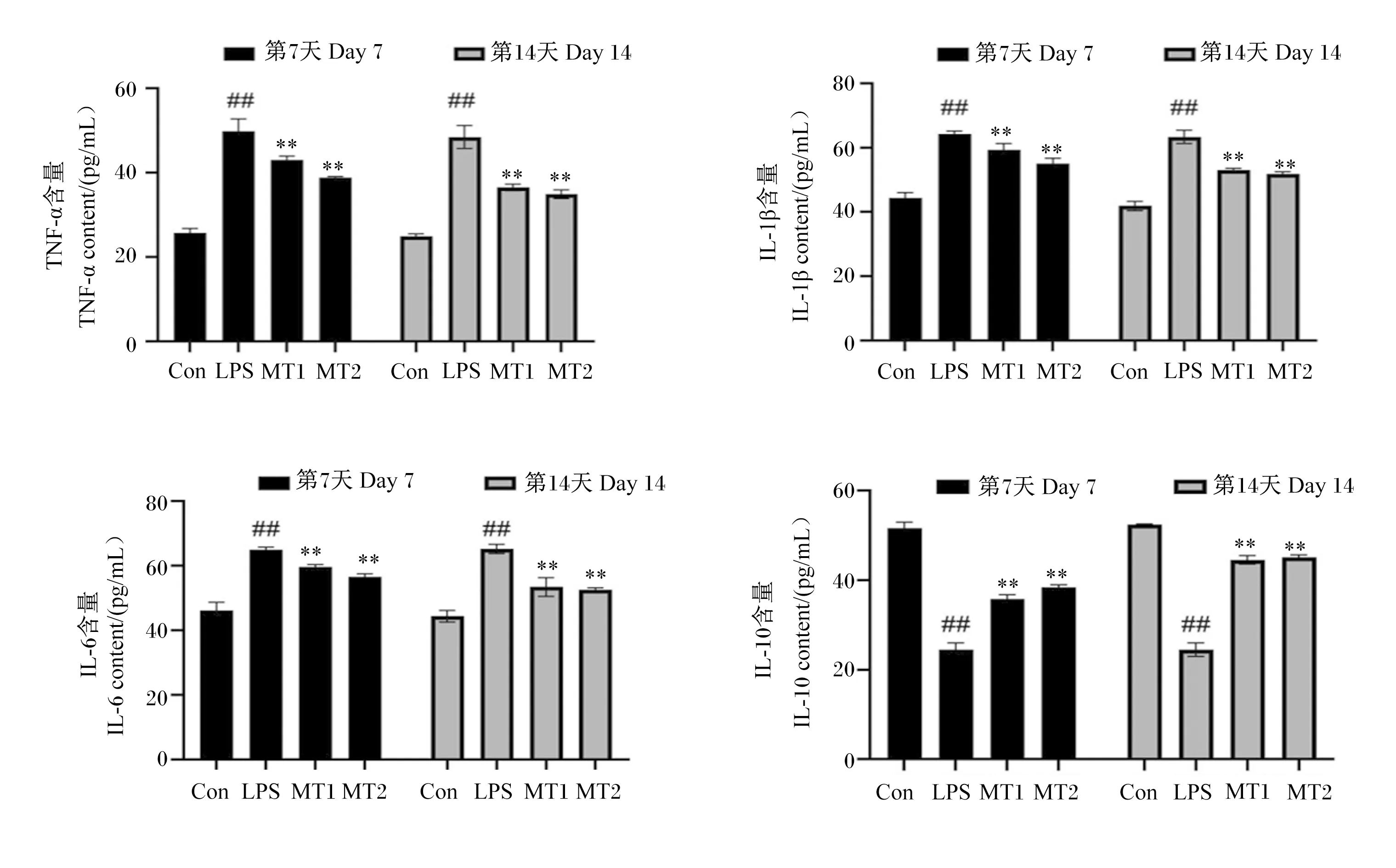
Con:空白对照组;LPS:模型组;MT1:MT低剂量组;MT2:MT高剂量组。模型组数据柱标注##表示与空白对照组相比差异极显著(P<0.01)。MT低或高剂量组标注**表示与模型组相比差异极显著(P<0.01)。下图同。Con: blank control group; LPS: model group; MT1: low-dose MT group; MT2: high-dose MT group. Date column of model group with ## represents extremely significant difference compared with blank control group (P<0.01). Date column of low-dose or high-dose MT group with ** represents extremely significant difference compared with model group (P<0.01). The same as below.图6 MT对LPS诱导的小鼠血清中炎性细胞因子含量的影响Fig.6 Effects of MT on serum inflammatory cytokine contents of mice induced by LPS (n=7)
2.4 MT对LPS诱导的小鼠血清中抗氧化指标的影响
如图7所示,试验第7和14天,经过LPS诱导后,与空白对照组相比,模型组小鼠血清中SOD、GSH-Px与CAT活性极显著降低(P<0.01),MDA含量极显著升高(P<0.01)。无论是灌胃MT 7 d后还是14 d后,与模型组相比,MT低、高剂量组小鼠均表现为血清中SOD、GSH-Px与CAT活性极显著增强(P<0.01),MDA含量极显著降低(P<0.01),且MT高剂量组的变化幅度略大于MT低剂量组,但差异不显著(P>0.05)。
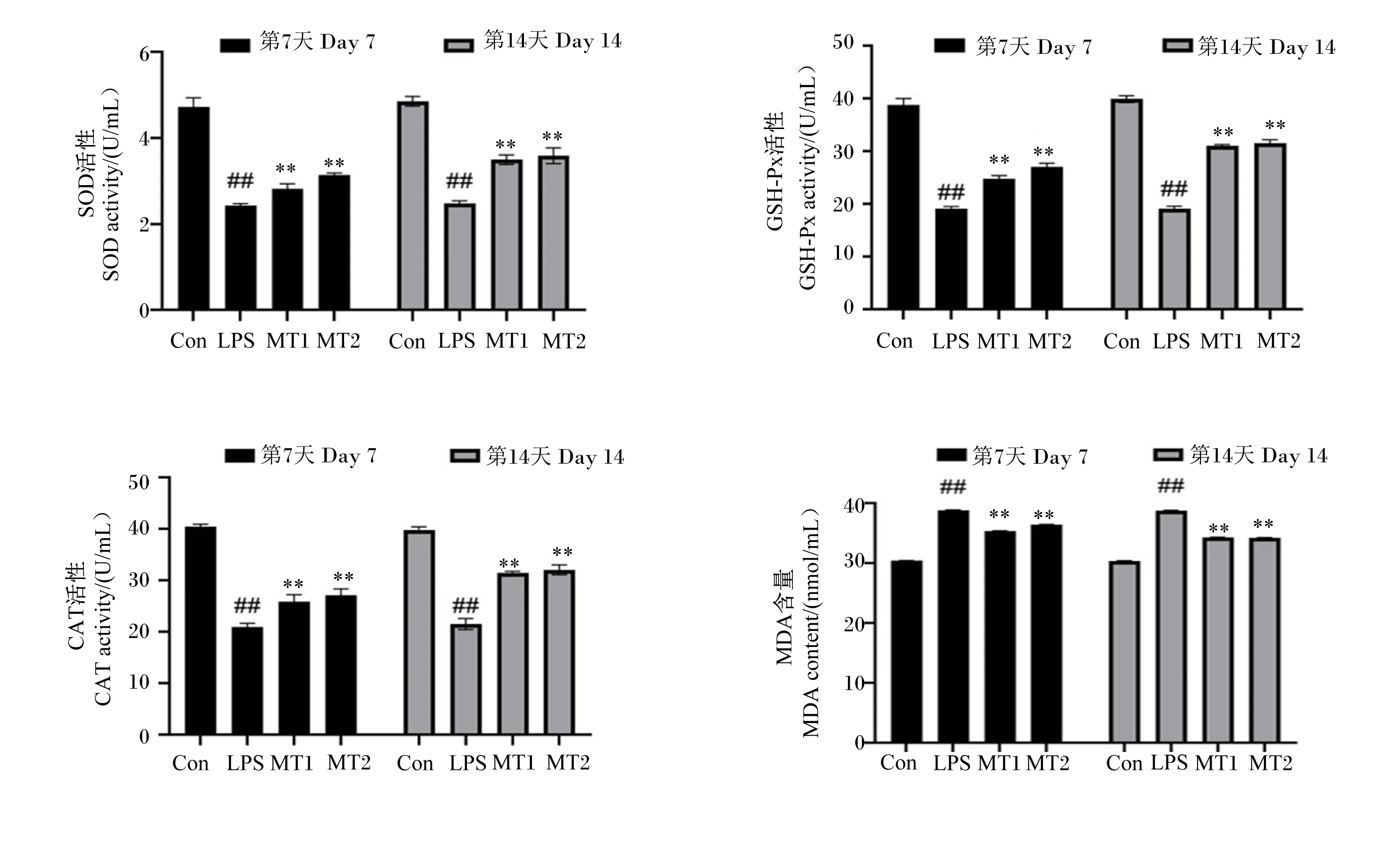
图7 MT对LPS诱导的小鼠血清中抗氧化指标的影响Fig.7 Effects of MT on serum antioxidant indexes of mice induced by LPS (n=7)
3 讨 论
3.1 小鼠乳腺炎模型的建立
乳腺炎是奶牛养殖场中高发的传染病,该疾病不仅会导致乳产量及乳品质的下降,而且会提高饲养成本,对养殖者的经济效益产生不利影响。由于小鼠和奶牛乳腺组织之间的相似性,作为一种替代方法,Chandler[16]在1970年成功建立了小鼠乳腺炎模型,为解决奶牛乳腺炎问题提供了良好的平台。
革兰氏阴性菌是引起奶牛乳腺炎的常见病原体[17],LPS是大肠杆菌等革兰氏阴性菌细胞壁的主要成分,当机体受到LPS刺激时,细胞会产生TNF-α、IL-1β和IL-6等促炎介质,诱导嗜中性粒细胞和淋巴细胞的产生,从而介导炎症反应[18]。张弛[19]、许店文[20]在小鼠第4对乳腺每侧灌注50 μL浓度为0.2 mg/mL的LPS构建小鼠乳腺炎模型,通过酶联免疫吸附测定(ELISA)法测定乳腺组织和血清中促炎细胞因子TNF-α、IL-1β的含量,结果显示构建乳腺炎模型小鼠上述促炎细胞因子的含量极显著升高;此外,由于促炎细胞因子的作用,大量的嗜中性粒细胞和炎性细胞聚集在乳腺腺泡泡腔中,同时腺泡壁有明显的水肿、增厚等变化。本试验结果与上述研究结果相同。这是由于当机体乳腺组织发生明显的炎性反应时,大量的嗜中性粒细胞从血管中渗出,并向发生炎症的组织移动聚集[21]。
因此,结合本试验中小鼠乳腺组织病理学变化结果以及血清和乳腺组织中促炎细胞因子含量的变化,证实在第4对乳腺每侧灌注50 μL浓度为0.2 mg/mL的LPS即可成功构建小鼠乳腺炎模型。
3.2 MT对LPS诱导的小鼠乳腺炎的防治作用
研究发现,LPS可以与细胞膜上的Toll样受体4(TLR4)相结合,从而激活核因子-κB(NF-κB)信号通路,被激活的NF-κB转位进入细胞核后,会产生大量的促炎细胞因子如TNF-α、IL-1β与IL-6,这些促炎细胞因子可以刺激免疫细胞、内皮细胞和其他细胞产生更多的活性氧(ROS)、NO、过氧化氢(H2O2)等自由基的生成,持续激活炎症信号通路,并进一步引发炎症反应和氧化应激,导致细胞损伤,甚至细胞凋亡和死亡[22]。
MT是一种脂溶性物质,可以穿过细胞膜作用于各种细胞器,具有抗应激、抗炎、促进睡眠、改善情绪、调节生殖和增强免疫等多种生理学功能[23-24]。此外,MT本身及其代谢物也是有效的抗氧化剂和自由基清除剂,可以通过自身吲哚环上的5-甲氧基吸收ROS,将其转变为非氧化物质,MT变成低毒的中间产物N1-乙酰-N2-甲酰-5-甲氧犬尿酞胺,成为比自身抗氧化能力更强的物质,清除更多的ROS[25]。MT主要在肝脏中代谢,经肾脏排出[26],其代谢物可通过电子转移、金属螯合等机制的方式,修复生物靶点,发挥联合抗氧化作用[27]。此外,MT还可以通过核受体抑制NF-κB的表达和激活,阻止其转移到细胞核并与DNA结合,并激活DNA修复机制,减少炎症介质的合成,调节炎症因子的表达,从而减轻炎症反应的程度[28]。
研究表明,炎症反应过程中,TNF-α、IL-1β以及IL-6都是非常重要的细胞因子,在体内引发和扩大炎症反应中具有重要的信息传递作用[29]。当血管内皮细胞中TNF-α、IL-1β、IL-6等促炎细胞因子含量升高后,会使白细胞黏附于血管内皮细胞上,导致血管壁通透性增强,嗜中性粒细胞从血管中渗出,从而启动炎症级联反应,造成乳腺组织炎性病理损伤[30]。IL-10是一种重要的抗炎细胞因子,主要由T辅助细胞产生,通过下调细胞因子受体及其下游信号通路的表达来抑制促炎细胞因子如TNF-α、IL-1β、IL-6等的过度表达,从而减缓炎症反应过程[31]。李洪洋等[32]研究表明,使用浓度为10 μg/mL的LPS刺激奶牛乳腺上皮细胞12 h,再经不同剂量(1、5、10、50、100 μmol/L)的MT处理48 h后发现,注射不同剂量的MT均能够显著抑制LPS诱导的奶牛乳腺上皮细胞中TNF-α、IL-1β和IL-6含量的升高。本试验测定了LPS诱导的小鼠血清中炎性细胞因子的含量,结果表明,MT可以极显著抑制LPS诱导的小鼠血清中促炎细胞因子TNF-α、IL-1β、IL-6含量的升高和抗炎细胞因子IL-10含量的降低,从而缓解LPS诱导的乳腺炎症反应。与本试验结果相似,有研究发现,在小鼠乳腺导管灌注50 μL浓度为0.2 mg/mL的LPS溶液1 h后,再静脉注射不同浓度(5、10、20 mg/kg)的MT,结果发现不同浓度的MT均可以减轻LPS诱导的乳腺损伤,抑制LPS诱导的小鼠乳腺组织和乳腺上皮细胞中促炎细胞因子TNF-α、IL-1β和IL-6的产生[33],表明MT对LPS诱导的小鼠乳腺炎症有缓解作用。
氧化还原平衡是维持机体正常生命活动的必要条件之一,当细胞内产生大量的ROS时,会直接攻击生物膜中的不饱和脂肪酸,导致脂质过氧化反应的发生,从而破坏细胞膜的完整性和稳定性。与此同时,ROS的大量产生还会降低细胞内抗氧化酶的活性,从而加剧氧化应激反应,当抗氧化酶无法有效清除自由基时,自由基堆积将导致细胞膜和其他生物大分子的氧化损伤,严重时会导致细胞损伤和死亡[34]。有研究表明,MT对大鼠脑高压氧诱导的氧化应激有保护作用,可以增强抗氧化酶SOD和GSH-Px的活性[35]。也有研究表明,饲喂外源MT可以增强大鼠部分内脏及脑中SOD和GSH-Px等抗氧化酶的活性,减少NO、ROS等自由基的生成,从而抑制脂质过氧化反应,降低LPS对机体的氧化损伤[36-37]。在本试验中,灌胃MT可极显著提高LPS诱导的小鼠血清中SOD、GSH-Px和CAT活性,并极显著降低MDA含量。
综上所述,LPS诱导小鼠乳腺炎的炎症过程会伴随着机体氧化应激反应的发生,产生大量的ROS,导致促炎细胞因子的释放,通过破坏细胞膜造成乳腺组织损伤。而MT可以缓解LPS造成的小鼠乳腺组织损伤,其除了通过本身所具有的抗氧化特性直接消除有毒的氧衍生物外,还可以通过增强抗氧化酶的活性间接起到抗氧化剂的作用,从而抑制炎症反应,缓解氧化应激[38]。
4 结 论
① 在小鼠第4对乳腺两侧的乳腺导管各灌注50 μL浓度为0.2 mg/mL的LPS可以成功构建小鼠乳腺炎模型。
② MT可以抑制促炎细胞因子的分泌,促进抗炎细胞因子的分泌,同时增强抗氧化酶活性,抑制氧化应激反应,从而改善LPS造成的小鼠乳腺组织病理损伤。
