白藜芦醇对脂多糖诱导的猪小肠上皮细胞炎性损伤和屏障功能障碍的缓解作用
2023-12-04张磊正冯志华龚建刚郝艳霜刘观忠刘彦慈马可为
张磊正 冯志华* 龚建刚 郝艳霜 刘观忠 刘彦慈 马可为
(1.河北农业大学动物科技学院,保定 071000;2.河北农业大学食品科技学院,保定 071000;3.保定职业技术学院,保定 071000)
肠道上皮屏障由位于肠道内壁的单层肠上皮细胞及细胞间连接(紧密连接、黏附连接和桥粒等)组成[1]。肠道上皮屏障破坏会增加肠道通透性,导致外界不利因素对内环境的侵袭,这是动物发生消化系统疾病与神经退行性疾病的重要原因[2-3]。因此,维持肠道上皮屏障的完整性是预防肠道相关疾病发生的关键靶点[4]。脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌细胞外壁的组成成分,被证明可破坏紧密连接蛋白、降低细胞跨膜电阻,是诱发肠道急性炎症的主要因素之一[5]。
近年来,在替抗的大背景下,植物来源多酚因具有类似抗生素的效果且不会引起抗药而被认为是抗生素的有效替代品[6-7]。白藜芦醇(resveratrol,RES)是一种从虎杖、葡萄和花生等植物中提取的多酚类植物抗毒素[8]。研究已证实,白藜芦醇在抗病原微生物、抗炎症、抗氧化和抗癌等方面具有重要作用[9]。另有研究表明,白藜芦醇可通过调节沉默调节蛋白-1(silencing regulatory protein-1,SIRT-1)信号通路减轻体外产肠毒大肠杆菌引起的猪肠上皮细胞炎症损伤[10]。白藜芦醇预处理人结直肠腺癌细胞可抑制右旋糖酐硫酸钠引起的肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-8(interleukin-8,IL-8)的产生和炎症信号分子的磷酸化[11],尽管白藜芦醇被证明有缓解动物肠道炎症的潜能[12-13],但关于白藜芦醇最适剂量的筛选及其在缓解肠道屏障损伤方面的作用鲜有报道。因此,本研究通过使用白藜芦醇干预LPS诱导的猪小肠上皮细胞(IPEC-J2细胞)炎症模型,探讨白藜芦醇在抗炎及改善肠道屏障方面的作用,为白藜芦醇在畜禽养殖中的应用提供理论依据。
1 材料与方法
1.1 试验材料
IPEC-J2细胞购自上海弘顺生物科技有限公司;白藜芦醇(纯度>99%)、MTT试剂盒和高糖DMEM培养基购自北京索莱宝科技有限公司;LPS与二甲基亚砜(dimethyl sulfoxide,DMSO)购自Sigma-Aldrich(上海)贸易有限公司;磷酸盐缓冲液(PBS)、胎牛血清(fetal bovine serum,FBS)、青-链霉素双抗与0.25%胰蛋白酶购自Biological Industries;TNF-α、IL-8、白细胞介素-10(interleukin-10,IL-10)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购自南京建成生物工程研究所;RNAiso Plus、PrimeScript RT reagent Kit with gDNA Eraser与TB Green Premix Ex Taq Ⅱ购自TaKaRa公司。
1.2 溶液配制
白藜芦醇存储液与工作液配制:将228.2 mg白藜芦醇溶于10 mL DMSO中,配制成0.1 mol/L的白藜芦醇存储液。将白藜芦醇存储液以完全培养基(含10% FBS、2%青-链霉素双抗的高糖DMEM培养基)稀释为不同浓度(0、5.0、20.0、35.0和50.0 μmol/L)工作液供后续使用。白藜芦醇存储液过滤除菌后分装,-20 ℃保存,工作液现配现用。
LPS存储液与工作液配制:将10 mg LPS溶于10 mL完全培养基中,配制成1 mg/mL的LPS存储液。将LPS存储液以完全培养基稀释为不同浓度(0、0.5、1.0、5.0和10.0 mg/L)工作液供后续使用。LPS存储液过滤除菌后分装,-20 ℃保存,工作液现配现用。
1.3 试验方法
1.3.1 细胞培养
IPEC-J2细胞复苏后,接种于含完全细胞培养基的25 cm2培养瓶中,并放在37 ℃、体积分数5% CO2的细胞培养箱中培养,待细胞传代3次脱毒后,生长汇合至85%以上时进行分组使用。
1.3.2 细胞活性检测
取对数生长期的IPEC-J2细胞,0.25%胰酶消化重悬后以每孔1×104个细胞接种到96孔板中,每孔加200 μL细胞悬液。待细胞生长汇合至85%左右,以非完全培养基(含2%青-链霉素双抗的高糖DMEM培养基)饥饿培养6 h后,加入不同浓度(0、0.5、1.0、5.0和10.0 mg/L)LPS和白藜芦醇(0、5.0、20.0、35.0和50.0 μmol/L)处理细胞18 h(处理时间由预试验确定),每组6个复孔。后向每孔中添加10 μL噻唑蓝溶液(5 g/L)和90 μL完全培养基,孵育4 h除去上清液,每孔中加入110 μL甲瓒溶解液振荡10 min,充分混匀后用酶标仪检测490 nm波长和参考波长570 nm处的吸光度值,确定不同浓度下药品对细胞的毒性。
根据细胞活性检测结果与前人研究结果[14],选择最佳LPS浓度(10.0 mg/L)作为造模浓度,无细胞毒性的白藜芦醇浓度(5.0、20.0、35.0 μmol/L)作为预处理浓度,每组设6个复孔。同样以MTT法检测白藜芦醇预处理后LPS诱导下的IPEC-J2细胞活性,同时设置对照组(不添加LPS与白藜芦醇)与LPS单独刺激组(单独添加10.0 mg/L LPS)。之后试验均采用上述分组进行。
细胞活性(%)=100×(试验孔490 nm处
吸光度值-试验孔570 nm处吸光度值)/
(对照孔490 nm处吸光度值-对照孔
570 nm处吸光度值)。
1.3.3 细胞迁移率检测
IPEC-J2细胞以2.5×105个/mL的密度接种于6孔板,完全培养基培养细胞,待生长汇合至85%左右,弃去旧培养液,非完全培养基饥饿培养6 h后,以不同浓度白藜芦醇预处理细胞18 h,LPS进行诱导培养18 h。以200 μL无菌枪头在皿底作等宽的直线划痕,并用无菌PBS轻柔清洗3次。非完全培养基培养24 h后于倒置显微镜下观察、拍照并采集图片,采用Image J V1.8.0软件分析划痕宽度并计算细胞迁移率。每组设置3个复孔,试验独立重复3次。
细胞迁移率(%)=[(0 h划痕面积-24 h
划痕面积)/0 h划痕面积]×100。
1.3.4 炎症因子分泌量检测
IPEC-J2细胞以2.5×105个/mL的密度接种于6孔板,完全培养基培养细胞,至细胞生长汇合至85%左右,弃去旧培养液,非完全培养基饥饿培养6 h后,以不同浓度白藜芦醇预处理细胞18 h,LPS进行诱导培养18 h。培养结束后,小心吸取细胞培养液,2 500 r/min离心5 min后仔细收集上清液。参照IL-8、IL-10和TNF-α的ELISA试剂盒说明书测定细胞上清液中IL-8、IL-10和TNF-α含量。
1.3.5 Toll样受体4(Toll-like receptor 4,TLR4)/核转录因子-κB(nuclear factor-κB,NF-κB)信号通路及紧密连接相关基因表达检测
上述1.3.4中细胞上清液收取后,参照RNAiso Plus说明书裂解细胞提取总RNA,采用TB Green反转录试剂盒生成cDNA,采用实时荧光定量基因扩增仪对各组cDNA进行目的基因扩增。PCR扩增条件为95 ℃预变性300 s,之后95 ℃ 15 s、60 ℃ 20 s和72 ℃ 20 s,35个循环。以β-肌动蛋白(β-actin)作为内参基因,引物使用Primer 5.0和NCBI进行设计,NCBI-BLAST验证引物特异性后由苏州金唯智生物科技有限公司合成,使用2-ΔΔCt方法分析每个目的基因的mRNA相对表达量。每组设置3个复孔,试验独立重复3次。详细引物序列如表1所示。

表1 基因引物序列Table 1 Primer sequences of genes
1.4 数据统计与分析
所有数据以Excel 2019归纳整理后,采用SPSS 22.0软件对对照组与LPS单独刺激组进行独立样本t检验,判断LPS对IPEC-J2细胞的影响;采用单因素方差分析(one-way ANOVA)检验组间差异,并采用LSD法进行多重比较。各组数据以“平均值±标准差”表示,P<0.05为差异显著。
2 结果与分析
2.1 白藜芦醇和LPS对IPEC-J2细胞活性的量效关系
由图1-A可见,与对照组(0 μmol/L白藜芦醇)相比,5.0、20.0和35.0μmol/L白藜芦醇对IPEC-J2细胞活性无显著影响(P>0.05),50.0 μmol/L白藜芦醇可显著抑制IPEC-J2细胞活性(P<0.05),表明50.0 μmol/L白藜芦醇对IPEC-J2细胞有明显的细胞毒性,因此选择5.0、20.0和35.0 μmol/L作为后续试验浓度。

数据柱标注不同小写字母表示差异显著(P<0.05)。下图同。Value columns with different small letters mean significant difference (P<0.05). The same as below.图1 不同浓度的白藜芦醇和LPS对IPEC-J2细胞活性的影响Fig.1 Effects of different concentrations of RES and LPS on viability of IPEC-J2 cells
由图1-B可见,与对照组(0 mg/L LPS)相比,0.5和1.0 mg/L LPS对IPEC-J2细胞活性无显著影响(P>0.05),5.0和10.0 mg/L LPS可显著抑制IPEC-J2细胞活性(P<0.05),表明5.0和10.0 mg/L LPS对IPEC-J2细胞有明显的细胞毒性,但综合考虑对细胞炎性损伤和屏障功能的影响,选择10.0 mg/L LPS为后续造模浓度。
2.2 白藜芦醇对LPS诱导的IPEC-J2细胞活性的影响
由图2可见,与对照组相比,LPS刺激显著降低了IPEC-J2细胞活性(P<0.05)。20.0 μmol/L白藜芦醇预处理细胞后显著提高了由LPS刺激引起的IPEC-J2细胞活性的降低(P<0.05),但5.0、35.0 μmol/L白藜芦醇预处理对LPS刺激下IPEC-J2细胞活性的影响不显著(P>0.05)。

“*”表示2组间差异显著(P<0.05)。下图同。“*” indicate significant difference between two groups (P<0.05). The same as below.图2 白藜芦醇对LPS诱导的IPEC-J2细胞活性的影响Fig.2 Effects of RES on activity of LPS-induced IPEC-J2 cells
2.3 白藜芦醇对LPS诱导的IPEC-J2细胞迁移率的影响
由图3可见,与对照组相比,LPS刺激未对IPEC-J2细胞迁移率产生显著影响(P>0.05)。相较于LPS单独刺激组,5.0、20.0 μmol/L白藜芦醇预处理后IPEC-J2细胞迁移率显著提高(P<0.05),但35.0 μmol/L白藜芦醇预处理对LPS刺激下IPEC-J2细胞迁移率的影响不显著(P>0.05)。
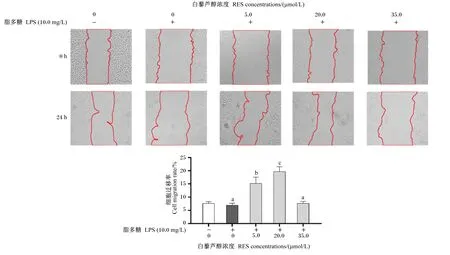
图3 白藜芦醇对LPS诱导的IPEC-J2细胞迁移率的影响Fig.3 Effects of RES on migration rate of LPS-induced IPEC-J2 cells
2.4 白藜芦醇对LPS诱导的IPEC-J2细胞炎症因子分泌量的影响
由图4可见,LPS刺激显著提高了细胞上清液中IL-8、TNF-α含量(P<0.05),显著降低了IL-10含量(P<0.05)。5.0、20.0和35.0 μmol/L白藜芦醇预处理组细胞上清液中IL-8、TNF-α含量显著低于LPS单独刺激组(P<0.05),IL-10含量显著高于LPS单独刺激组(P<0.05)。
2.5 白藜芦醇对LPS诱导的IPEC-J2细胞TLR4/NF-κB信号通路相关基因mRNA相对表达量的影响
由图5可见,与对照组相比,LPS单独刺激显著提高了细胞中IL-8、TNF-α、白细胞介素-1β(interleukin-1β,IL-1β)、TLR4和髓样分化因子88(myeloid differentiation factor 88,MyD88)的mRNA相对表达量(P<0.05),显著降低了IL-10的mRNA相对表达量(P<0.05)。相较于LPS单独刺激组,5.0、20.0 μmol/L白藜芦醇预处理组细胞中TLR4/NF-κB信号通路相关基因的表达得到改善,表现为IL-8、TNF-α、IL-1β、TLR4和MyD88的mRNA相对表达量显著降低(P<0.05),IL-10与NF-κB抑制蛋白α(NF-κB inhibitor protein α,IκBα)的mRNA相对表达量显著升高(P<0.05);此外,35.0 μmol/L白藜芦醇预处理显著降低了细胞中IL-8、TNF-α、TLR4和MyD88的mRNA相对表达量(P<0.05),显著提高了IκBα的mRNA相对表达量(P<0.05),但未观察到IL-1β和IL-10的mRNA相对表达量的显著变化(P>0.05)。

图5 白藜芦醇对LPS诱导的IPEC-J2细胞TLR4/NF-κB信号通路相关基因mRNA相对表达量的影响Fig.5 Effects of RES on mRNA relative expression levels of TLR4/NF-κB signaling pathway-related genes in LPS-induced IPEC-J2 cells
2.6 白藜芦醇对LPS诱导的IPEC-J2细胞紧密连接相关基因mRNA相对表达量的影响
由图6可见,与对照组相比,LPS刺激显著降低了细胞中封闭蛋白-1(claudin-1)、闭锁蛋白(occludin)和闭锁小带蛋白-1(ZO-1)的mRNA相对表达量(P<0.05)。相较于LPS单独刺激组,5.0、20.0 μmol/L白藜芦醇预处理组细胞中claudin-1、occludin和ZO-1的mRNA相对表达量显著提高(P<0.05)。此外,35.0 μmol/L白藜芦醇预处理组细胞中ZO-1 mRNA相对表达量显著高于LPS单独刺激组(P<0.05)。

图6 白藜芦醇对LPS诱导的IPEC-J2细胞紧密连接相关基因mRNA相对表达量的影响Fig.6 Effects of RES on mRNA relative expression levels of tight junction-related genes in LPS-induced IPEC-J2 cells
3 讨 论
炎症性肠病是兽医临床中常见的一类疾病,以消化机能障碍、采食量下降和腹泻为主要特征,严重危害畜牧业发展和动物福利。LPS是被广泛使用的炎症诱导剂,对肠道细胞屏障功能的损伤作用已在体外研究中被广泛证实[15-16]。而白藜芦醇具有抗氧化、抗肿瘤和抗炎的功能,有证据表明白藜芦醇可以通过减少黏膜炎症来改善肠炎[9,11,13]。因此,本试验以LPS作为诱导试剂,建立猪小肠上皮细胞屏障炎性损伤模型,以评估白藜芦醇对LPS诱导的猪小肠上皮细胞炎性损伤和屏障功能障碍的缓解作用。
肠上皮细胞参与了肠道屏障的形成,这对维持动物的消化效率与内环境的稳定至关重要,肠上皮细胞迁移速率能反映肠道损伤修复的情况[17-18]。已有研究表明,LPS对细胞迁移愈合过程有显著的负面作用[19-20]。在本试验中,LPS虽然导致IPEC-J2细胞迁移率出现下降的趋势,但影响不显著,这与上述结果有所区别,造成这种结果的原因可能与不同物种、不同组织的细胞对LPS敏感度存在差异有关。杨凯等[21]发现,以50 μg/mL的白藜芦醇处理血管内皮细胞后可有效缓解LPS对细胞增殖、迁移和侵袭过程的抑制作用。同样,本试验采用5.0、20.0 μmol/L白藜芦醇预处理IPEC-J2细胞,显著提高了LPS刺激下IPEC-J2细胞的迁移能力,这从侧面反映了白藜芦醇增强了肠上皮单层细胞炎性损伤愈合的能力。
在革兰氏阴性菌感染过程中,LPS作为病原体相关分子模式(pathogen associated molecular patterns,PAMPs),被最早发现的模式识别受体(pattern recognition receptor,PRR)TLR4识别后,募集衔接分子MyD88与下游效应子白细胞介素-1家族受体相关激酶1-4(IL-1 receptor-associated kinases 1 to 4,IRAK1-4)和受体相互作用蛋白1(receptor-interacting protein 1,RIP1)结合,经过级联反应引起NF-κB抑制蛋白激酶β(inhibitor of NF-κB kinase β,IKKβ)的磷酸化和蛋白酶体降解以及主转录因子NF-κB的二聚体释放,而后靶位炎症基因转录,导致发生促炎因子级联反应[22]。这种级联反应将直接影响上皮细胞的活性与屏障功能[23]。在本试验中,LPS激活了TLR4/NF-κB信号通路,改变了炎性因子(IL-8、IL-1β、IL-10和TNF-α)的表达,提高了细胞上清液中IL-8、TNF-α的含量。袁昊等[24]研究显示,白藜芦醇是通过介导NF-κB信号通路发挥其抗炎功能的。Zeng等[25]研究发现,白藜芦醇通过调控miR-34a/SIRT1/NF-κB通路,减轻了烟草焦油提取物诱导的呼吸道上皮细胞炎性损伤。瞿秋红[26]的研究表明,白藜芦醇可以显著降低猪小肠上皮细胞炎症因子mRNA的表达,提示白藜芦醇有利于改善肠道炎症反应。同样,本试验中,白藜芦醇通过下调TLR4/NF-κB信号通路级联反应,降低了下游炎症因子的mRNA表达与细胞上清液中促炎因子(IL-8、TNF-α)的含量。在相似的试验中,白藜芦醇改善了IPEC-J2细胞中TLR4/NF-κB信号通路关键蛋白(IκBα、NF-κB p65)的表达,缓解因LPS引起的炎症反应[26],这佐证了本试验结果。
早期研究表明,肠道炎症可破坏肠道屏障的完整性,肠道屏障失效又会加剧并扩大肠道炎症,而这种屏障功能障碍可能是紧密连接蛋白改变的结果[27]。有研究发现,LPS能通过改变紧密连接相关基因(ZO-1、occludin和claudin家族)的表达,破坏肠上皮屏障功能[28-30]。本试验中,LPS刺激后,IPEC-J2细胞中紧密连接相关基因mRNA的相对表达量均显著降低,与上述结论一致。Mayangsari等[31]发现,白藜芦醇通过抑制occludin的酪氨酸磷酸化,改善Caco-2细胞氧化应激模型中上皮屏障破坏。还有研究发现,白藜芦醇的浓度为100.0 μmol/L时,可通过抑制Notch1通路活性来上调HT-29细胞紧密连接蛋白(occludin、ZO-1、claudin-1)的表达[32]。本研究发现,5.0、20.0 μmol/L白藜芦醇预处理IPEC-J2细胞后,LPS引起的紧密连接相关基因(ZO-1、occludin和claudin-1)mRNA相对表达量的下降得到显著缓解。结合上述白藜芦醇缓解TLR4/NF-κB信号通路的过度活化和降低促炎因子的分泌,我们推测白藜芦醇能通过缓解炎症损伤,有效抑制LPS诱导的IPEC-J2细胞紧密连接相关基因ZO-1、claudin-1和occludin表达的降低,从而维持肠道上皮屏障稳态。
4 结 论
综上所述,5.0和20.00 μmol/L白藜芦醇可提高IPEC-J2细胞迁移率,调节炎症细胞因子分泌,缓解TLR4/NF-κB信号通路的过度活化,提高紧密连接相关基因表达,从而缓解LPS诱导的IPEC-J2细胞炎症反应与屏障功能障碍。
