浒苔生物制品对云龙石斑鱼摄食、生长及非特异性免疫的影响
2023-12-04周志斌赵丽丽王艺超王鲁波代明琴张西超梁萌青徐后国程镇燕卫育良
周志斌 赵丽丽 王艺超 王鲁波 代明琴 张西超 马 强 梁萌青 徐后国 程镇燕 卫育良*
(1.天津农学院水产学院,天津 300392;2.中国水产科学研究院黄海水产研究所,青岛 266071;3.青岛海大生物集团股份有限公司,青岛 266114)
浒苔(Enteromorphaprolifera)是“海上草原”的罪魁祸首,在各沿海国家近海广泛分布,有着极强的环境适应能力与繁殖能力[1]。浒苔爆发给沿岸生态环境构成极大危害[2],所造成的经济损失也非常大[3]。但是浒苔也并非没有价值,相反,其富含多种生物活性物质,如多糖、酚类、多肽、生物碱等[4]。因此,开发利用浒苔资源,更好地挖掘其生物资源价值对浒苔治理具有重要意义。
浒苔属藻类,可作为食品添加剂供人类食用[5]。在畜禽上,研究发现其作为饲料原料能够促进肉兔[6]、肉鸡[7]、肉鸭[8]的生长并提高免疫功能,提高蛋鸡[9]、蛋鸭[10]的产蛋性能以及蛋品质,增加奶牛的产奶量[11]。在水产动物上,大黄鱼(Larimichthyscrocea)[12]、罗非鱼(Oreochromismossambicus×Oreochromisniloticus)[13]、皱纹盘鲍(Haliotisdiscushannai)[14]、鲈鱼(Lateolabraxjaponicus)[15]、珍珠龙胆石斑(Epinepheluslanceolatus)[16]、红鳍东方鲀(Takifugurubripes)[17]、刺参(Stichopusjaponicus)[18]、鲫鱼(Carassiusauratus)[19]、大菱鲆(Scophthalmusmaximus)[20]等也已开展研究,并发现浒苔粉(EPM)对这些水产动物的生长、消化酶活性、肌肉品质、非特异性免疫等方面具有重要作用。但是,这些研究大都以单一的EPM作为研究对象,浒苔的加工工艺过于简单,无法充分发挥浒苔含有的生物活性物质在调节水产动物生长、免疫等方面的重要作用。因此,有必要通过优化加工工艺,进一步提高浒苔的经济价值。

1 材料与方法
1.1 试验材料
试验用EPM(粗蛋白质含量为9.26%,粗脂肪含量为1.70%,总糖含量为39.37%)是黄海海域采集的天然浒苔经剪切破碎、烘干粉碎所得;EPH(粗蛋白质含量为7.93%,粗脂肪含量为0.28%,总糖含量为43.72%)是采用专一的浒苔细胞壁多糖降解酶对浒苔进行生物破壁,然后通过浒苔多糖裂解酶将细胞内糖链定向酶切,获得高免活性低聚糖片段,并通过喷雾干燥而来;EPP(粗蛋白质含量为5.74%,粗脂肪含量为0%,总糖含量为50.40%)是浒苔经酶解提取、纯化、浓缩、喷雾干燥而成的水溶性硫酸多糖。
1.2 试验设计及试验饲料
本试验以鱼粉、磷虾粉、豆粕为主要蛋白质源,鱼油为主要脂肪源,配制成粗蛋白质含量为48%左右、粗脂肪含量为10%左右的等氮等脂的饲料。本试验主要比较云龙石斑鱼对不同浒苔生物制品的利用差异,试验设计7个组(每组3个重复,每个重复25尾鱼),分别饲喂无添加的基础饲料(对照组)及分别添加0.2%的EPH(EPH0.2%组)、0.4%的EPH(EPH0.4%组)、0.03%的EPP(EPP0.03%组)、3.0%的EPM(EPM3.0%组)、0.1%二甲基-β-丙酸噻亭(DMPT0.1%组)和1.0%鱿鱼膏(SP1.0%组)的试验饲料。不同浒苔生物制品在饲料中的添加量是基于浒苔生物制品加工工艺的难易程度及浒苔生物制品的成本确定的,使不同浒苔生物制品在饲料中添加成本接近,同时,设计2个水平的EPH组,以便更好地理解云龙石斑鱼对浒苔生物制品的利用情况,DMPT0.1%组和SP1%组的设置是用于研究浒苔生物制品的诱食性。试验饲料组成及营养水平见表1。

表1 试验饲料组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of experimental diets (DM basis) %
试验饲料的制作采用黄海水产研究所水产动物营养与饲料实验室的小型饲料制粒机制粒,制粒开始前,先将所有原料粉碎过80目筛网,按照饲料配方逐级充分混匀,加水后用制粒机制成直径为3 mm的饲料,加水量为饲料总重的35%,最后放入50 ℃烘箱烘8 h,在-20 ℃下保存备用。
1.3 试验动物及饲养管理
养殖试验在山东省海阳市黄海水产有限公司进行,试验所用云龙石斑鱼幼鱼也购于山东省海阳市黄海水产有限公司。试验开始前,先将所有石斑鱼鱼苗放入饲养桶内,进行1周的暂养试验,暂养期间饲喂商品饲料(购自青岛赛格林生物工程有限公司,其中粗蛋白质含量大约为50%,粗脂肪含量大约为10%),使石斑鱼适应饲养条件。饲养试验开始前,停食24 h,选择大小均匀的石斑鱼幼鱼[初始体重为(7.47±0.03) g]进行称重。然后,随机将鱼放入21个饲养桶内(7个组,每组3个重复),饲养桶体积为200 L,有效水体为180 L,每桶放25尾,流水养殖,持续充氧气,每天人工饱食投喂2次(07:30和18:30),并记录残饵质量,饲养试验周期为63 d。在整个试验过程中,对养殖水体状况进行了持续监测,饲养期间温度为22.5~24.5 ℃、盐度为22~29、pH为7.5~8.0、溶解氧含量为6~8 mg/L。
1.4 样品采集
试验开始前,在暂养桶中随机取10尾石斑鱼幼鱼,用于鱼体常规成分分析。试验结束后,停食24 h,分别称量每桶鱼的总重量,记录鱼的尾数,计算每桶鱼的平均重量。在每桶中随机取4尾鱼,用MS222(1∶10 000体积比)麻醉试验鱼。从尾静脉取血液,将取出的血液样本置于4 ℃静置3 h,3 500 r/min离心15 min,取上层血清,置于液氮中保存。然后,将鱼解剖后收集同一部位头肾、肝脏和肌肉样品。接着,取部分肝脏组织,放入固定液中,用于肝脏组织切片分析。将头肾、肝脏和肌肉的所有样品立即置于液氮中保存,再转移到-80 ℃冰箱中储存备用。取样结束后,每桶随机挑选2尾全鱼放入-20 ℃备用,用于体成分分析。
1.5 相关计算公式
存活率(%)=[试验结束每桶鱼尾数/
试验开始每桶鱼尾数]×100;
增重率(WGR,%)=[(终末体重-初始体重)/
初始体重]×100;
特定生长率(SGR,%/d)=[(ln终末体重-
ln初始体重)/饲养天数]×100;
摄食率(FI,%/d)={总干物质摄食量/[饲养
天数×(初始体重+终末体重)/2]}×100;
饲料转化率(FCR)=摄入饲料总量/(终末
体重-初始体重);
蛋白质效率(PER)=(终末体重-初始
体重)/(摄入饲料总量×饲料粗蛋白质含量);
蛋白质沉积率(PPV,%)=[(终末体重×终末
鱼体粗蛋白质含量-初始体重×
初始鱼体粗蛋白质含量)/(摄入饲料
总量×饲料粗蛋白质含量)]×100;
脂肪沉积率(LPV,%)=[(终末体重×
终末鱼体粗脂肪含量-初始体重×
初始鱼体粗脂肪含量)/(摄入
饲料总量×饲料粗脂肪含量)]×100;
累积摄食量(CFI,g)=摄入饲料总量/鱼尾数;
相对累积摄食量(RCF,g)=A组的累积摄食量-
B组的累积摄食量。
1.6 样品分析
饲料、鱼体组成的粗蛋白质、粗脂肪、粗灰分和水分含量参照AOAC(1984)[21]方法进行测定。其中水分含量是将样品放入烘箱105 ℃烘干至恒重,用失重法测定;粗蛋白质含量采用凯氏定氮法(FOSS 2300,瑞典)测定;肝脏粗脂肪含量通过氯仿甲醇法测定,其余粗脂肪含量采用索氏抽提法(FOSS 2050,瑞典)测定;粗灰分含量采用失重法测定,将样品在电磁炉上碳化后利用马弗炉高温(550 ℃)灼烧8 h测定。
血清或肝脏中糖、脂代谢相关指标:葡萄糖(GLU)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)含量;血清抗氧化指标:总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性及丙二醛(MDA)、还原型谷胱甘肽(GSH)含量;血清免疫指标:谷草转氨酶(GOT)、谷丙转氨酶(GPT)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、溶菌酶(LZM)活性,以上指标均采用南京建成生物工程研究所相关试剂盒,按照试剂盒说明书中的操作步骤进行测定。
1.7 RNA提取与基因表达测定
使用RNAiso Plus试剂盒(TaKaRa,日本)提取头肾中的总RNA,使用Evo M-MLV RT Mix试剂盒(湖南艾科瑞生物工程有限公司)进行反转录。RNA的纯度和浓度由超微量分光光度计(Colibri,德国)检测。所有RNA样品的260/280 nm的吸光度比值均在1.8~2.0,表明提取的RNA样品的纯度较高,可以满足后续分析。利用Evo M-MLV RT Mix试剂盒合成cDNA,保存于-40 ℃备用。
采用SYBR Green Premix Pro Taq HS qPCR Kit Ⅱ(湖南艾科瑞生物工程有限公司)和定量PCR仪(Roche Light Cycler 96,瑞士)进行实时荧光定量PCR(qRT-PCR)分析。以β-肌动蛋白(β-actin)和次黄嘌呤磷酸核糖基转移酶1(HPRT1)作为内参基因。反应体系由1 μL cDNA模板、5 μL 2×SYBR Green Pro Taq HS Premix Ⅱ、0.3 μL正向引物、0.3 μL反向引物和3.4 μL无菌水组成。程序如下: 95 ℃预变性30 s,然后依次进行“95 ℃变性5 s,57 ℃退火30 s,72 ℃延伸30 s”的40个循环。在扩增阶段后进行熔解曲线分析(从65 ℃增加到97 ℃,6.4 ℃/min),以确认唯一的产物条带。根据2-ΔΔCt法[22]计算目的基因相对表达量。引物序列见表2。

表2 引物序列Table 2 Primers sequences
1.8 攻毒试验
本试验所用哈维氏弧菌菌株来自中国科学研究院黄海水产研究所。菌种经活化、扩大培养后连续稀释,获得不同浓度的菌液用于攻毒试验。经预试验,获得哈维氏弧菌对云龙石斑鱼的半数致死量(LD50,7 d)为1×10-6CFU/mL。样品采集结束后,每个重复取10尾鱼进行攻毒试验,取0.2 mL半数致死量的哈维氏弧菌菌液注射到试验鱼腹腔中。统计云龙石斑鱼被攻毒后7 d的死亡数量,计算累积死亡率。
1.9 统计分析
所有统计分析均采用SPSS 26.0软件,对试验各数据进行单因素方差分析(one-way ANOVA),当方差分析显著时,采用Tukey氏法进行组间多重比较,所有数值以平均值±标准误表示。P<0.05为差异显著。
2 结 果
2.1 浒苔生物制品在云龙石斑鱼上的诱食效果
由表3可知,在初始体重接近的情况下,摄食第1餐DMPT0.1%组的摄食量(每组每尾鱼平均摄食的饲料质量)最大,显著高于对照组、EPH0.4%和EPP0.03%组(P<0.05)。
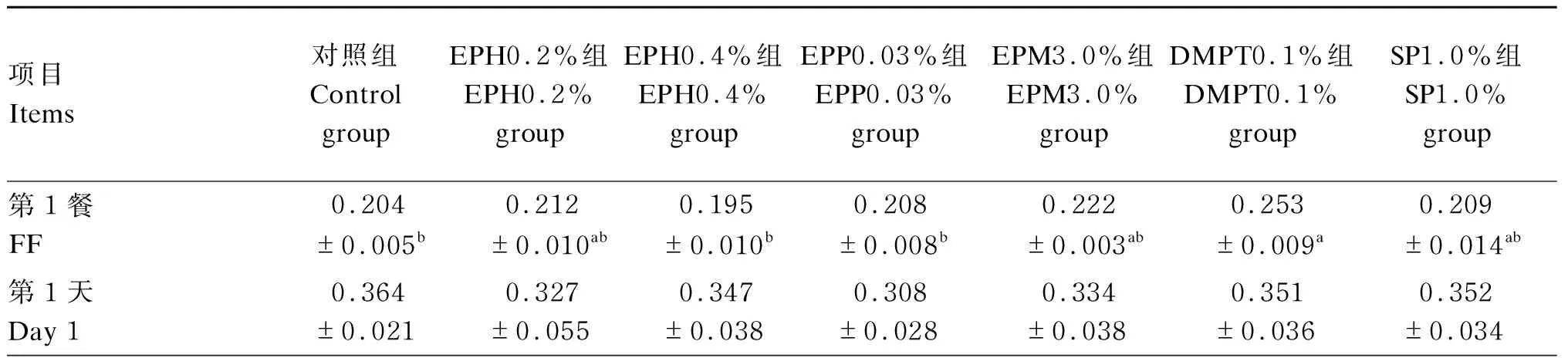
表3 饲喂21 d后各组每尾鱼的累积摄食量Table 3 Cumulative feed intake per fish in each group after 21 days of feeding g
由图1可知,在摄食3 d后,除EPP0.03%组外,与对照组相比的其余组的相对累积摄食量均为正值,而摄食10到21 d后,与对照组相比,所有浒苔生物制品组的相对累积摄食量均为正值。

横坐标中,数字1代表第1餐相对摄食量,数字2代表第1天相对摄食量,数字3代表前3天相对累积摄食量,数字4代表前5天相对累积摄食量,数字5代表前7天相对累积摄食量,数字6代表前10天相对累积摄食量,数字7代表前14天相对累积摄食量,数字8代表前21天相对累积摄食量。图2同。On the horizontal axis, No.1 represents the amount of relative feed intake of the first feeding (FF) meal, No.2 represents the amount of relative feed intake on day 1, No.3 represents the amount of relative cumulative feed intake on first 3 days, No.4 represents the amount of relative cumulative feed intake on first 5 days, No.5 represents the amount of relative cumulative feed intake on first 7 days, No.6 represents the amount of relative cumulative feed intake on first 10 days, No.7 represents the amount of relative cumulative feed intake on first 14 days, and No.8 represents the amount of relative cumulative feed intake on first 21 days. The same as Fig.2.图1 DMPT、浒苔生物制品与对照组摄食后21 d相对累积摄食量Fig.1 Relative cumulative feed intake of DMPT, E. prolifera bio-products compared with control group after 21 days of feeding
由图2可知,在摄食21 d后,相对累积摄食量在DMPT0.1%组与对照组之间均为正值;但是DMPT0.1%组与EPM3.0%组之间相对累积摄食量在摄食7 d之前为正值,摄食7 d以后为负值,且差距逐渐拉大;DMPT0.1%组与EPP0.03%组或EPH0.4%组之间的相对累积摄食量的变化趋势与DMPT0.1%组与EPM3.0%组之间的变化趋势相似,但是转折点出现在摄食10 d后。

图2 DMPT与浒苔生物制品组摄食后21 d相对累积摄食量Fig.2 Relative cumulative feed intake of DMPT and E. prolifera bio-products groups after 21 days of feeding
2.2 浒苔生物制品对云龙石斑鱼生长性能的影响
由表4可知,根据终末体重、增重率和特定生长率的结果发现,添加0.1%DMPT的云龙石斑鱼的生长性能最差,显著低于EPM3.0%组(P<0.05),与对照组相比,添加EPH、EPM和EPP有升高生长性能的趋势,且依次为EPM3.0%组>EPH0.2%组>EPH0.4%组>EPP0.03%组,但均无显著差异(P>0.05)。EPM3.0%组的摄食率最高,显著高于对照组(P<0.05)。此外,摄食率在所有试验组均高于对照组。饲料转化率、蛋白质效率和蛋白质沉积率在各组之间无显著差异(P>0.05)。
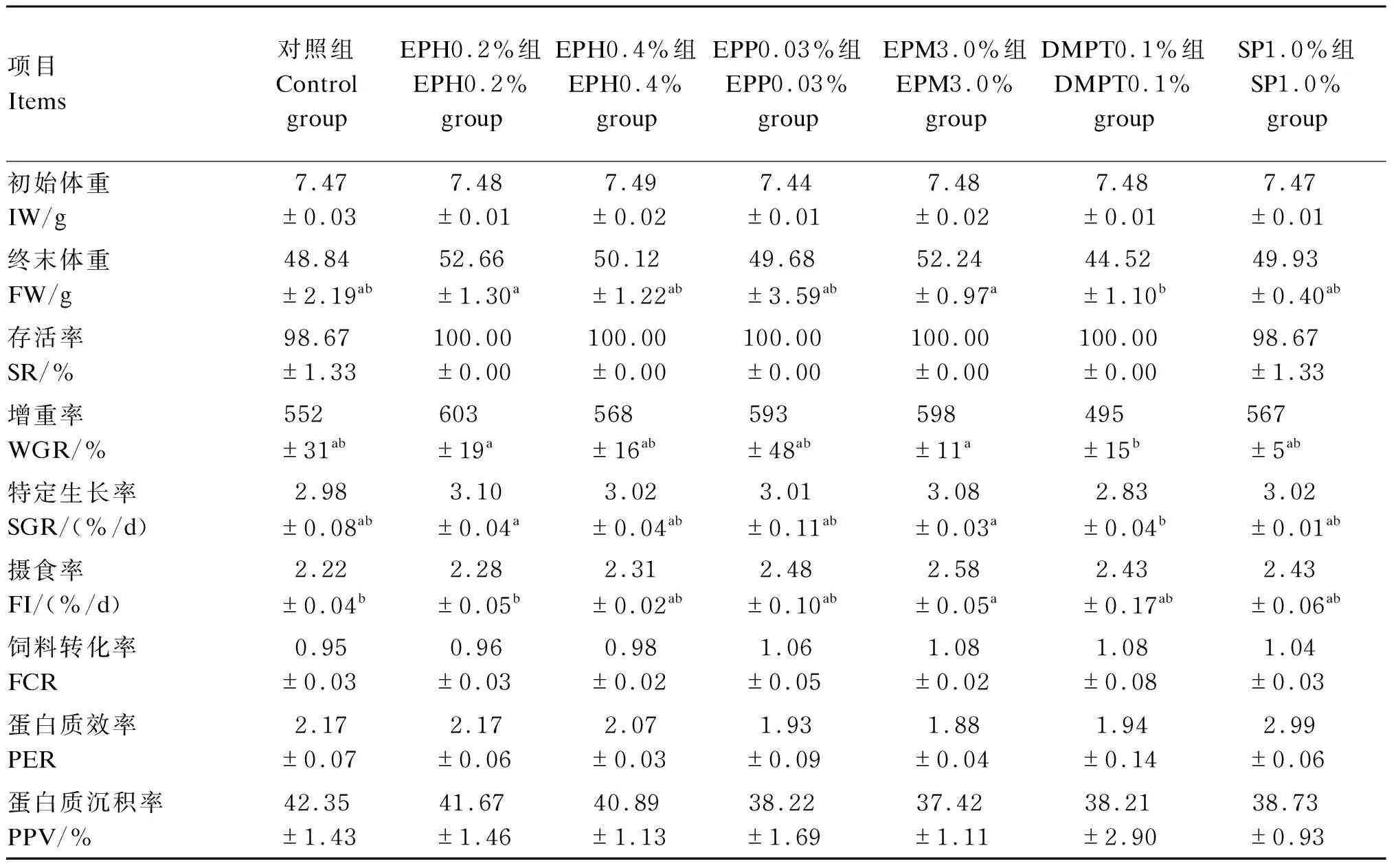
表4 浒苔生物制品对云龙石斑鱼生长性能的影响Table 4 Effects of E. prolifera bio-products on growth performance of Yunlong grouper
2.3 浒苔生物制品对云龙石斑鱼鱼体成分组成及糖、脂代谢的影响
由表5可知,云龙石斑鱼鱼体水分、粗脂肪和粗灰分含量在各组之间无显著差异(P>0.05),但与EPP0.03%组相比,鱼体粗蛋白质含量在EPH0.2%组和SP1.0%组显著升高(P<0.05)。
与对照组相比,饲料中添加EPH,特别是添加0.2%时会显著降低血清和肝脏中甘油三酯的含量(P<0.05),但是对饲料脂肪沉积率有提高的趋势。与对照组相比,EPM3.0%组血清和肝脏甘油三酯含量分别降低19.5%和25.4%,EPP0.03%组血清和肝脏甘油三脂含量分别降低2.9%和38.0%,但均差异不显著(P>0.05)。与对照组相比,EPH0.4%组血清高密度脂蛋白胆固醇含量显著升高(P<0.05),血清低密度脂蛋白胆固醇含量显著降低(P<0.05),而EPP0.3%组和EPM3.0%组血清低密度脂蛋白胆固醇含量也显著降低(P<0.05)。此外,EPP0.3%组血清葡萄糖含量相比EPH0.2%组显著升高(P<0.05)。
2.4 浒苔生物制品对云龙石斑鱼血清抗氧化、免疫指标的影响
由表6可知,与对照组相比,浒苔生物制品对血清还原型谷胱甘肽含量和谷胱甘肽过氧化酶活性没有显著影响(P>0.05),但提升了总抗氧化能力和超氧化物歧化酶的活性,特别是EPH,与对照组相比,EPH0.2%组血清总抗氧化能力显著提高(P<0.05),EPH0.4%组血清超氧化物歧化酶的活性显著提高(P<0.05)。此外,与对照组相比,所有浒苔生物制品均显著降低了血清丙二醛的含量(P<0.05)。血清酸性磷酸酶、碱性磷酸酶、谷草转氨酶和谷丙转氨酶的活性在各组之间均无显著差异(P>0.05)。与对照组相比,EPH0.4%组显著提高了血清溶菌酶活性(P<0.05)。

表6 浒苔生物制品对云龙石斑鱼血清抗氧化、免疫指标的影响Table 6 Effects of E. prolifera bio-products on serum antioxidant and immune indexes of Yunlong grouper
2.5 浒苔生物制品对云龙石斑鱼肝脏的影响
由图3可知,所有组肝脏切片中肝细胞形态完整、胞核正常、肝小叶形态完整,未发现肝脏损伤或病变。

A~G依次为对照、EPH0.2%、EPH0.4%、EPP0.03%、EPM3.0%、DMPT0.1%、SP1.0%组。From A to G, the control, EPH0.2%, EPH0.4%, EPP0.03%, EPM3.0%, DMPT0.1%, SP1.0% groups.图3 云龙石斑鱼肝脏切片(HE染色)Fig.3 Liver section of Yunlong grouper (HE stain)
2.6 浒苔生物制品对云龙石斑鱼头肾组织免疫相关基因表达的影响
由图4可知,与对照组相比,所有浒苔生物制品均有降低促炎因子IL-1β和IL-6基因相对表达量的趋势,特别是EPH0.2%组,显著低于对照组(P<0.05)。另外,所有浒苔生物制品组促炎因子TNF-α基因相对表达量显著低于对照组(P<0.05)。EPH0.4%组和EPP0.03%组抑炎因子IL-10的基因相对表达量显著高于对照组、EPH0.2%组、EPM3.0%组和SP1.0%组(P<0.05)。
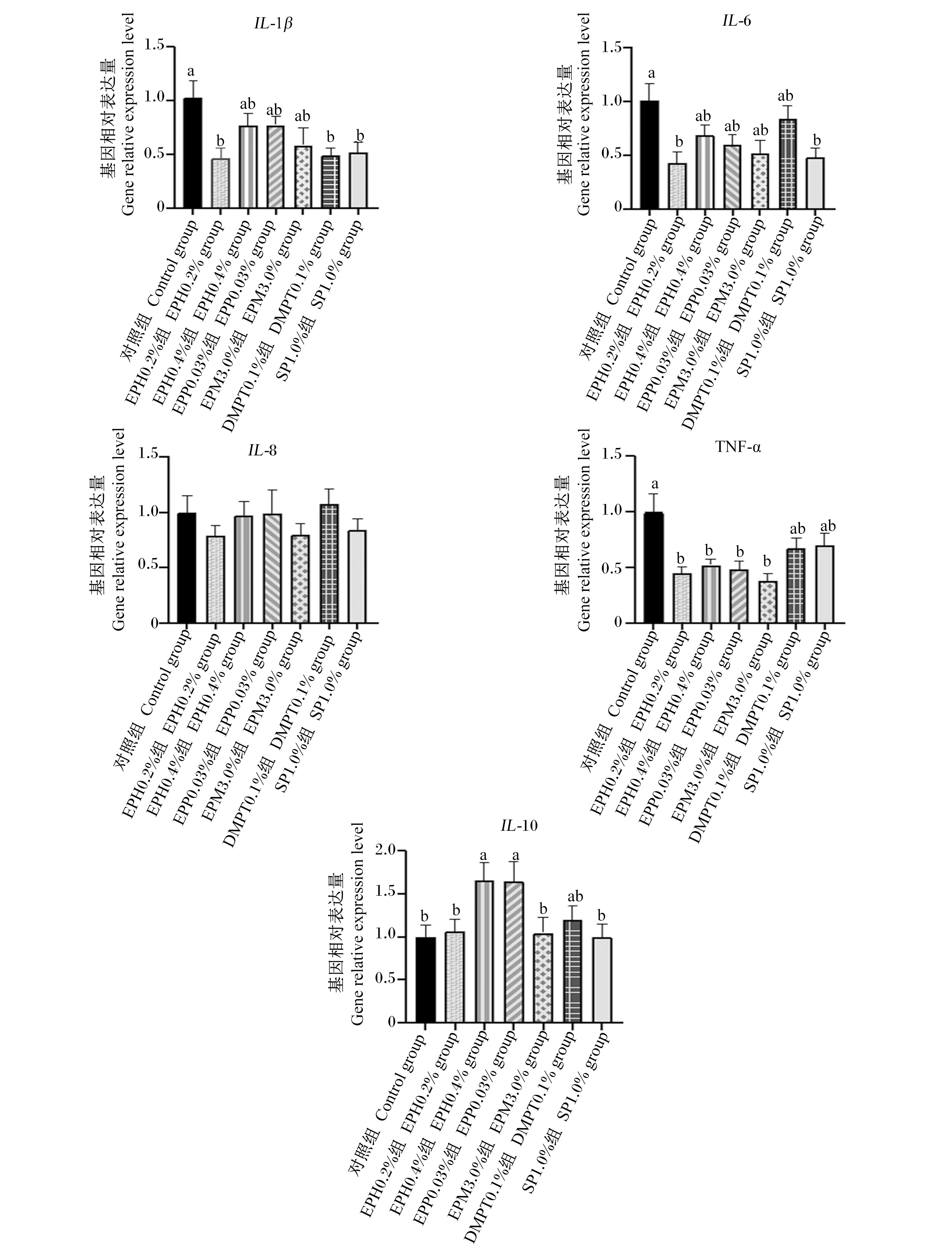
IL-1β:白细胞介素-1β interleukin-1β;IL-6:白细胞介素-6 interleukin-6;IL-8:白细胞介素-8 interleukin-8;TNF-α:肿瘤坏死因子-α tumor necrosis factor-α;IL-10:白细胞介素-10 interleukin-10。柱状图中不同字母表示不同组间有显著差异(P<0.05)。Bars with different letters mean significant difference between groups (P<0.05).图4 浒苔生物制品对云龙石斑鱼头肾组织免疫相关基因表达的影响Fig.4 Effects of E. prolifera bio-products on expression of immune-related genes in head kidney of Yunlong grouper
2.7 攻毒结果
由图5可知,在对云龙石斑鱼攻毒后,鱼的死亡开始出现在第2天,结束在第5天,死亡率在10%~40%。其中EPM3.0%组累积死亡率最低,为10%,其次为EPH0.4%组,累积死亡率为20%;累计死亡率最高组为DMPT0.1%组,为40%,其次为对照组,累积死亡率为37%。
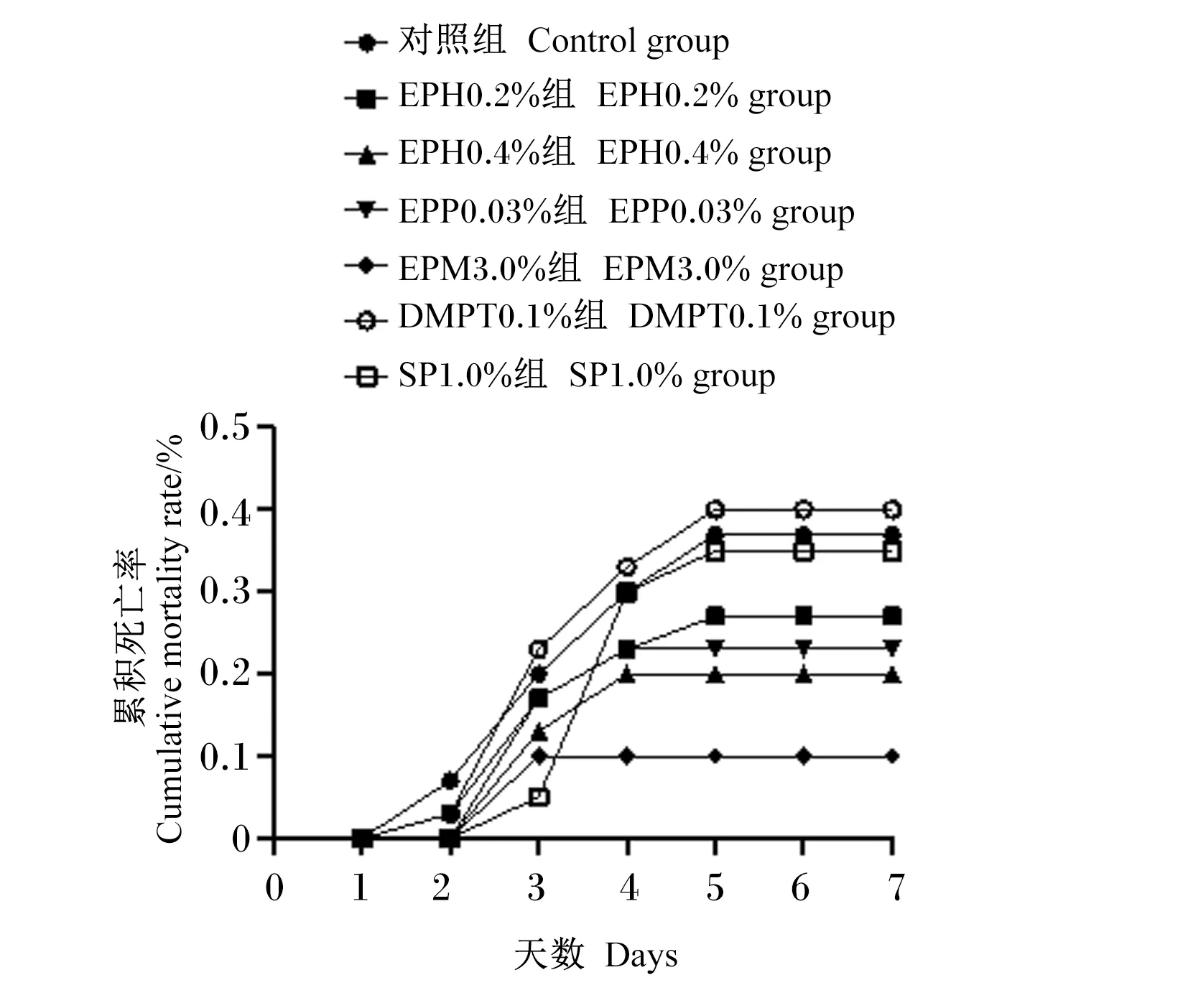
图5 哈维氏弧菌攻毒后的7 d累积死亡率Fig.5 Cumulative mortality rate of 7 days after Vibrio harveyi challenge
3 讨 论
3.1 浒苔生物制品在云龙石斑鱼上的诱食效果
浒苔作为饲料中诱食剂成分已经在多种水产动物上开展研究,如在大菱鲆上,王晓兰等[23]用摄食率法和迷宫法,均发现浒苔的诱食作用;在锦鲤(Cyprinuscarpio)上,关洪斌等[24]的研究表明,浒苔的诱食性虽然低于大蒜,但是强于江蓠、陈皮、海星等。基于此,本研究通过观察石斑鱼前21天摄食量的变化,开展浒苔对云龙石斑鱼诱食性的系统研究。
结果发现,摄食率的结果与之前研究相似,EPM、EPH和EPP 3种浒苔生物制品都具有诱食作用,但是通过对21 d摄食量的观察,发现浒苔生物制品与DMPT的诱食方式不同,DMPT对石斑鱼的诱食作用在摄食后第1餐就非常明显,但是随着摄食时间的推移,其诱食作用在减弱,而浒苔生物制品的诱食作用则是随着摄食时间的增加逐渐增加的,EPM在摄食后7 d体现出来,而EPH和EPP则是在摄食后10 d开始体现。浒苔这种不同于DMPT的诱食方式可能是多种因素作用的结果,一方面可能是其富含二甲巯基丙酸(DMSP),根据王亮[25]的研究,浒苔所属的绿藻中DMSP含量是红藻和褐藻的几十倍;另一方面,可能是其富含甜菜碱,根据Han等[26]的研究,浒苔所属的绿藻中甜菜碱的含量也是红藻和褐藻的几倍到十几倍;最后,浒苔还富含多糖、膳食纤维、某些促进摄食的氨基酸等,这些可能也会对鱼类的摄食产生影响[24,27-28]。因此,我们猜测,相比DMPT,浒苔的诱食作用是受到多种诱食成分的影响,再加上浒苔生物制品在饲料中的添加量本来就很低,所以这些诱食成分在整个饲料中的水平要远远低于化学合成的DMPT直接添加到饲料中的含量,从而导致诱食作用效果比DMPT缓慢,但是长期饲喂纯的DMPT可能会产生类似于诱食疲劳效应,使得诱食效果有所降低,而浒苔生物制品由于含有多种诱食成分,不会产生优势疲劳效应,这使得最终对石斑鱼的诱食作用会逐步超过DMPT。基于此,接下来有必要从诱食机制方面开展进一步的研究。
3.2 浒苔生物制品对云龙石斑鱼生长性能和鱼体成分的影响
浒苔作为一种饲料原料,已经在水产动物上开展了大量研究,并发现适宜添加水平能够提高大黄鱼[12]、罗非鱼[29]、墨吉明对虾(Fenneropenaeusmerguiensis)[30]、鲫鱼[19]、大菱鲆[31]等水产动物的生长性能。此外,在石斑鱼上,徐安乐等[16,32]先后报道,发酵浒苔和超微粉碎浒苔可以显著提高珍珠龙胆石斑鱼的生长性能,且最适添加量分别是2%和4%。因此,本试验在设计时,EPM的添加量设计为3.0%,与在珍珠龙胆石斑鱼上的结果类似,即与对照组相比,饲料中添加浒苔生物制品(包括EPH、EPP和EPM),云龙石斑鱼的生长性能均有升高的趋势。同时,本试验还发现,添加0.2%的EPH与添加3.0%的EPM在添加量上相差15倍,但是生长效果接近,这可能是因为通过酶解工艺可以有效提高浒苔制品活性物质的利用率,从而更好地促进云龙石斑鱼生长。类似的结果也在罗非鱼上发现,发酵浒苔相比超微粉碎的浒苔,在该鱼上的适宜添加水平有降低的趋势[33]。这表明浒苔作为饲料原料,可以通过加工工艺的改进,提高其在鱼类上的利用效率。
3.3 浒苔生物制品对云龙石斑鱼脂代谢的调节作用
浒苔除了具有诱食和促进生长的作用外,在哺乳动物的研究中,还发现浒苔,特别是其中的EPP对脂肪的调节具有重要作用[34-35],例如,对饲喂高脂饲料的小鼠,进行灌喂EPP,不仅可以有效降低小鼠的肝脏脂肪和血清甘油三酯的含量[36],而且也能有效降低血清低密度脂蛋白胆固醇的含量[37],表明EPP在降血脂方面的重要作用;此外,将EPP添加到饲粮中直接饲喂肉鸡,也能够起到降低血清甘油三酯含量,提高血清高密度脂蛋白含量的作用[38]。而在鱼类上,也发现了浒苔的降血脂作用,胡晓伟[39]的研究表明,饲料中添加2%、3.5%的粉碎浒苔显著降低了黑鲷(Acanthopagrusschlegeli)幼鱼血清总胆固醇、甘油三酯和低密度脂蛋白胆固醇含量,添加5%、6.5%的粉碎浒苔显著升高了血清高密度脂蛋白胆固醇含量。与上述结果类似,在本研究中,发现3种浒苔生物制品均能不同程度降低血清甘油三酯及低密度脂蛋白胆固醇含量,并提高高密度脂蛋白胆固醇含量,且发现添加0.2%~0.4%的EPH,降脂作用好于添加0.03%的EPP和3.0%的EPM,考虑到EPH、EPP和EPM在饲料中的添加量差异,这表明不同加工方式可以在降低浒苔使用量的同时提高其降血脂方面的功效。此外,添加0.2%~0.4% EPH还有效降低了肝脏中甘油三酯的含量,但却提高了鱼体脂肪沉积率,特别是EPH0.2%组,这表明EPH可能导致摄食的脂肪在降低肝脏中的脂肪后再在体内重新分布,因此提高了体脂肪的沉积率。
3.4 浒苔生物制品对云龙石斑鱼抗氧化能力的影响
当机体抗氧化能力减弱,不足以清除氧化自由基时,就会对机体产生氧化损伤[40],而有学者利用自由基体外抗氧化活性评价方法,发现浒苔具有较强的抗氧化活性,甚至可作为潜在的抗氧化剂进行开发利用[41],因此,当EPM添加到水产饲料中,可能会对水产动物抗氧化能力产生重要的影响。在随后的研究中得到证明,大量的研究发现,EPM能够提高罗非鱼[29]、墨吉明对虾[30]、鲫鱼[19]、花鲈[42]等水产动物血清总抗氧化能力、超氧化物歧化酶、谷胱甘肽过氧化物酶活性,并降低脂质过氧化物丙二醛的含量。而本研究中,不但证实浒苔生物制品包括EPH、EPP和EPM,均能一定程度提高血清中总抗氧化能力和超氧化物歧化酶活性,并降低丙二醛含量;而且进一步发现,浒苔的加工形式会影响浒苔活性成分含量,从而影响鱼类抗氧化能力的提高,在本试验条件下,添加0.2%~0.4% EPH的抗氧化能力强于添加0.03% EPP和3.0% EPM,这一点从EPH添加组具有最高的血清总抗氧化能力、超氧化物歧化酶活性和最低的丙二醛含量中可以看出。
3.5 浒苔生物制品对云龙石斑鱼免疫指标的影响
浒苔因其富含EPP,而多糖是一种重要的免疫调节物质,因此,其被认为在提高机体免疫上具有重要作用[43]。本研究中,为探究浒苔生物制品对云龙石斑鱼免疫力的影响,首先,分析了肝脏健康状况,通过对组织切片的观察发现,包括对照组在内,所有试验组的肝脏的细胞形态完整,无肝脏损伤或病变,表明所有肝脏的健康状况良好,为了进一步验证肝脏组织切片的结果,本试验测定了评估肝脏健康状况的重要指标血清谷草转氨酶和谷丙转氨酶活性,结果发现所有组均无显著差异。在红鳍东方鲀[17]上,也发现血清谷草转氨酶和谷丙转氨酶活性没有受到饲料中添加浒苔生物制品的影响。原因可能是,本试验在设计饲料配方时,尽量使饲料原料和营养组成接近石斑鱼的营养需求,加上饲养条件良好,所以所有鱼的生长都非常健康,没有出现肝脏损伤情况,这点也从98.67%~100.00%的成活率得到验证。
溶菌酶在鱼体内广泛分布,具有裂解革兰氏阳性菌和革兰氏阴性菌的活性,被认为是评价鱼类非特异性免疫的重要指标[44-45]。本研究中,添加浒苔生物制品,特别是0.4%的EPH,血清溶菌酶活性显著升高,类似的结果在珍珠龙胆石斑鱼[32]、花鲈[42]、罗非鱼[13]等鱼类的研究中也发现,这提示摄食浒苔后,鱼类的抗菌能力可能增强。因此,进一步进行了哈维氏弧菌攻毒试验,结果进一步证明,饲料中添加浒苔生物制品可以提高云龙石斑鱼的抗病力,降低死亡率,其中,添加3.0%的EPM组存活率最高,抗病力最强,其次是添加0.4%的EPH组,这与血清溶菌酶活性的结果相似,证明了浒苔生物制品在提高云龙石斑鱼抗菌能力方面的作用。
在畜禽研究中,发现饲料中添加浒苔能够影响炎性因子如TNF-α、IL-1β等的表达[46],而对炎性因子的测定是监测机体炎性反应及免疫力的有效手段[47]。因此,本研究也测定了云龙石斑鱼头肾促炎因子(IL-1β、IL-6、IL-8、TNF-α)和抑炎因子(IL-10)的基因表达,结果发现,浒苔生物制品对促炎因子中IL-1β、IL-6和TNF-α的基因表达都有显著降低或降低趋势,而添加0.4%的EPH和0.03%EPP显著增加了抑炎因子IL-10的基因表达,相似的结果也在皱纹盘鲍[14]中发现,这表明饲料中添加浒苔生物制品后,云龙石斑鱼发生炎症的风险将会有一个显著的降低。
4 结 论
综上所述,EPM、EPH和EPP 3种浒苔生物制品在对云龙石斑鱼的摄食、生长、降血脂、增强抗氧化能力、提高免疫力等方面均有一定的有益作用,且通过酶解工艺等对浒苔进行处理后,可在降低饲料中浒苔使用量的同时,达到或超过传统EPM的作用效果。
