体外产气法评价植物提取物对生长肥育猪粪样微生物发酵特性及甲烷生成的影响
2023-12-04王珊珊狄寒秋钟一帆汪海峰
王珊珊 狄寒秋 钟一帆 陈 斌 施 宪 汪海峰*
(1.浙江大学动物科学学院,杭州 310058;2.浙江华统肉制品股份有限公司,义乌 322005)
全球变暖已成为世界关注的热点问题。正如联合国政府间气候变化专门委员会(IPCC)第6次评估报告所述,全球温室气体排放量持续上升,甲烷(CH4)作为第二大温室气体,诱导温室效应能力远高于二氧化碳(CO2),目前CH4排放的增长速度为自20世纪80年代以来的最高值[1]。2021年《全球甲烷评估》报告指出,畜禽粪便和肠道发酵的CH4排放量约占全球人为排放总量的32%,仅次于能源生产排放的CH4[2]。反刍动物被认为是畜禽CH4的主要来源,虽然猪的肠道CH4产量远低于反刍动物,但由于其全球种群数量庞大,尤其我国是世界主要生猪养殖大国,养殖量占世界1/2以上,所产CH4对环境的影响不容小觑。饲粮成本占生猪生产总成本最大,其中能量是最昂贵的组成部分,约占饲粮成本的70%[3]。现代养猪生产中,CH4排放产生的能量损失约占猪饲粮总能的0.7%,更有研究表明饲喂高纤维饲粮的成年母猪产生的CH4能量损耗高达3.36%消化能[4-5]。因此,研究探索如何减少猪生产过程中的CH4排放有助于提高其饲粮利用率,降低CH4对全球变暖的负面影响。
近年来,有许多研究描述了瘤胃中产甲烷菌的多样性,以及在体外和体内条件下通过一系列方法进行的缓解CH4排放策略,包括改变动物管理、调整饲粮结构、饲喂微生物制剂及添加化学抑制剂如三氯乙酰胺、水合氯醛、硝基乙烷、3-硝氧基丙醇和氯仿等,这些方法均可以在反刍动物中找到广泛应用,这也可能适用于非反刍动物的CH4缓解。但由于一些抑制剂具有毒性,残留于动物体内不仅容易引起机体不良副作用,其排泄物还会对环境造成污染和破坏;更有甚者易蓄积在动物产品中,进而损害人类健康[6-8]。研究表明,植物及其提取物可能间接(影响与产甲烷菌相关的原生动物、细菌和真菌的数量)和直接影响产甲烷菌群的生长、发育、活性和多样性来影响产甲烷菌[9]。研究报道,一些植物提取物如大蒜、牛至和肉桂等多种植物精油已被证明可以降低体外CH4排放,并具有调节瘤胃环境、改善动物性能的潜力[10-12]。其中,含有有机硫化合物蒜氨酸、二烯丙基硫醚和大蒜素(allicin,ALN)的大蒜油则被认为是体外抑制产CH4最有效的植物化合物之一[13]。
体外发酵产气法是一种通过在可控环境下测量发酵过程中产生的气体量来评估发酵速度进而实现模拟动物体内消化的试验方法,具有简单易行、通用性强和重复性好的特点[14]。Menke等[15]研究发现,体外产气法所测得的产气量与体内干物质的代谢能及降解率呈显著正相关,且相关系数高达0.98。Bauer等[16]研究表明,猪粪便微生物与结肠微生物区系相似,且粪便采样相比于肠道内容物采样更便捷,因此使用猪粪便作为微生物接种源能有效模拟猪体内结肠发酵。到目前为止,大多数体外研究的目的是评估植物提取物对瘤胃CH4产量的影响,而对猪肠道CH4调控研究有限。因此,本研究利用体外产气的方法,研究不同植物提取物对生长肥育猪粪样微生物发酵特性与CH4产量的影响,比较了不同浓度、不同种类的植物提取物对猪粪样微生物产CH4的作用差异,旨在为降低猪肠道CH4排放提供依据。
1 材料与方法
1.1 试验材料
1.1.1 植物提取物
3种植物提取物牛至油(origanum oil,ORM)、肉桂油(cinnamon oil,CIN)及大蒜素均购自上海某生物科技有限公司。参照张然等[17]所用方法添加样品:分别称取100、200和400 mg样品溶于5 mL无水乙醇中混匀,使得浓度分别为20、40和80 mg/mL,取0.5 mL上述溶液加入到相应的产气瓶中,使样品最终在50 mL发酵液中浓度依次达到200、400和800 mg/L,对照(CON)组加入0.5 mL无水乙醇。
1.1.2 饲粮底物
以浙江省某牧场提供的生长肥育猪饲粮作为底物,饲粮底物组成及营养水平见表1。饲粮在试验前粉碎并过1 mm筛,按照1%质量浓度称取0.5 g到产气瓶中。

表1 饲粮底物组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the dietary substrate (DM basis) %
1.1.3 接种粪样采集与处理
随机选择浙江省某牧场5头日龄、体型相近的平均体重为(55.0±5.0) kg的商品猪,采用直肠刺激法收集新鲜粪样并立即置于充满CO2的自封袋中带回实验室。从5份鲜粪样中称取等重量粪样,在厌氧环境下混合,并在接种前用39 ℃无菌生理盐水按照50%质量浓度对粪样进行稀释,并用4层无菌纱布过滤得到含粪样微生物的滤液(以下简称为粪液)。
1.2 试验方法
1.2.1 试验设计
采用3×3双因素试验设计,在底物中分别添加不同浓度的植物提取物,使发酵液中3种植物提取物(牛至油、肉桂油和大蒜素)的浓度分别为200、400和800 mg/L,另设不添加任何植物提取物的空白对照组,每个处理设7个重复。
1.2.2 培养基制备
参照Theodorou等[18]提出的配方制备培养液,按表2比例和顺序混合制备,同时不断通入CO2使培养基由蓝色变为无色后按45 mL/瓶迅速分装至产气瓶中,并用CO2饱和后密封。

表2 体外发酵培养基配方Table 2 Components of medium used for in vitro fermentation
1.2.3 体外发酵
发酵培养参照Menke等[19]提出的体外产气法进行,将粪液按5 mL/瓶接种于上述含底物、处理和培养基的100 mL产气瓶中,并迅速将产气瓶置于39 ℃恒温培养箱中培养48 h后冰浴终止发酵(在正式培养前将产气瓶中所产气体排空,不计入发酵产气量)。
1.3 指标测定
1.3.1 产气量与产气动力学参数
用压力传感器记录发酵0、2、6、12、24、48 h的压力值并用集气袋收集产气瓶内全部气体,产气量由以下公式计算:
GPt=Pt(V0-50)/(101.3W)。
式中:GPt为t时的产气量(mL/g DM);Pt为t时测得的压力值(MPa);V0为产气瓶体积(mL);W为饲粮底物干物质重量(g)。
累积产气量由各时间点的产气量相加得到。
利用Origin 2021将各时间点的产气量代入Gompertz模型[20]公式对产气动力学参数进行拟合,公式为:
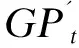
1.3.2 CH4产量
使用气密进样针(SGE-008770,Trajan,澳大利亚)从集气袋中抽取5 mL的气体注入气相色谱仪(GC-2010 Plus,岛津株式会社,日本)测定CH4浓度(色谱柱:毛细管柱,30 m×0.25 mm×0.25 μm,HP-INNOWAX,19091N-133)。参数设定如下:柱温80 ℃,汽化室100 ℃,检测室120 ℃,载气为高纯氮气(N2),压力179.5 kPa,总流量46.2 mL/min,柱流量2.7 mL/min,分流比15,吹扫流量3 mL/min,循环流量30 mL/min,氢气(H2)流量40 mL/min,空气流量400 mL/min。CH4产量是用生成的气体总量乘以其在被分析样品中相应的CH4浓度来计算的,累积CH4产量由各时间点CH4产量相加得到。
1.3.3 短链脂肪酸(SCFA)
发酵结束后抽取1 mL发酵液,加入250 μL偏磷酸,4 ℃孵育10 min,15 000×g离心10 min,取上清液通过0.22 μm滤膜后用气相色谱仪(GC-2010,岛津株式会社,日本)测定SCFA浓度。
1.4 数据统计分析
试验所得数据通过Excel 2016进行计算整理后,采用SPSS 25.0软件进行单因素方差(one-way AVOVA)分析,利用SAS 9.4进行双因素方差分析,并使用Duncan氏法进行多重比较检验。试验结果以平均值±标准误(mean±SE)表示,P<0.05表示差异显著。
2 结果与分析
2.1 体外发酵累积产气量的变化
不同处理的体外发酵累积产气量变化曲线如图1所示。由图1-A可知,与对照组相比,从发酵12 h开始,200 mg/L牛至油组累积产气量显著降低(P<0.05);从发酵24 h开始,各200 mg/L植物提取物组累积产气量均显著降低(P<0.05),其中200 mg/L大蒜素组下降幅度最大。由图1-B可知,从发酵12 h开始,各400 mg/L植物提取物组累积产气量均显著低于对照组(P<0.05),其中400 mg/L牛至油组下降幅度最大。由图1-C可知,从发酵6 h开始,各800 mg/L植物提取物组累积产气量均显著低于对照组(P<0.05),下降幅度由大到小依次为牛至油组>肉桂油组>大蒜素组。
与对照组相比,各浓度植物提取物组体外发酵48 h累积产气量变化百分比如图2所示。各浓度植物提取物组48 h累积产气量均显著低于对照组(P<0.05),其中200 mg/L肉桂油组下降幅度最小,800 mg/L牛至油组下降幅度最大;此外,在200和800 mg/L浓度时,各植物提取物组之间48 h累积产气量变化百分比差异显著(P<0.05)。

数据柱标记*表示与对照组相比差异显著(P<0.05),数据柱之间标记*表示差异显著(P<0.05)。图4和图5同。* marked on value columns mean significant difference compared with CON group (P<0.05), and * marked between value columns mean significant difference (P<0.05). The same as Fig.4 and Fig.5.图2 不同浓度的3种植物提取物对体外发酵48 h累积产气量变化的影响Fig.2 Effects of different concentrations of three plant extracts on cumulative gas production changes at 48 h in in vitro fermentation
2.2 体外发酵产气动力学参数的变化
与对照组相比,各浓度植物提取物组体外发酵产气动力学参数差异百分比见表3。各植物提取物组的理论最大产气量均有不同程度的降低,其中200 mg/L大蒜素组、400 mg/L牛至油组、800 mg/L牛至油组和800 mg/L肉桂油组均显著低于对照组(P<0.05),且上述4组之间差异显著(P<0.05),800 mg/L牛至油组理论最大产气量最低。除800 mg/L牛至油组产气速率显著高于对照组(P<0.05)外,其他植物提取物组产气速率均有不同程度的降低,其中800 mg/L肉桂油组最低。各200 mg/L植物提取物组产气延滞时间与对照组相比无显著差异(P>0.05),400 mg/L肉桂油组400 mg/L大蒜素组产气延滞时间显著高于对照组(P<0.05),而400 mg/L牛至油组和各800 mg/L植物提取物组产气延滞时间显著低于对照组(P<0.05),其中400 mg/L牛至油组产气延滞时间最低。植物提取物种类与浓度对产气动力学参数差异百分比均有极显著影响(P<0.01),且均存在极显著交互作用(P<0.01)。

表3 不同浓度的3种植物提取物体外发酵产气动力学参数变化百分比Table 3 Percentage of gas production kinetics parameter changes of three plant extracts with different concentrations in in vitro fermentation %
2.3 体外发酵累积CH4产量的变化
不同处理的体外发酵累积CH4产量变化曲线如图3所示。由图3-A可知,与对照组相比,从发酵24 h开始,200 mg/L牛至油组累积CH4产量显著降低(P<0.05);从发酵6 h开始,200 mg/L大蒜油组累积CH4产量显著降低(P<0.05),且200 mg/L大蒜油抑制CH4生成的效果强于200 mg/L牛至油。由图3-B可知,从发酵6 h开始,各400 mg/L植物提取物组累积CH4产量均显著低于对照组(P<0.05),其中400 mg/L牛至油抑制CH4生成的效果最好。由图3-C可知,当处理浓度提高至800 mg/L时,3种植物提取物抑制CH4生成的效果均有所增强,且不同植物提取物之间差异显著(P<0.05),其中800 mg/L牛至油组累积CH4产量最低。

图3 不同浓度的3种植物提取物体外发酵累积CH4产量变化曲线Fig.3 Cumulative CH4 production curves of three plant extracts with different concentrations in in vitro fermentation
与对照组相比,各浓度植物提取物组体外发酵48 h累积CH4产量变化百分比如图4所示。除200 mg/L牛至油组外,各浓度植物提取物组48 h累积CH4产量均显著低于对照组(P<0.05),且200和800 mg/L浓度不同处理之间差异显著(P<0.05)。3种植物提取物的累积CH4产量下降幅度均随着处理浓度的增大而增大,其中800 mg/L牛至油组下降幅度最大,其次是800 mg/L肉桂油组。
与对照组相比,各浓度植物提取物组不同发酵时间点所产生的气体中CH4浓度变化百分比见表4。各400 mg/L植物提取物组从发酵6 h开始CH4浓度开始显著下降(P<0.05),各800mg/L植物提取物组从发酵2 h开始CH4浓度开始显著下降(P<0.05),说明各800 mg/L植物提取物对CH4生成的抑制效果更快。此外,各400和800 mg/L植物提取物组在发酵至48 h时CH4浓度下降幅度减小,而200 mg/L大蒜素组CH4浓度下降幅度随着发酵时间增加而逐渐增大,直至发酵48 h,其CH4浓度下降幅度达到最大,显著低于其他组(P<0.05)。植物提取物种类与浓度对各时间点的CH4浓度变化百分比均有极显著影响(P<0.01),且均存在极显著的交互作用(P<0.01)。
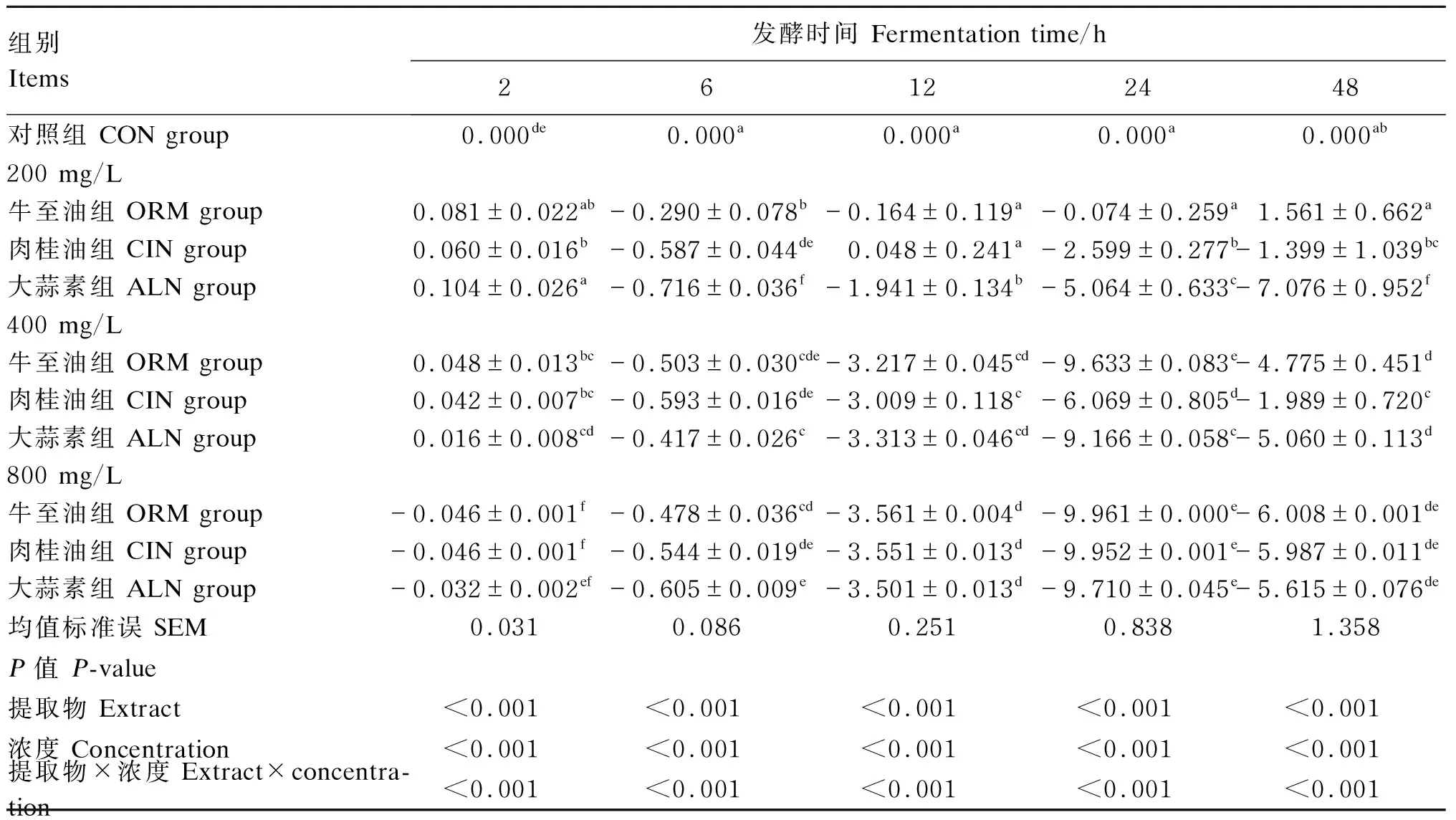
表4 不同浓度的3种植物提取物体外发酵CH4浓度变化百分比Table 4 Percentage of CH4 concentration changes of three plant extracts with different concentrations in in vitro fermentation %
2.4 体外发酵SCFA浓度的变化
与对照组相比,各浓度植物提取物组发酵48 h终末产物中SCFA浓度变化百分比如图5所示。由5-A可知,各200 mg/L植物提取物组乙酸浓度相较于对照组而言有不同程度的提高,其中200 mg/L大蒜素组乙酸浓度显著高于其他2组(P<0.05);而各800 mg/L植物提取物组乙酸浓度均显著低于对照组(P<0.05),且不同植物提取物组之间差异显著(P<0.05)。由5-B可知,与对照组相比,200 mg/L肉桂油组、200 mg/L大蒜素组和400 mg/L大蒜素组丙酸浓度显著提高(P<0.05),其中200 mg/L大蒜素组增幅高达24.38%,其余植物提取物组丙酸浓度则出现不同程度的降低,且各牛至油组丙酸浓度的下降幅度随着处理浓度的增大而增大。由5-C可知,与对照组相比,除800 mg/L牛至油组和800 mg/L肉桂油组丁酸浓度显著降低(P<0.05)外,200 mg/L牛至油组、400 mg/L肉桂油组及各大蒜素组丁酸浓度均显著提高(P<0.05)。由5-D可知,与对照组相比,除200 mg/L牛至油组戊酸浓度显著提高(P<0.05)外,其余植物提取物组均出现不同程度的降低,且下降幅度均随着处理浓度的增大而增大。由5-E可知,各200 mg/L植物提取物组总SCFA浓度相较对照组而言都有不同程度的提高,其中200 mg/L大蒜素组总SCFA浓度上升幅度最大(P<0.05);除200 mg/L肉桂油组外,各植物提取物组总SCFA浓度与对照组相比差异显著(P<0.05),其中各800 mg/L植物提取物组总SCFA浓度均显著降低(P<0.05),且不同植物提取物组之间总SCFA浓度差异显著(P<0.05)。由5-F可知,与对照组相比,不同浓度的大蒜素组乙酸/丙酸值均有不同程度的降低,但只有400 mg/L大蒜素组表现出显著差异(P<0.05);而800 mg/L肉桂油组乙酸/丙酸值显著高于对照组(P<0.05),增幅高达428.80%。
3 讨 论
3.1 不同植物提取物对生长肥育猪粪样微生物体外发酵产气的影响
目前体外产气技术虽已得到了广泛应用,但由于发酵过程中不能将代谢产物及时移除,体外发酵只能反映较短时段内的微生物代谢情况。基于生长猪大肠中26~44 h的饲粮转运时间,本试验选择48 h的发酵时长,以期准确描述猪粪样微生物发酵特性[21]。体外研究表明,产气量与有机物的消化率呈正相关[16]。本试验培养初期发酵速度较快,可能是由于前期底物能够提供充足的营养,后期可能会因营养物质逐渐被分解消耗导致产气趋于平稳,这一趋势与杨翠凤[22]的研究一致。此外,本研究结果与Cobellis等[23]和Zhou等[24]的报告一致,即肉桂油和牛至油表现出了对气体总产量的显著抑制作用;而大蒜素的处理结果与Patra等[11]的研究结果一致,即低、中和高浓度大蒜油处理后发现高浓度抑制总产气量效果最强,但远不及牛至油。这可能是因为植物提取物的抗菌活性与其主要化合物的类型密切相关,如牛至油中的香芹酚和百里香酚、肉桂油中的肉桂醛等化合物具有较强的活性,能够有效阻止微生物生长[25]。体外产气动力学可以通过数学模型定量描述微生物发酵及产物生成的过程,提供对预测饲粮底物消化有用的信息。本研究中,800 mg/L牛至油的理论最大产气量达到最低,笔者推测是牛至油更强的抑菌作用引发了更低的气体产量。Bindelle等[26]报告表明,更小的发酵产气速率和较长的延滞时间可能与接种物中活菌浓度的降低以及微生物适应营养物质的存在有关。这或许也解释了本试验中产气速率随着处理浓度提高而降低的现象,但可能还受其他因素的影响,因此还需在以后的研究中进一步验证它们对体外发酵气体生成的影响机制。
3.2 不同植物提取物对生长肥育猪粪样微生物体外发酵液中SCFA浓度的影响
碳水化合物在结肠被微生物发酵生成的SCFA可被宿主用于自身的能量供应进而促进细菌增殖[27]。Varel等[28]研究表明,SCFA可以满足生长猪15%和母猪30%的维持能量需求。乙酸、丙酸和丁酸是SCFA的主要成分,占总量的90%~95%[29]。其中,乙酸和丙酸参与宿主的能量代谢,且丙酸已被证明可以抑制主要脂肪生成底物如乙酸的代谢,丁酸则是结肠黏膜细胞最重要的能量来源[30-32]。产甲烷菌可以利用肠道中的H2、CO2、乙酸等碳底物合成CH4,而肠道中H2含量可直接受到SCFA发酵模式的影响,如生成1 mol乙酸能产生2 mol H2,而生成1 mol丙酸只产生1 mol H2[33]。因此,生产上被认可的缓解CH4排放的添加剂应该在不损害饲粮降解和SCFA产量的情况下减少CH4的生成。
近年来,一些体外研究探讨了植物提取物(如精油、大蒜提取物)通过增加挥发性脂肪酸的比例来提高瘤胃发酵效率的能力,但也存在与之相反的情况[34-35]。Evans等[36]研究发现,百里香酚在浓度为90 mg/L时能选择性抑制反刍单胞菌的生长,但不抑制牛链球菌的生长,而当浓度提高到400 mg/L时,瘤胃微生物活动被全面抑制,说明添加过量的植物提取物有可能使其对微生物种群的选择性影响转变为非特异性的抑菌作用。本试验中,各800 mg/L植物提取物均同时显著降低了乙酸、丙酸和总SCFA浓度,这可能是由于过量的植物提取物导致粪便菌群受到了无差别损伤。Michiels等[37]研究表明,1 000 mg/L香芹酚和百里香酚显著抑制了体外模拟猪空肠发酵中所有细菌的生长,其中厌氧菌总数均显著降低。本试验中,200 mg/L牛至油显著提高了总SCFA浓度,而400 mg/L则结果相反,说明牛至油可能从某一浓度开始对肠道细菌生长有明显的抑制作用。但由于牛至油组成比例不同,且猪肠道细菌对其敏感性存在差异,因此抑菌临界值也会不同[38]。本试验中,各200 mg/L植物提取物均提高了总SCFA浓度,且大蒜素效果最好。大蒜素组总SCFA浓度显著提高可能是由于细菌和真菌的生长增加,促进了有机物的降解,进而增加了SCFA,降低了CH4产量[39];且Cremonesi等[40]发现在仔猪饲粮中添加大蒜油与牛至油混合物后,SCFA生成菌属中的瘤胃球菌属显著增加,这可能也解释了本试验出现的结果。
3.3 不同植物提取物对生长肥育猪粪样微生物体外发酵产CH4的影响
一些研究结果表明,CH4产量的降低通常伴随着饲粮消化和发酵的降低[11]。某些植物精油或其化合物的抗产CH4活性是非特异性的,如香芹酚和百里香酚通过破坏细胞膜、增加细胞对ATP的通透性等来发挥抗菌作用[41]。本试验中,各800 mg/L植物提取物处理后48 h累积CH4产量降低的同时累积产气量和总SCFA浓度都降低,这进一步验证了上述说法。Macheboeuf等[12]研究发现,添加264 mg/L肉桂醛能在不影响总挥发性脂肪酸含量的同时减少体外CH4生成,这与本研究中肉桂醛的处理结果一致。本研究中,大蒜素表现出了最有趣的结果,因为添加适当浓度大蒜素后能在减少CH4产量的同时显著提高总SCFA浓度。Soliva等[42]研究发现,300 mg/L大蒜油几乎完全抑制了体外CH4生成,且未显著降低有机物表观消化率。这一研究与本试验的结果相似,而减少CH4排放的效果则可能取决于大蒜油的不同品种、浓度等因素。Ruiz等[43]研究表明,添加蒜氨酸和大蒜素分解得到的有机硫化合物能导致体外发酵猪粪中总厌氧菌表现出剂量依赖性降低,且大蒜油能通过抑制羟甲基戊二酰辅酶A(HMG-CoA)还原酶的活性直接抑制产甲烷菌的生长和活性[36]。因此,猜测本试验中大蒜素可能直接影响了产甲烷菌。当CH4产量减少时,H2浓度通常会增加。同型产乙酸菌能够利用H2和CO2产生乙酸,这在一些非反刍动物消化生态系统中被发现对发酵H2的再利用具有重要作用[44]。且李耀宇[45]已报道,同型产乙酸菌在猪粪厌氧发酵中能通过消耗H2降低氢分压,这或许能够解释本试验中200 mg/L大蒜素在降低累积CH4产量的同时显著提高了乙酸浓度。氢分压会因产CH4被抑制而升高,从而导致丁酸的利用和利用丁酸细菌的生长都会受到抑制[46]。本研究发现,不同浓度大蒜素在降低累积CH4产量的同时显著提高了丁酸浓度,这也支持了Patra等[47]的研究结果。本研究中,200、400 mg/L大蒜素均在抑制CH4生成的同时降低了乙酸/丙酸值,且丙酸浓度显著提高,而丙酸的生成是H2的有效竞争途径[48],这似乎表明伴随CH4产量减少而来的可能是更多的H2转移到了丙酸代谢途径,这也是大多数研究中抗产CH4化合物的一个普遍特征[49]。
因此,综合评估来看,大蒜素抑制CH4的效果最佳,尽管800 mg/L大蒜素对总SCFA浓度的负面影响不容忽视,但200和400 mg/L大蒜素能够在体外抑制CH4产生的同时促进SCFA的生成。根据国家统计局数据及《省级温室气体清单编制指南(试行)》[50],我国生猪肠道发酵CH4排放因子为1 kg/(头·年),根据本试验结果估测,200和400 mg/L大蒜素分别能够减少0.573和0.860 kg/(头·年)的猪CH4排放量,从而减少约4 356.028和6 537.102 kcal/(头·年)(1 kcal≈4.186 kJ)的能量损耗;按照2022年我国生猪存栏量估测,200和400 mg/L大蒜素分别能够减少4.011×1014和6.02×1014g的CH4排放,从而减少约3.048×1015和4.575×1015kcal的能量损耗。同时,笔者推测适宜浓度大蒜素可能是通过几种相互关联的机制减少CH4产量:1)直接抑制产甲烷菌的生长和活性;2)诱导发酵模式向丙酸化方向转变,与产甲烷菌竞争系统中的游离H2;3)促进能够利用H2合成乙酸的同型产乙酸菌的生长,作为系统中游离H2的另一个替代汇。
不过,笔者认为本研究仍存在以下局限性:1)本试验使用粪便微生物替代远端结肠微生物区系,且假设样品只在结肠后端被消化,因此这可能无法准确反映发生在结肠的发酵过程;2)粪便微生物在体外的浓度低于体内,为增加添加剂与粪菌相互作用的可能性,体外研究所使用的浓度可能比体内实际可行浓度大;3)由于本试验缺乏各处理的微生物区系特征,无法通过评价各处理间是否存在微生物区系差异来进一步解释所评估的植物提取物的作用机制。目前关于猪的CH4缓解策略的信息有限,暂无任何关于猪的公开数据能够验证本研究结果。因此,后续可以考虑通过参考体外发酵结果与实际生产效益,选择适宜的浓度和条件进行体内试验,并结合宏基因组学和代谢组学等方法了解植物提取物影响生长肥育猪结肠微生物组与CH4生成的途径,确定其是否有望作为调节剂来改善结肠发酵特性和生产力,同样这也可能会进一步支持本研究目前的推测。
4 结 论
① 本研究所用的牛至油、肉桂油及大蒜素3种植物提取物均可作为潜在的生长肥育猪肠道CH4抑制剂,其中800 mg/L浓度的抑制效果最佳。
② 3种植物提取物在200 mg/L浓度下均能提高体外发酵乙酸和总SCFA浓度,而在800 mg/L浓度下均显著降低了乙酸、浓度和总SCFA浓度。
③ 在200 mg/L浓度处理下,3种植物提取物中大蒜素的抑制CH4效果最好,且同时能够提高乙酸、丙酸、丁酸和总SCFA浓度。从经济成本和处理效果评价,200 mg/L大蒜素的综合效益最佳。
