甘草的生物学活性及其在畜禽养殖中的应用研究进展
2023-12-04季小禹李元晓
季小禹 刘 宁 李元晓 张 才,2*
(1.河南科技大学,动物福利与健康养殖河南省国际联合实验室,洛阳 471023;2.河南省畜禽新发病检测与防控工程研究中心,洛阳 471023)
甘草是豆科多年生草本植物,在我国东北、华北、西北各省区广泛分布,其干燥的根和根茎是我国常用的中药,具有补脾益气、祛痰止咳、和中缓急、解毒、调和诸药、缓解药物毒性等功效。甘草主要含有类黄酮、三萜皂苷、酚类化合物(如香豆素、苯并呋喃和二氢二苯乙烯)、多糖、生物碱、氨基酸、挥发性油、矿物质元素等化学成分[1-4]。类黄酮包括黄烷酮、黄酮、黄酮醇、查耳酮、异黄酮和异黄烷酮。主要的类黄酮是甘草素(4′,7-二羟基黄烷酮)和异甘草素(2′,4,4′-三羟基查耳酮)的糖苷,例如甘草苷、异甘草苷和芹糖甘草苷[4];甘草酸是甘草中含量最高的五环三萜类化合物,约占甘草根干重10%;甘草多糖主要由阿拉伯糖、葡萄糖、半乳糖、鼠李糖、甘露糖、木糖和半乳糖醛酸以不同比例和不同类型的糖苷键组成[5]。
现已证明,甘草具有抗氧化、抗炎、抗癌、抗病毒等多种生物学功能[6-10]。在食品中,甘草是一种常见的甜味剂和抗氧化剂;饲料行业中,甘草可以加工成各种动物的饲料[11];在医药行业中,单味甘草可用于治疗气喘咳嗽,也可与其他药物配伍制成复方。甘草制剂主要包括甘草干燥的根和根茎、甘草片、炙甘草、甘草浸膏、甘草颗粒、甘草粉、甘草提取物和甘草茎叶。本文将从甘草的生物学活性、甘草的制剂类型以及在畜禽养殖中的应用进行综述。
1 甘草的生物学活性
1.1 抗氧化和抗炎活性
甘草中具有抗炎和抗氧化特性的生物活性成分包括类黄酮和三萜皂苷[12-13]。类黄酮的抗氧化作用机制包括直接清除活性氧(reactive oxygen species,ROS),通过微量元素的螯合作用抑制ROS的形成或抑制参与生成ROS的酶,以及激活抗氧化机制[14]。甘草查尔酮A通过上调超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽过氧化物酶1(glutathione peroxidase 1,GPX1)等蛋白质的表达,提高机体抗氧化作用[15]。甘草的抗炎作用机制包括抑制一氧化氮(NO)、前列腺素E2(prostaglandin E2,PGE2)和环氧化酶(cyclooxygenase,COX)的产生,抑制炎症细胞因子的产生,以及调节核因子-κB(nuclear factor kappa-B,NF-κB)/丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)途径[12,16]。甘草酸、甘草素和甘草苷可以降低肝脏中促炎症细胞因子,如白细胞介素(interleukin,IL)-1β、IL-6和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的基因表达水平,并阻止活化的巨噬细胞产生多种炎症介质[17]。甘草查尔酮A通过与急性炎症和慢性炎症中MAPK、NF-κB、NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)和核因子红细胞2相关因子2(nuclear factor erythroid 2 related factor 2,Nrf2)信号传导相互作用表现出抗炎活性[18]。此外,甘草还可以抑制线粒体脂质过氧化作用,通过抑制磷脂酶A2(phospholipase A2,PLA2)活性而显示出类似于类固醇激素(氢化可的松)的抗炎作用[13]。
1.2 抗癌和抗肿瘤活性
甘草的活性成分能与多种细胞靶点结合并抑制其活性,包括B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)、细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)、磷脂酰肌醇3激酶(phosphatidylinositide 3-kinases,PI3K)、哺乳动物雷帕霉素靶点(mammalian target of rapamycin,mTOR)、NF-κB、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和基质金属蛋白酶-3(matrix metalloproteinase-3,MMP-3),导致癌细胞在体内外模型中的致癌性降低[19]。甘草中的类黄酮(异甘草素和甘草查尔酮A)可诱导肿瘤细胞凋亡,导致细胞核体积减少、核染色质凝结成团块和凋亡小体的形成[20]。甘草中的酚类化合物可以利用半胱天冬酶(caspases)的活化诱导癌细胞凋亡,并导致细胞周期中的G2/M期阻滞[21]。Zhang等[22]分析了16种甘草类黄酮的作用,证明类黄酮通过阻断细胞周期和调节多种信号通路来抑制癌细胞增殖,其靶向的主要途径包括:MAPK途径、PI3K/丝苏氨酸蛋白激酶(AKT)途径、NF-κB途径、死亡受体主导的细胞凋亡途径,以及线粒体凋亡途径。高迁移率族蛋白B1(high mobility group protein B1,HMGB1)在大部分肿瘤中都是上调的,而甘草酸是一种新型的HMGB1抑制剂[23]。甘草酸通过降低细胞外基质中HMGB1的水平,阻断HMGB1与Toll样受体(Toll-like receptor,TLR)的结合来抑制肿瘤的发生,从而降低NF-κB的表达水平[24]。此外,甘草酸可以提高巨噬细胞在受到干扰素-γ(interferon-γ,IFN-γ)或脂多糖(lipopolysaccharides,LPS)刺激后产生NO的能力,进而产生高浓度NO杀死癌细胞[25]。
1.3 抗病毒活性
甘草被证实对多种病毒具有抗病毒作用,包括人类免疫缺陷病毒(human immunodeficiency virus,HIV)、甲型肝炎病毒(hepatitis A virus,HAV)、冠状病毒(severe acute respiratory syndrome coronavirus,SARS-CoV)、传染性支气管炎病毒(infectious bronchitis virus,IBV)、猪繁殖和呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)和伪狂犬病病毒(pseudorabies virus,PRV)等[26-27]。研究表明,将甘草提取物添加到饲粮中能够有效的抑制鸽Ⅰ型副黏病毒(pigeon paramyxovirus-Ⅰ,PPMV-Ⅰ)的复制,并减少病毒RNA在肾脏和肝脏内的复制[28]。这种抗病毒活性可能与甘草酸和甘草次酸的存在有关[29-30],这些成分通过抑制病毒基因表达和复制、减少病毒的吸附和减少HMGB1与DNA的结合等方式削弱病毒的活性,同时还可以通过阻断抑制蛋白κB(inhibitor kappa B,IκB)降解、激活T淋巴细胞增殖及抑制宿主细胞凋亡等方式提高宿主细胞的活性[8]。Omer等[31]认为,甘草酸可以对抗新城疫病毒(newcastle disease virus,NDV)感染,其机制涉及病毒的吸附、侵入、脱壳、生物合成、组装以及从宿主细胞释放的多个过程。甘草酸通过与细胞膜的相互作用,降低了细胞内吞活性和病毒进入细胞的数量,从而有效地抑制了甲型流感病毒入侵宿主细胞[32]。另有研究表明,甘草酸抑制了病毒蛋白的表达,显著降低了PRRSV的增殖[33]。Tong等[34]发现,以甘草酸为原料制成的碳点相能够抑制PRRSV的入侵和复制,刺激先天免疫反应,并抑制PRRSV感染引起的细胞内ROS积累,还显著抑制PRV和猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)的传播。此外,甘草提取物可以提高机体的免疫水平,Ocampo等[35]通过迟发型超敏反应试验发现,与未处理的对照组相比,甘草提取物处理的肉鸡具有更高NDV抗体滴度和更有效的细胞免疫反应。
1.4 其他
除了上述生物学活性外,甘草还具有抗菌、保肝、降血糖、抗糖尿病、抗寄生虫等多种生物活性。研究表明,甘草及其制剂对多种致病菌都有不同程度的抑制作用,包括革兰阳性菌(金黄色葡萄球菌、表皮葡萄球菌、粪肠球菌、蜡样芽孢杆菌、巨型芽孢杆菌、枯草芽孢杆菌),革兰阴性菌(铜绿假单胞菌、大肠杆菌和副伤寒沙门菌)以及真菌(白色念珠菌)[6,36]。甘草的抗菌活性机理可能在于降低细菌基因的表达水平、抑制细菌的生长,以及减少细菌毒素的产生[8]。甘草具备一定的保肝作用,主要表现为其所含的活性成分可以保护肝细胞,减轻肝脏受到损伤的程度。Hashem等[37]发现,甘草提取物可抑制铅诱导大鼠损伤模型中血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天冬氨酸氨基转移酶(aspartate aminotransferase,AST)的活性,进而发挥保肝作用。甘草查尔酮A降低了LPS/D-氨基半乳糖(D-galactosamine)诱导小鼠模型中的肝脏毒性,降低死亡率、减轻肝脏组织病理学变化、降低ALT和AST活性、减少炎症细胞因子的分泌和调节氧化标志物[38]。甘草可以降低血糖,并对糖尿病及其并发症表现出有益作用[39],这些作用归因于各种机制,例如增强胰岛素分泌、调节葡萄糖稳态和脂质代谢以及改善胰岛素敏感性和葡萄糖耐量[40]。此外,Rashidzadeh等[41]报道了光果甘草对伯氏疟原虫(寄生虫)有明显的抑制作用。光果甘草的水醇提取物和甘草酸对利什曼原虫感染的小鼠显示出治疗和免疫调节作用[42]。
2 甘草的制剂
根据《中华人民共和国兽药典》2015年版,甘草制剂主要包括甘草干燥的根和根茎、甘草片、炙甘草、甘草浸膏、甘草流浸膏、甘草颗粒[43]。此外,在畜牧生产上还应用甘草粉、甘草提取物、甘草茎叶[44-45]。我们对甘草各制剂,从性状、含量、主要用途、剂量等方面进行了概述,详见表1。

表1 甘草制剂、性状、含量、主要用途及用量Table 1 Types, characters, contents, main application and dosage of licorice preparations
3 甘草在畜禽养殖中的应用
3.1 对生长性能的影响
甘草对畜禽的生长性能具有促进作用,能够提高体重(BW)、平均日增重(ADG)和平均日采食量(ADFI),降低料重比(F/G)(表2)。在饲粮中添加0.1%甘草提取物后,肉鸡的BW、ADG和ADFI显著增加,F/G显著降低[46]。黄文清[47]在1~14日龄乌骨鸡的饲粮中添加2 g/kg甘草颗粒提高BW、ADFI和ADG,降低F/G和死淘率。在产蛋后期蛋鸡饲粮中添加甘草提取物降低了料蛋比,但对产蛋率、平均蛋质量、ADFI和破蛋率无显著影响[48]。添加不同水平甘草提取物对肥育猪BW、ADG、ADFI、F/G和成活率均无显著影响[49]。甘草提取物可以改善肉兔ADG和ADFI,且9 g/kg效果最佳[50]。甘草茎叶替代饲粮中粗饲料有提高巴什拜羊的BW和ADG的趋势[51]。动物体重增加的原因可能是由于甘草可以改善动物的食欲和消化能力。Toson等[52]发现,在整个饲养期,添加甘草提取物组肉鸡的饲料消耗量增加。然而,Sedghi等[53]发现,饲喂含甘草提取物的饲粮对肉鸡BW、ADFI和饲料转化率(FCR)没有显著影响。

表2 甘草对畜禽生长性能的影响Table 2 Effects of licorice on growth performance of livestock and poultry
3.2 对胴体性状和畜产品品质的影响
甘草有助于提高畜禽瘦肉率、改善肉品质和蛋品质(表3)。饲粮添加0.1%甘草提取物对肉鸡屠宰率、半净膛率和胸肌率无显著影响,但显著提高了全净膛率和腿肌率,降低了腹脂率[46]。在饲粮中添加甘草提取物不会影响肉鸡肝脏、心脏、脾脏、法氏囊和胃肠道的相对重量[53]。而Abo-Samaha等[54]发现,在饮水中添加0.4 g/L甘草根粉可以提高法氏囊的相对重量,对肝脏、心脏、脾脏、胸腺、胃和肠道的相对重量无显著影响。在产蛋后期蛋鸡饲粮中添加甘草提取物可以改善蛋品质[48]。甘草提取物提高了肥育猪的眼肌面积和胴体瘦肉率,降低了背膘厚,显著增加了肌肉中不饱和脂肪酸含量,改善了肉质[49]。饲粮中添加甘草提取物可增加家兔屠体重、屠宰率,这些指标的增加伴随着较高的胴体肥度[50]。侯芳等[55-56]研究了在饲粮中添加不同水平甘草茎叶对阿勒泰羊羊肉风味和肉品质的影响,研究发现,当添加水平为20.41%时改善羊肉风味的效果最佳,并在一定程度上改善肉品质。

表3 甘草对畜禽胴体形状和畜产品品质的影响Table 3 Effects of licorice on carcass shape and quality of livestock products
3.3 对血清生化指标的影响
血清生化指标可体现动物的健康状况和生长状态。大多数的研究表明,甘草可以减少脂肪沉积,改善血清生化指标(表4)。在饮用水中加入甘草提取物使肉鸡血清葡萄糖(GLU)、低密度脂蛋白胆固醇(LDL-C)和总胆固醇(TC)含量显著降低[57],还可以可降低肉鸡甘油三酯(TG)、游离脂肪酸(FFA)含量,增加高密度脂蛋白胆固醇(HDL-C)含量,这反映了肉鸡腹部脂肪随甘草添加水平的增加而减少[54]。甘草降低腹部脂肪的作用可能与抑制能量摄入,降低脂质吸收,加强脂肪酸氧化或者降低脂肪酸生物合成有关。在另一项研究中,在鹌鹑饲粮中添加750 mg/kg甘草粉使血清总蛋白(TP)和球蛋白(GLO)含量升高,白蛋白/球蛋白比值(A/G)、TC、TG和低密度脂蛋白(LDL)含量及乳酸脱氢酶(lactate dehydrogenases,LDH)活性降低[58]。潘昱麒等[51]发现,用甘草茎叶替代25%的粗饲料饲喂巴什拜羊可降低其血清TG和TC含量。娇丽娟等[59]研究发现,甘草提取物显著降低滩羊血清TG含量,提高了滩羊肝脏的肝脂酶(hepaticlipase,HL)和脂蛋白脂酶(lipoprteinlipase,LPL)活性。动物肝脏脂肪下降的原因可能是甘草对脂质过氧化及脂氧合酶、环加氧酶活性的抑制作用。甘草降胆固醇作用可能是由于胆固醇、胆汁酸和中性甾醇分泌增加和肝胆酸增加所致。然而,在Sedghi等[53]的研究中,未观察到饲喂甘草提取物的肉鸡血清中TG、HDL、极高密度脂蛋白(VHDL)和GLU含量出现显著变化。潘军等[60]发现,饲喂含甘草茎叶的饲粮提高绵羊血清中TP、白蛋白(ALB)、GLO含量,但对TG、TC及LDL含量无显著影响。

表4 甘草对畜禽血清生化指标的影响Table 4 Effects of licorice on serum biochemical indexes of livestock and poultry
3.4 对免疫功能的影响
甘草通过调节免疫器官中基因表达、血清免疫球蛋白含量和溶菌酶(lysozyme,LZM)活性,调节畜禽的免疫功能(表5)。家禽的主要免疫器官有胸腺、脾脏和法氏囊,通常用胸腺指数、脾脏指数和法氏囊指数来评价家禽的免疫状态。黄文清[47]研究发现,甘草颗粒提高1~14日龄乌骨鸡的胸腺指数、脾脏指数和法氏囊指数。添加甘草粉提高鹌鹑体内免疫球蛋白(immunoglobulin,Ig)G、IgM含量和LZM活性[58]。Abo-Samaha等[54]以剂量依赖性方式添加甘草提取物增加肉鸡的血清LZM活性,表明甘草提取物具有免疫刺激作用。甘草类黄酮粉上调了仔猪脾脏中IL-1β和单核细胞趋化蛋白-1(monocyte chemotactic protein-1,MCP-1)的表达,以及胸腺中细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)、IL-1β、IL-6和TNF-α的表达,通过缓解免疫器官炎症等方式改善仔猪免疫功能[61]。此外,在巴什拜羊饲粮中用25%甘草茎叶替换粗饲料对其免疫性能提高效果最好[51]。
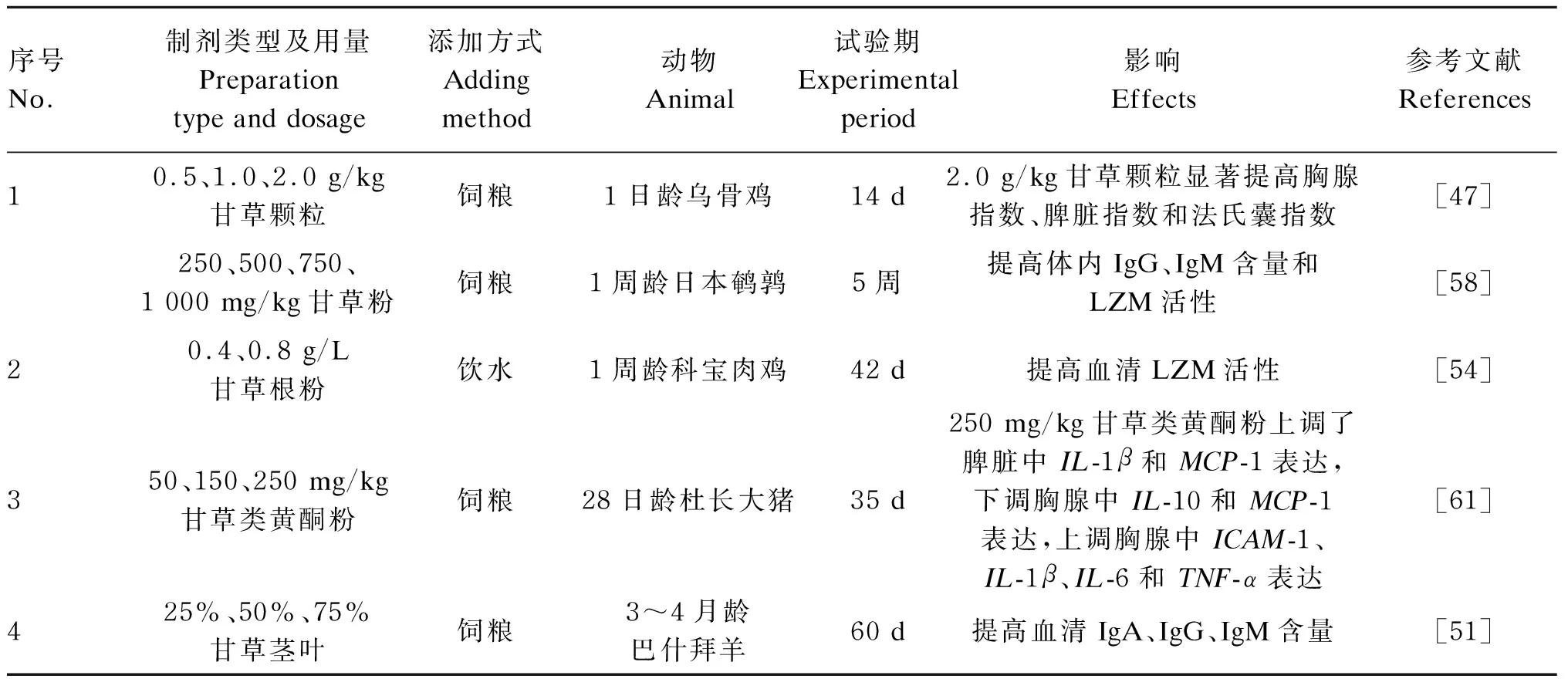
表5 甘草对畜禽免疫功能的影响Table 5 Effects of licorice on immune function of livestock and poultry
3.5 对肠道健康的影响
肠道是维持动物健康的重要靶器官。甘草可以通过调节肠道功能及肠道微生物来提高肠道健康程度(表6)。甘草提取物可调节断奶仔猪肠道黏膜中免疫和发育及肠道紧密连接相关基因表达,降低肠道pH和回肠肌层厚度[62]。通过上调紧密连接蛋白-4(Claudin-4)的表达,增强了猪细胞培养过程中肠道屏障功能的恢复[63]。在肉鸡饲粮中添加甘草提取物后,上调了咬合蛋白(Occludin)和连接黏附分子-2(junctional adhesion molecule-2,JAM-2)基因表达,表明甘草提取物对肠道屏障功能的有益影响[64]。在空肠弯曲杆菌攻毒处理的肉鸡中,甘草提取物可提高肠道黏蛋白-2(mucin-2,MUC-2)的表达水平,同时降低Toll样受体-4(TLR-4)和IL-1β的表达水平,并减少空肠弯曲杆菌的数量[64]。此外,甘草提取物也能减少肉兔盲肠内容物病原菌数量[50]。在鹌鹑饲粮中加入甘草粉使其盲肠细菌总数、大肠杆菌和沙门菌的数量均显著减少[58]。

表6 甘草对畜禽肠道健康的影响Table 6 Effects of licorice on intestinal health of livestock and poultry
4 小结和展望
自2020年1月1日起,国家农业农村部发布禁止使用除中药外的所有促生长类药物饲料添加剂品种,使得饲用植物提取物的研发和生产成为热点。传统医学认为甘草能补脾益气、清热解毒、和中扶正等;现代药理研究认为甘草不同有效成分分别具有抗炎、抗氧化、抗病毒、抗癌、保肝、免疫调节等作用。以甘草为原料制成的甘草制剂逐渐被广泛应用于畜禽生产领域,并发挥了重要的作用,达到提高养殖效率、防病治病的效果。这些甘草制剂可以提高畜禽的生长性能、饲料转化率、胴体品质,以及改善畜禽的血液生化指标和产品质量。此外,甘草制剂还可以成为畜禽呼吸道、消化道以及免疫系统疾病的潜在解决方案。然而,长期饲喂甘草可能产生一些副作用,如水钠潴留、代谢性碱中毒等。因此,在使用甘草制剂时需要注意剂量控制和时机调整,以减少可能的负面影响。为发挥甘草的作用,未来的研究应该着重探索其在畜禽生产中的最佳使用方法和剂量,明确其作用机制,并将其应用于大规模的实际生产中,以提高养殖业的生产效率和质量。此外,还需要加强对甘草制剂的安全性评价和副作用研究,确保其在畜禽养殖中的合理应用。
