植物精油的抗氧化活性及其在畜禽生产中的应用
2023-12-04欧念涛刘孟哲李艳玲
张 岩 欧念涛 刘孟哲 李艳玲
(北京农学院动物科学技术学院,北京 102206)
在畜牧生产中,冷热刺激、环境污染、机体炎症反应和营养代谢异常等均可诱发畜禽产生氧化应激。氧化应激是由过量活性氧(reactive oxygen species,ROS)所导致的机体氧化和抗氧化系统失衡引起的,可通过破坏蛋白质、脂质以及DNA等生物分子的结构和功能,干扰转录因子表达和氧化还原敏感信号通路,导致细胞氧化损伤甚至死亡[1-2]。氧化应激会诱导机体氧化损伤,发生炎症反应,导致畜禽免疫力下降、饲料转化率降低,进而影响经济效益[3]。在畜禽饲粮中添加抗氧化剂不仅是预防饲料成分自氧化的有效方法,也是一种缓解机体氧化损伤的策略。考虑到畜牧生产中使用合成抗氧化剂的安全性等因素,寻找绿色的天然抗氧化剂尤为重要。天然植物提取物不仅有利于调节机体代谢,还具有良好的抗氧化活性[4-6]。其中,植物精油(essential oils,EOs)是通过水蒸馏等方法从植物组织(花、叶和果实等)中提取的次生代谢产物,具有抗菌、抗炎、抗氧化等多种生物活性[7]。尤其是EOs对ROS或炎症所引起的疾病可能具有良好的预防和治疗效果[8]。EOs在畜禽生产中具有巨大的应用潜力。因此,本文综述了EOs的抗氧化作用及其在畜禽生产中的应用,为EOs在畜禽生产中作为合成抗氧化剂的替代物提供理论参考。
1 EOs的抗氧化活性
1.1 EOs发挥抗氧化活性的主要成分

1.2 EOs抗氧化活性的评价方法
1.2.1 体外化学评价法
体外化学评价法可通过检测EOs的自由基清除能力、还原力以及抑制脂质过氧化水平等方式快速评估其抗氧化活性。
在体外测定EOs清除ROS自由基能力时通常采用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picryl-hydrazyl radical,DPPH)自由基清除试验、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2, 2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS]清除试验、β-胡萝卜素漂白(beta-carotene bleaching,BCB)试验、氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)测定试验、自由基捕获抗氧化参数(radical-trapping antioxidant parameter,TRAP)测定试验等方法。
EOs的还原力可作为评价其潜在抗氧化活性的重要指标,还原力越强抗氧化活性越高[14]。EOs的还原力是通过测定铁还原抗氧化能力(ferric reducing antioxidant power,FRAP)和总酚含量(total phenolic content,TPC)的方法进行评估。其中,福林酚法是一种衡量天然产物中总酚类化合物含量的方法。研究发现,欧防风草精油虽TPC较低,但具有较高的抗氧化活性[15],因此仅依靠该方法并不能准确评估EOs的抗氧化能力。
此外,EOs的体外抑制脂质过氧化测定通常采用硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)和抑制脂蛋白脂质过氧化活性(inhibition ability of lipoprotein lipid peroxidation,ILLP)的方法。Wu等[10]研究表明,10~1 000 μg/mL的薄荷精油处理猪肝脏组织匀浆以剂量依赖的方式降低了组织中丙二醛(malondialdehyde,MDA)含量,缓解了脂质过氧化损伤。另有研究显示,黑胡椒精油的ILLP显著高于维生素C,具有良好的脂质过氧化抑制作用[16]。
1.2.2 细胞模型评价法
在细胞模型评价法中通常采用细胞抗氧化活性(cellular antioxidant activity,CAA)和细胞内抗氧化活性(intracellular antioxidant activity,IAA)的测定方法。
采用CAA方法测量荧光强度可直接反映细胞内ROS含量,荧光强度越低则表明EOs清除ROS能力越强;也可通过积分荧光随时间的曲线下面积(area under curve,AUC)计算EOs的CAA,CAA越高表明EOs清除ROS能力越强。Wang等[16]研究指出,0.1 μL/mL黑胡椒精油的相对荧光强度显著低于白胡椒精油,CAA高于白胡椒精油,两者均具有清除HeLa细胞内ROS的活性。
采用IAA方法测定时,可检测细胞内谷胱甘肽(glutathione,GSH)含量。GSH作为电子供体直接清除自由基或为谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)和谷胱甘肽硫转移酶(glutathione S-transferase,GST)提供底物,其含量增加表明EOs的抗氧化能力增强。研究发现,绿薄荷精油在25 μg/mL的浓度下可显著增加H2O2处理的猪小肠上皮细胞(IPEC-J2细胞)中GSH含量,增强了细胞内源性抗氧化系统的功能[10]。在细胞氧化应激状态下使用GSH检测试剂盒分析细胞裂解液中总GSH和谷胱甘肽二硫化物的含量并计算两者的比值,在GSH被氧化为谷胱甘肽二硫化物过程中,可猝灭与脂质过氧化氢(lipid hydroperoxide,LOOH)和H2O2相关的细胞内ROS。
1.2.3 动物模型评价法
近年来,国内外研究学者在动物水平建立氧化损伤模型来评估EOs的抗氧化活性。一般使用氧化应激诱导剂处理秀丽隐杆线虫等低等生物,检测EOs缓解急性系统性氧化损伤的有效性[10];小鼠、大鼠等氧化损伤模型可通过检测血液和组织匀浆中的ROS、MDA含量和抗氧化酶活性来评价EOs的体内抗氧化活性。Ahmed等[17]研究表明,250 mg/kg的百里香精油灌胃大鼠可以通过缓解肝脏脂质过氧化、增加GSH含量、提高GST和GSH-Px活性等,改善机体抗氧化能力。
综上所述,虽然体外化学方法在评价EOs抗氧化活性具有快速、简单、廉价、方便的特点,但不能真实模拟动物内部的生理环境,也不能准确反映抗氧化物质在体内的抗氧化能力。与体外化学方法相比,细胞模型评价法可分析EOs在细胞内吸收、分布和代谢情况,更准确地预测EOs在动物体内的抗氧化活性。相比于体外化学方法和细胞模型评价法,动物模型评价法可直接反映EOs在动物复杂的内部生理环境下的抗氧化能力。
2 EOs的抗氧化作用机制
2.1 基于氢原子转移(hydrogen atom transfer,HAT)和电子转移(electron transfer,ET)清除自由基
ROS自由基的化学本质是含有不成对电子(自由电子)的一种化学实体,Barzegar[18]研究表明,HAT和ET均参与了自由基的清除,如姜黄素异构体的2个酚羟基在HAT和ET中清除ROS发挥重要作用。在DPPH和ABTS自由基清除试验中,DPPH或ABTS自由基含有单电子,EOs的活性成分通过ET猝灭DPPH或ABTS自由基产生光学差异,从而初步评估EOs的抗氧化能力;BCB试验、ORAC测定试验、TRAP测定试验的原理是EOs作为氢原子供体,发生HAT[19]。Simirgiotis等[14]研究发现,牛至精油的高DPPH和ABTS自由基清除能力与其主要成分香芹酚和百里香酚的含量有关;相反,阿米芹精油对DPPH自由基清除能力较低的原因则可能是酚类化合物含量较低[20]。Ahmed等[21]研究指出,罗勒精油的DPPH自由基清除能力与萜烯类化合物发挥抗氧化活性有关。肉桂精油对β-胡萝卜素变色有较高的抑制作用,能够清除及中和导致β-胡萝卜素变色的亚油酸自由基[22]。综上所述,EOs中的酚类以及萜烯类化合物等其他次生代谢产物可通过HAT或ET,使ROS自由基形成相对稳定的物质,从而发挥自由基清除的作用。
2.2 促进金属离子配位饱和
二价铁离子(Fe2+)和亚铜离子(Cu+)等过渡金属离子同样具有自由电子,在生物系统中Fe2+和Cu+等过渡金属离子会发生芬顿(Fenton)反应,即Fe2+和Cu+会被H2O2快速氧化后产生·OH。此外,当细胞内Fe2+过度积累时可以与细胞膜上高表达的不饱和脂肪酸发生脂质过氧化反应,诱发细胞死亡即铁死亡[23]。细胞内高含量的铜离子(Cu2+)还可以通过显著降低GSH含量诱导机体产生氧化应激[24]。因此,如Fe2+、Cu+、Cu2+等过渡金属离子可破坏细胞结构和功能,造成氧化损伤,使用有效的螯合剂能促进金属离子配位饱和,降低ROS含量,保护细胞免受氧化损伤。
在化合物结构中含有2个或2个以上官能团(如C-OH、C=O、-OCH3等)可表现出显著的金属螯合活性,如姜黄素通过-OH和-OCH3螯合Fe2+,山奈酚可通过C=O螯合Cu2+和Fe2+,迷迭香酸在二酚芳香族基团上螯合了2个Fe2+[25]。EOs含有酚-OH与Fe2+、Cu2+发生螯合,使其生成相对稳定的配合物[26]。因此,EOs的生物活性成分能有效结合Cu2+和Fe2+等金属离子,使其生成相对稳定的物质,从而保护机体免受金属离子所诱导的氧化损伤。
2.3 作为供氢体抑制脂质过氧化
过量ROS引起的脂质过氧化链式反应损伤细胞结构和功能,一方面由于细胞膜上含有大量的不饱和脂肪酸具有活性双键而容易受到ROS氧化,导致细胞结构破坏;另一方面在链式反应过程中形成大量碳氢化合物、醇类及醛类中间产物。其中MDA具有细胞毒性,能异常修饰胞内磷脂、蛋白质及核酸生物分子的构象,损害细胞功能。MDA修饰的大多数蛋白质是线粒体蛋白,这可能是由于线粒体是ROS的主要来源之一[27]。MDA代表了在高氧化应激期间产生的一类与氧化损伤相关的分子模式,故常作为脂质过氧化的生物标志物,评估MDA含量可反映其发生脂质过氧化程度。Ding等[28]研究表明,在亚临床大肠杆菌攻毒期间,添加400 mg/kg的茴香油可以上调体内核因子E2相关因子2(nuclear factor erythroid-2 related factor 2,Nrf2)信号通路,降低MDA含量,提高机体抗氧化能力。在链式反应过程中脂质过氧自由基(peroxyl radical,LOO·)是主要的不稳定氧化产物,从另一种脂质中提取氢分子后又生成LOOH,而EOs可作为LOO·的供氢体从而阻断链式反应,减少脂质自由基(lipid radical,L·)和非自由基性脂类分解产物(non-radical products,NRP)的产生,从而保护脂质不被过氧化(图1)。

ROS:活性氧 reactive oxygen species;EOs:植物精油 essential oils。图1 EOs抑制自由基引发脂质过氧化链式反应Fig.1 EOs inhibit free radicals induced lipid peroxidation chain reactions
2.4 调节转录因子表达和信号通路
细胞内的ROS是有氧代谢过程的产物,广泛存在于生物体内[29]。ROS作为一类信号小分子可通过氧化修饰、磷酸化修饰等使Nrf2、核因子-κB(nuclear factor-κB,NF-κB)等转录因子活性改变,影响细胞信号通路,破坏细胞抗氧化系统功能,使之产生炎性反应甚至凋亡。Nrf2是一种对氧化应激高度敏感的转录因子,通常在细胞质中与Kelch样ECH关联蛋白1(Kelch like ECH associated protein 1,Keap1)结合,控制Nrf2的泛素化和降解;氧化应激状态下,Keap1和Nrf2解离并激活Nrf2,使其在细胞质中积累。激活的Nrf2发生易位进入到细胞核中与染色质上的多种抗氧化基因上游启动子区域抗氧化反应元件(antioxidant response element,ARE)结合,可激活通路下游多种抗氧化应激相关基因,如超氧化物歧化酶(superoxide dismutase,SOD)、血红素氧合酶-1(heme oxygenase-1,HO-1)、过氧化氢酶(catalase,CAT)、GSH-Px等,减少细胞的氧化损伤(图2)。
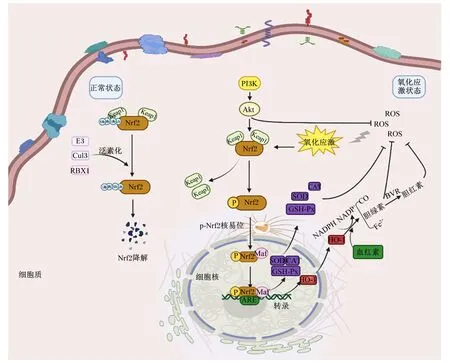
Keap1:Kelch样ECH关联蛋白1 Kelch like ECH associated protein 1;Nrf2:核因子E2相关因子2 nuclear factor erythroid-2 related factor 2;E3:E3泛素连接酶 E3 ubiquitin-ligase enzymes;Cul3:泛素连接酶cullin3 ubiquitin-ligase enzymes cullin 3;RBX1:E3泛素连接酶亚基1 E3 ubiquitin-ligase enzymes subunit 1;PI3K:磷脂酰肌醇-3-激酶 phosphatidylinositol-3-kinase;Akt:蛋白激酶B protein kinase B;ROS:活性氧 reactive oxygen species;Maf:小肌肉筋膜纤维肉瘤 musculoaponeurotic fibrosarcoma;ARE:抗氧化反应元件 antioxidant response element;BVR:胆绿素还原酶 biliverdin reductase;SOD:超氧化物歧化酶 superoxide dismutase;CAT:过氧化氢酶 catalase;GSH-Px:谷胱甘肽过氧化物酶 glutathione peroxidase;HO-1:血红素氧合酶-1 heme oxygenase-1;NADPH:还原型烟酰胺腺嘌呤二核苷酸磷酸 reduced nicotinamide adenine dinucleotide phosphate;NADP+:烟酰胺腺嘌呤二核苷磷酸 nicotinamide adenine dinucleotide phosphate;CO:一氧化碳 carbon monoxide;Fe2+:二价铁离子 ferrous iron;Ub:泛素化 ubiquitination;P:磷酸化 phosphorylation。图2 Nrf2-Keap1-ARE信号通路Fig.2 Nrf2-Keap1-ARE signaling pathway
EOs可以激活Nrf2-ARE信号通路,促进Nrf2的核内移,增强细胞的抗氧化能力。Zou等[30]研究表明,2.5~10.0 μg/mL的牛至精油以剂量依赖的方式增强IPEC-J2细胞中Nrf2的mRNA表达水平,并激活ARE,提高SOD活性和GSH含量,而敲除Nrf2基因后,抗氧化酶mRNA表达水平降低;100或200 mg/kg的香叶醇预处理可显著降低Keap1 mRNA和蛋白表达水平,促进Keap1和Nrf2解离,增加Nrf2的核积累以及HO-1的 mRNA表达水平和蛋白质含量,并缓解大鼠心肌组织的氧化应激[31]。此外,EOs可促进Nrf2易位至细胞核内与NF-κB竞争性结合CREB结合蛋白(CREB-binding protein,CBP),发挥抗氧化作用、抗炎作用以及抑制细胞凋亡作用。Younis等[32]研究发现,50和100 mg/kg的没药精油预处理可增加大鼠心脏组织中Nrf2、HO-1的mRNA表达水平,提高GSH含量和SOD、CAT活性,通过降低肿瘤坏死因子-α(TNF-α)、NF-κB、p65亚基、白细胞介素-6(IL-6)、半胱氨酸蛋白酶3(Caspase3)和半胱氨酸蛋白酶9(Caspase9)的mRNA表达水平来抑制细胞凋亡。200 mg/kg的香叶醇能有效提高大鼠肾脏中Nrf2和HO-1的mRNA表达水平,降低Keap1的mRNA表达水平,提高GSH含量及SOD、CAT和GSH-Px活性,降低MDA含量,下调NF-κB的mRNA表达水平,降低TNF-α、白细胞介素-1β(IL-1β)、IL-6和白细胞介素-10(IL-10)含量,负调节凋亡介质B细胞淋巴瘤/白血病-2相关X蛋白(B-cell lymphoma/leukaemia-2-associated X protein,Bax)、Caspase 3和Caspase 9,并上调抗凋亡因子B细胞淋巴瘤/白血病-2(B-cell lymphoma/leukaemia-2,Bcl-2),同时升高血清白蛋白含量[33]。综上所述,EOs发挥调节转录因子的表达和信号通路作用见图3,EOs可通过激活Nrf2-ARE信号通路,提高抗氧化酶的表达,增强细胞的抗氧化能力;此外,EOs抑制NF-κB通路激活,降低细胞内促炎因子的表达,减轻细胞炎症反应。同时,EOs可上调抗凋亡蛋白的表达,下调促凋亡蛋白的表达,从而提高抵抗氧化损伤而导致细胞凋亡的能力。
3 EOs在畜禽生产中的应用
3.1 在猪生产中的应用
在断奶仔猪饲粮中添加EOs可提高体内抗氧化酶活性,改善肠道组织形态、黏膜抗氧化活性,缓解仔猪断奶应激产生的氧化损伤。饲粮中添加200 mg/kg的混合精油(13.5%百里香酚和4.5%肉桂醛)可提高断奶仔猪十二指肠和回肠黏膜的GSH含量、空肠黏膜的SOD活性以及肝脏中GST和Nrf2的mRNA表达水平,并降低空肠黏膜的MDA含量[34]。Zhang等[35]研究发现,饲粮中添加100 mg/kg茶树油可提高断奶仔猪血清SOD活性,降低血清MDA含量,提高抗氧化能力。母猪在妊娠晚期和泌乳早期阶段氧化应激显著增加,以2.0~3.0 kg/d的剂量饲喂每千克饲粮中混合15 mg牛至精油的饲粮,可降低母猪血清中TBARS含量,并有提高GSH-Px活性、降低ROS含量的趋势,缓解氧化应激[36]。此外,在育肥猪的低蛋白质、氨基酸饲粮中长期添加250 mg/kg牛至精油,提高了血清中SOD、GSH-Px等抗氧化酶活性,降低了TBARS含量,通过改善其抗氧化防御系统来保护猪免受氧化应激[37],还可增强肌肉组织中CAT活性,提高其抗氧化能力[38]。综上所述,在断奶仔猪、母猪以及育肥猪的饲粮中添加EOs可提高机体的抗氧化能力,缓解氧化损伤。
3.2 在家禽生产中的应用
在肉鸡饲粮中添加EOs可提高血清中抗氧化酶活性,降低MDA含量。研究指出,饲粮中添加200~600 mg/kg薰衣草精油提高了肉鸡血清CAT活性[39];饲粮中添加0~1 g/kg的桉树精油可提高肉鸡血清SOD活性[40]。Elbaz等[41]研究发现,饲粮中添加200 mg/kg大蒜精油和柠檬精油混合物可提高肉仔鸡血清GSH-Px活性,降低MDA含量,减轻热应激所带来的氧化损伤。此外,在肉鸡饲粮中添加EOs还可缓解肠道氧化应激。如饲粮中添加150~300 mg/kg牛至精油可提高肉鸡空肠和回肠黏膜的总抗氧化能力,减轻肠道局部氧化应激[42]。Zhang等[43]的研究同样发现,饲粮中添加200 mg/kg牛至精油可降低肉鸡血清和空肠MDA含量,提高肠道抗氧化能力。饲粮中添加300 mg/kg迷迭香精油或肉桂精油可提高蛋鸡血清SOD活性[44];饲粮中添加100~150 mg/kg大蒜精油降低蛋鸡血清MDA含量[45];饲粮中添加200~600 mg/kg八角茴香油以剂量依赖性方式增强蛋鸡肝脏总抗氧化能力和GSH-Px活性,减少MDA含量,提高蛋鸡整体抗氧化能力[46]。此外,饲粮中添加150 mg/kg牛至精油可减少蛋鸡蛋黄中脂质过氧化物含量[47]。综上所述,EOs可通过增强体内抗氧化酶活性、降低MDA含量来提高家禽机体的抗氧化能力。
3.3 在反刍动物生产中的应用
EOs不仅在调节反刍动物瘤胃发酵、减少甲烷产量等方面发挥作用,在提高反刍动物抗氧化能力上也具有很大潜力。在羔羊的饲粮中添加0.5~1.5 g/kg的牛至精油可以显著提高血清中总抗氧化能力以及SOD活性,显著降低MDA含量[48]。在哺乳期母羊的饲粮中添加150~450 mg/kg牛至精油,不仅提高了血清中GSH-Px、SOD活性,还增加了奶中CAT活性[49]。Jeshari等[50]研究发现,在犊牛发酵饲料中添加300 mg/kg迷迭香、设拉子百里香、唇萼薄荷的混合精油可降低血清MDA含量。饲粮中添加100~300 mg/d混合精油(百里香、薰衣草、丹参和棘荸荠精油)可线性提高荷斯坦犊牛的总抗氧化能力[51]。此外,在饲粮中添加EOs后,活性成分可进入到肌肉组织细胞内,提高肌肉组织的抗氧化能力,缓解肌肉的脂质过氧化。Rivaroli等[52]研究发现,在安格斯和内洛尔杂交公犊牛的饲粮中添加3.5 g/d的牛至油、大蒜精油、柠檬油、迷迭香精油、百里香精油、桉树油和甜橙油混合物,可在不影响牛肉化学组成和脂肪酸分布的基础上减少脂质氧化。综上所述,EOs作为反刍动物的饲料添加剂,可提高反刍动物机体的总抗氧化能力,降低MDA含量,并可缓解肌肉组织的脂质过氧化。
4 小 结
EOs依赖其活性成分发挥抗氧化作用,并可采取体外化学评价法、细胞模型评价法和动物模型评价法评估抗氧化活性的高低。EOs通过HAT和ET清除自由基、结合金属离子使其配位饱和、作为供氢体抑制脂质过氧化以及调节内源性抗氧化系统等途径改善畜禽机体内的抗氧化防御系统功能,提高机体抗氧化能力,减轻氧化损伤。越来越多的研究证实EOs具有显著的抗氧化活性,是替代合成抗氧化剂的天然来源之一,在畜禽生产中具有广阔的应用前景。未来需要深入探讨EOs在畜禽的饲粮中有效添加剂量、活性成分在畜禽体内的代谢途径等,从而发挥其最佳的应用效果。
