围产期奶牛脂肪动员对肝脏健康的影响及其机制
2023-12-04赵慧颖赵玉超蒋林树
赵慧颖 赵玉超 蒋林树
(北京农学院动物科学技术学院,奶牛营养学北京市重点实验室,北京 102206)
奶牛从妊娠期过渡到哺乳期经历了能量代谢的显著变化,这是奶牛机体支持胎儿发育的一种方式[1-2]。在围产期开始时(即妊娠晚期),奶牛机体内葡萄糖和氨基酸的利用率增加,以支持胎儿的生长[1]。而奶牛泌乳初期对这些营养素以及脂肪酸(fatty acids,FA)和矿物质的需求又会随着牛奶生产的开始而增长。在整个泌乳早期,奶牛的饲粮摄入量仍不足以支持其对能量的需求。为了满足奶牛的机体需要,奶牛脂肪组织中的脂肪从头合成、FA摄取和酯化作用减弱,而脂解作用加速。循环中的FA在肝脏和骨骼肌组织中被氧化,并在乳腺中用于乳汁甘油三酯(triglycerides,TG)的合成。在肌肉中,蛋白质合成减少,氨基酸动员增强,而氨基酸又被用来支持糖异生或增加乳蛋白的合成速率。骨骼肌和脂肪组织对葡萄糖的利用减少,肝脏糖原分解和生酮作用增强,为牛奶乳糖合成提供多余的葡萄糖[3]。
围产期奶牛的这些生理变化是进化而来的适应性机制。若奶牛无法适应围产期的代谢变化则会引发代谢应激[4],如过度的脂解会使奶牛血清中FA含量升高,大量FA流入肝脏,促进神经酰胺的生成及肝外组织胰岛素抵抗的发生,FA积累也会使脂质氧化加剧、线粒体过载,最终产生酮体和氧脂,促进酮病和氧化应激的发展[5-7]。然而,神经酰胺合成的主要部位在肝脏,FA氧化的主要部位也在肝脏,FA代谢过程与肝脏健康息息相关,FA在肝脏中的不同去向也会对肝脏健康造成不同影响。本文探讨了围产期奶牛FA的营养分配对肝脏健康的影响,以期对FA代谢和肝脏健康的关系理解的更加透彻,为改善围产期奶牛FA与肝脏健康提供理论基础。
1 体脂动员产生的FA对肝脏营养分配的调控作用
围产期奶牛能量负平衡引发的脂肪动员会使大量的非酯化脂肪酸(non-esterified fatty acid,NEFA)和甘油进入血液,部分NEFA被肝脏吸收参与肝脏的营养代谢过程。在肝脏中,FA共有4种去向:1)通过三羧酸循环(tricarboxylic acid cycle,TCA)完全氧化生成能量;2)通过不完全氧化生成酮体;3)生成TG后与极低密度脂蛋白结合从肝脏中输出进入血液;4)生成TG后在肝脏中沉积(图1)[8]。正常生理情况下,肝脏主要根据血液中FA的含量和血流量按比例吸收FA[9-10]。在脂肪动员高峰期,游离NEFA增多,肝脏中FA含量超过TCA的氧化能力,造成TG的大量沉积[11],引发脂肪肝(fatty liver disease,FLD)等疾病。过量的NEFA会造成奶牛的糖、脂代谢紊乱,酮体生成过多,超过机体负担会引发奶牛酮病[11]。
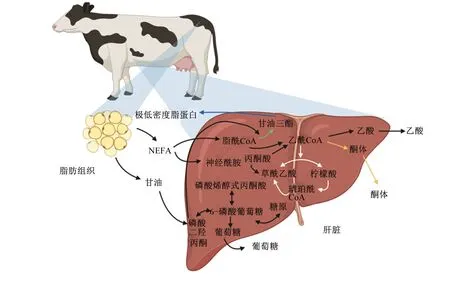
NEFA:非酯化脂肪酸;CoA:辅酶A。图中白色箭头表示三羧酸循环,黄色箭头表示酮体的生成,蓝色箭头表示极低密度脂蛋白的生成,绿色箭头表示甘油三酯的生成及沉积。NEFA: non-esterified fatty acid; CoA: coenzyme A. The white arrow in the figure indicated the tricarboxylic acid cycle, the yellow arrow indicated the ketone production, the blue arrow indicated the very-low-density lipoprotein production; the green arrows indicated the triglyceride production and deposition.图1 脂肪酸在肝脏中的营养分配Fig.1 Nutrient distribution of FA in liver[12]
尽管围产期奶牛过度脂肪动员可能造成肝脏代谢紊乱,但脂肪动员产生的FA在肝脏中发挥着关键作用。脂肪动员产生的TG为乳腺生物合成提供了宝贵的脂肪前体物质[13]。甘油可以为肝脏在采食受限或能量负平衡期间提供糖异生前体[14-15]。此外,NEFA在TCA氧化过程中产生的能量对于促进肝脏糖异生、通过尿素循环进行氨解毒和其他肝脏功能至关重要[16],但这些途径可能会受到肝细胞内脂质积聚的影响[17-18]。FA和其他氧化底物(如乳酸盐、丙酸盐)的完全氧化产生的能量可能超过肝细胞的正常所需能量,而ATP和还原型烟酰胺腺嘌呤二核苷酸(NADH)含量的增加会减弱TCA[19]。同时,在奶牛围产期若除FA外的TCA底物供应不足,则会降低其氧化能力,促进生酮作用及肝脏的脂质沉积[11]。生成的酮体可以被其他组织用作能量来源,包括乳腺、中枢神经系统、心脏和肌肉,从而使酮体作为能量从肝脏输出[19]。只有当酮体的产生速率超过外周组织的摄取时,才会发生奶牛酮病[16]。脂肪动员产生的FA的多种代谢途径凸显了奶牛围产期营养分配的复杂平衡。
然而,肝脏中沉积的脂质也具有被逆转的可能性。FA对丙酮酸羧化酶(pyruvate carboxylase,PC)基因的调节,可能增加FA的氧化能力[11,20-21],以及肝脏脂质相关蛋白表达,这些蛋白可进一步控制FA的储存或再活化[22]。因此,含有Patatin样磷脂酶结构域的蛋白3(Patatin like phospholipase domain containing 3,PNPLA3)受到了广泛关注。PNPLA3是一种甘油酯水解酶,可将TG、甘油二酯和单甘酯水解[23]。研究表明,敲除PNPLA3会使TG含量显著增加,导致动物FLD患病率增加[24-26]。奶牛上的研究显示,限制饲喂(饲粮供给减少50%,诱导能量负平衡)可使肝脏PNPLA3的mRNA表达量降低;且相比产犊前14 d,产犊后1和14 d肝脏PNPLA3的mRNA表达量显著降低[27]。Pralle等[28]观察到围产期奶牛肝脏PNPLA3蛋白质丰度与肝脏脂质积累呈负相关。使用小干扰RNA降低原代牛肝细胞内PNPLA3的蛋白质表达,可观察到细胞内脂质含量的显著增加[29]。而PNPLA3蛋白质丰度也可受到肝脏内脂质积累的影响,Erb等[30]发现肝脏PNPLA3蛋白质丰度随着奶牛肝脏脂质积累的增加而下降,随着奶牛肝脏脂质的清除而上升。综合肝脏PNPLA3的脂解功能及在非酒精性FLD发病中的潜在作用[31-32],PNPLA3在肝脏FA的营养分配中发挥着显著的调控作用。
2 围产期奶牛肝脏FA代谢与肝脏健康
围产期奶牛肝脏中FA的营养分配与奶牛的肝脏健康密切相关,FA进入肝脏主要用于氧化供能。FA在线粒体进行β-氧化,一些多不饱和FA还可被氧化酶氧化生成氧脂。过度的FA积累会使参与β-氧化的酶发生功能障碍,造成线粒体损伤,氧脂产生过多极易引发氧化应激,氧化功能的受损会进一步促进肝脏脂质积累和神经酰胺的生成,这些代谢过程显著影响肝脏健康。
2.1 β-氧化与肝脏健康
β-氧化是FA分子在线粒体或过氧化物酶体中被分解以产生乙酰辅酶A、NADH和还原型黄素腺嘌呤二核苷酸(FADH2)的过程,乙酰辅酶A进入TCA,NADH和FADH2被电子传递链使用[33-35]。L-肉碱是β-氧化所需的关键酶,由2种酰基转移酶组成,即肉碱棕榈酰转移酶(carnitine palmityl transferase,CPT)和肉碱-酰基肉碱转移酶(carnitine-acylcarnitine translocase,CACT),后者是蛋白质线粒体载体家族的一员[35]。CPT1可催化细胞质长链酰基辅酶A和肉碱转化为酰基肉碱,CACT通过线粒体内膜转运酰基肉碱,以换取游离的肉碱分子[35]。酰基肉碱通过位于内膜中的CPT2的作用重新转化为线粒体内酰基辅酶A,用于基质中的β-氧化[35-38]。然而,过度的脂解也会使FA氧化受到严重的影响,在人类肥胖和2型糖尿病的研究中,酰基肉碱作为脂质诱导的线粒体功能障碍的生物标志物受到了广泛关注[39]。研究表明,在非反刍动物来源的分化肌管中,C16∶0-肉碱抑制了胰岛素刺激的蛋白激酶B(protein kinase B,Akt/PKB)激活和葡萄糖摄取,加入酰基肉碱转移酶抑制剂减少了棕榈酸诱导的活性氧(reactive oxygen species,ROS)积累,这说明酰基肉碱会促进氧化应激,同时引发胰岛素敏感性受损[40]。并且,在高脂饮食诱导的胰岛素抵抗大鼠模型中也发现肝细胞线粒体呼吸受损[41]。
酰基肉碱在肝脏代谢中也起着重要作用,在人类医学中许多非酒精性FLD患者在脂肪变性和脂肪性肝炎的发展过程中就出现了酰基肉碱水平升高的现象[42]。并且,补充C14∶0-肉碱刺激了RAW 264.7巨噬细胞中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)的表达,说明以炎症形式(脂肪变性至脂肪性肝炎)发展的肝脏损伤由酰基肉碱引起[43]。除了酰基肉碱,FA氧化障碍的另一个原因就是氧化关键酶的活性降低,在脂肪性肝炎的发展过程中还观察到前期CPT1 mRNA表达量较高,但CPT1蛋白氧化导致活性蛋白量减少使CPT1活性降低,从而干扰线粒体氧化,导致肝脏疾病不断发展[44]。同时,Sirtuin 3(SIRT3)的表达下调也是造成线粒体氧化障碍的重要原因,参与FA肝脏β-氧化的酰基辅酶A脱氢酶是SIRT3翻译后调节的靶点,因此当SIRT3表达下调时会造成FA氧化不完全,在许多FLD患者的肝脏中都会检测到SIRT3功能受损[45-46]。在奶牛上的研究中也发现,肝脏SIRT3的相对丰度在患有FLD的奶牛中较低[47]。奶牛体内FA过度积累还可通过ROS-c-Jun氨基末端激酶(c-Jun amino-terminal kinase,JNK)/p38丝裂原活化蛋白激酶(p38 mitogen activated protein kinase,p38MAPK)途径诱导线粒体功能障碍和胰岛素抵抗,从而诱发脂肪性肝炎的产生[48]。这些研究表明,FA主要通过诱导肝脏线粒体功能障碍使β-氧化受损,脂质积累加剧,诱导肝脏疾病发生发展。然而,对于这种情况奶牛机体也有其应对机制,Schlegel等[49]发现,泌乳早期奶牛体内三甲基赖氨酸羟化酶、4-N-三甲基氨基丁醛脱氢酶、γ-丁基甜菜碱羟化酶1等肝脏中L-肉碱合成酶的基因表达增强,这些变化可能为产后第一阶段观察到的肝脏L-肉碱含量增加提供了解释,并被视为一种生理手段,为肝细胞提供足够的L-肉碱,以在奶牛能量负平衡期间运输过量的NEFA。并且,Carlson等[50]研究表明,饲粮中补充L-肉碱可以刺激产后奶牛的棕榈酸β-氧化,并降低肝脏TG含量,说明在泌乳早期补充L-肉碱可改善线粒体功能,保护奶牛免受脂毒性影响,预防FLD发生。
2.2 氧化脂质与肝脏健康
肝脏是FA氧化的主要部位,在奶牛围产期大量脂肪组织被动员,FA在肝脏中积累,一部分用于TG及神经酰胺的合成,一部分则用于β-氧化。而二酰甘-O-酰基转移酶(diacylglycerol-O-acyltransferase,DGAT)可以促进FA向TG转化,TG可合成极低密度脂蛋白后输出肝脏,一旦DGAT被抑制会使大量FA进入线粒体氧化,使线粒体过载导致大量ROS的产生和线粒体损伤[51-52]。这种现象被称为氧化应激的脂毒性疾病,与非反刍动物的胰岛素抵抗和非酒精性FLD的发展非常相似[53]。持续的ROS产生激活Akt/PKB信号级联,抑制胰岛素刺激的胰岛素受体底物激活。反过来,胰岛素抵抗可能会增加肝脏内脂质含量,从而促进单纯性脂肪变性(即非炎症表型)。然而,氧化应激也可能促进库普弗细胞活化,激活氧化还原敏感的转录因子,包括核因子-κB(nuclear factor-kappa B,NF-κB),并上调促炎因子TNF-α的表达。炎症性脂肪性肝炎的特征还表现在还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶和细胞色素P450(CYP450)表达的上调,这会进一步降低抗氧化能力并促进肝细胞损伤[53]。ROS聚积还会造成肝脏中FA去饱和不完全和过氧化增强,引起n-3长链多不饱和FA耗竭[54]。
奶牛围产期的功能失调引起的炎症状态是奶牛极易患病的基础[4],这种状态与氧脂的产生也密切相关。氧化脂质主要是通过环氧合酶(COX)、脂氧合酶(LOX)和CYP450途径对多不饱和FA进行酶代谢形成的[55]。研究表明,在围产期奶牛的血浆和牛奶中以及患有严重大肠杆菌感染的乳腺炎奶牛的牛奶中都检测到了含有CYP450衍生的氧脂[56-57],说明在奶牛最容易感染疾病的时期,CYP450衍生的氧脂可能发挥着关键作用。此外,除了酶的作用促使氧脂生成,大量ROS的积累会促进氧化应激,增强脂肪组织的脂解,加剧脂质氧化从而生成氧脂[7]。研究表明,围产期奶牛体内ROS水平增加,总抗氧化能力下降,而脂质过氧化产物大量积累[58-60]。同时,脂肪组织释放的FA也用于肝脏β-羟丁酸的产生,可通过ROS介导的p38MAPK激活来促进肝细胞凋亡[61]。此外,FA的大量积累可通过触发炎症的ROS依赖性机制,在肝细胞中诱导NF-κB通路的激活[62]。这些发现都表明氧化应激与FLD的病理机制有关。氧脂通常伴随着ROS产生,这也说明氧脂与FLD的发展可能存在关联。然而,关于氧脂对奶牛肝脏的直接影响目前还未有报道,需要进一步研究。
2.3 FA的衍生物——神经酰胺与肝脏健康
鞘脂由鞘氨醇碱基骨架(即D-红-鞘氨醇)和通过酰胺键连接的FA组成。鞘脂的结构多种多样,但它们的从头合成始于部分由丝氨酸棕榈酰转移酶和神经酰胺合成酶(ceramide synthase,CerS)控制的神经酰胺。丝氨酸棕榈酰转移酶控制棕榈酰辅酶A和丝氨酸的缩合,产生3-酮二氢鞘氨醇。CerS异构体将第2个FA(通常是饱和的)连接到鞘氨醇上,合成神经酰胺前体二氢神经酰胺[63](图2)。例如,CerS6和CerS2分别参与哺乳动物中高度丰富的C16∶0-神经酰胺和C24∶0-神经酰胺的生成[64]。神经酰胺可以通过葡糖基神经酰胺合酶作用,形成鞘糖脂,并最终形成神经节苷脂,后者可被鞘磷脂合酶转化为鞘磷脂或被神经酰胺激酶磷酸化,或者被神经酰胺酶降解以形成鞘氨醇和FA[65]。在人类[66]和奶牛[67]体内,神经酰胺主要存在于低密度脂蛋白中;并且,神经酰胺与极低密度脂蛋白的结合随着禁食而增加[66]。神经酰胺因其在人类2型糖尿病、非酒精性FLD和心血管疾病进展中的作用而受到关注。在奶牛的研究中也观察到,神经酰胺会降低奶牛的全身胰岛素敏感性及葡萄糖的摄取,加速脂解,并促进葡萄糖及FA向肝脏和乳腺的分配[6,68]。
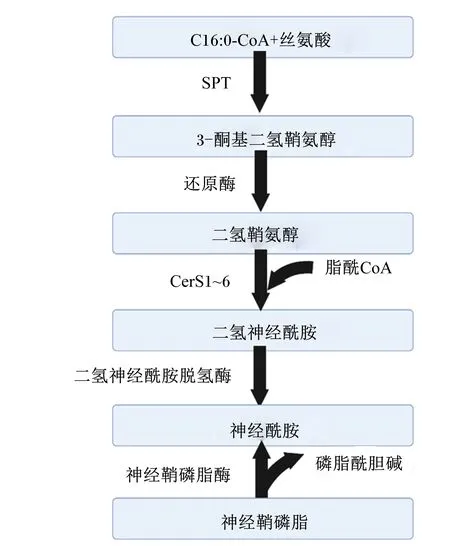
CoA:辅酶A coenzyme A;SPT:丝氨酸棕榈酰转移酶 serine palmitoyl transferase;CerS:神经酰胺合成酶 ceramide synthase。图2 神经酰胺的合成途径Fig.2 Pathway of ceramide synthesis[69]
神经酰胺对胰岛素敏感性的影响是多方面的。神经酰胺可通过引导胰岛β细胞凋亡来发挥其效应,细胞凋亡效应的部分原因是增强了新生神经酰胺的合成。早期研究表明,长链FA可通过从头合成神经酰胺诱导β细胞凋亡[70]。随后的研究发现,神经酰胺主要通过阻止Akt/PKB的激活来抑制胰岛素的作用。具体来说,神经酰胺可通过蛋白磷酸酶2A加速Akt/PKB上2个重要的Akt/PKB残基的去磷酸化来发挥作用[71-72],或者也可以通过刺激其在PH结构域中的抑制性残基上的磷酸化来阻断Akt/PKB向膜的易位,这种机制需要神经酰胺驱动的蛋白激酶Cζ与小窝结构域的结合[73-74]。在诱导胰岛素抵抗的同时神经酰胺还可进一步诱导肝脏疾病的发展。在肝脏中神经酰胺主要通过调节固醇调节原件结合蛋白-1(sterol regulatory element-binding protein-1,SREBP-1)的表达诱导TG合成、破坏线粒体的呼吸能力以及阻断Akt/PKB磷酸化增强糖异生等来诱导肝脏脂肪变性[75-77]。
近年来,奶牛鞘脂生物学的研究有所扩展。血浆神经酰胺和葡糖神经酰胺浓度在妊娠期到哺乳期的过渡期间逐渐增加,主要体现在产前肥胖和产后高NEFA的奶牛中[68,78]。在围产期,代谢应激奶牛的产后肝脏C24∶0神经酰胺浓度随着肝脏脂质的积累而逐渐增加,所有奶牛的骨骼肌组织和血浆低密度脂蛋白(LDL)组分中C16∶0神经酰胺的浓度都会增加,与产前体况无关[67,78]。在荷斯坦奶牛中静脉注射TG乳液,或限制饲喂以提高循环总FA含量的试验中,Davis等[79]和Rico等[69]也分别观察到神经酰胺的循环浓度和肝脏神经酰胺供应增加。饲粮中添加棕榈酸增加了泌乳中期奶牛的血浆和肝脏神经酰胺浓度[80]。用从头合成抑制剂(肉豆蔻素)处理犊牛原代脂肪细胞却可以防止细胞内神经酰胺在棕榈酸孵育后的积聚[6],说明组织对饱和FA吸收的增加很可能推动了奶牛体内神经酰胺的从头合成。神经酰胺循环浓度与循环总FA含量呈正相关,与奶牛全身胰岛素敏感性呈负相关[68,78-79]。Rico等[68]的研究也表明超重奶牛更易产生胰岛素抵抗及神经酰胺积累,而神经酰胺也极有可能参与了奶牛胰岛素抵抗的病理发展,而产前高能饲喂也会进一步使脂肪组织中神经酰胺积累,肝脏中鞘磷脂积累,促使奶牛发生不同程度的胰岛素抵抗[81]。Rico等[69]发现,奶牛静脉注射TG使其肝脏中TG含量增加了4倍,肝脏中神经酰胺合酶2的mRNA表达量增加了60%,而肝脏神经酰胺浓度随之增加,促进了肝脏脂肪变性。这些研究都表明,由FA衍生的神经酰胺在奶牛胰岛素抵抗和FLD发展中发挥着重要作用。
3 小 结
围产期奶牛依靠营养代谢中完善的生理生化功能来满足机体需要。如今,FA被公认为具有生物活性的信号分子,对营养物质的产生和利用有重要影响。FA在肝脏中的营养分配与围产期奶牛的肝脏健康息息相关,在过度脂解的情况下,肝脏中FA除了生成TG沉积外还极易生成神经酰胺发挥脂毒性作用,危害肝脏健康;而大量FA氧化也会造成线粒体损伤,加剧脂质积累;同时,过度的氧化反应易产生ROS,使氧脂的生成增加,造成氧化应激的进一步发展。未来应进一步研究FA的β-氧化和氧脂对奶牛糖、脂代谢的影响,揭示氧脂的产生及其在奶牛肝脏中的作用机制;同时深入研究神经酰胺对奶牛肝脏的影响及作用机制,进一步优化奶牛肝脏疾病的预防策略,改善围产期奶牛健康。
