浮床水芹不同器官酚酸类和脂肪酸类化感物质代谢组学分析
2023-12-03刘吉祥孙林鹤杜凤凤李金凤常雅军姚东瑞
王 巍,刘吉祥,孙林鹤,杜凤凤,李金凤,常雅军,姚东瑞
(江苏省中国科学院植物研究所(南京中山植物园),江苏省水生植物资源与水环境修复工程研究中心,江苏 南京 210014)
化感作用是指生物体通过向环境中释放化学物质(称为化感物质)而对另一生物体产生的任何直接或间接的有益或有害影响[1-2]。据报道,多种大型植物对各种蓝藻具有较强的化感作用,并且能够抑制有害藻类的生长[3-4]。植物释放的化感物质具有生物可降解、来源自然、污染小等特点,可作为防治河流、湖泊和海洋中有害藻类的天然生态安全杀菌剂[5-6]。特别是近年来,随着全球有害藻华的频繁发生,利用植物化感作用控制藻华越来越受到重视[5-6]。迄今为止,已发现的植物化感物质有类黄酮、萜类、脂肪酸、酚酸等20多种[6];其中,脂肪酸和酚酸类化感物质是目前研究较多且较为常见的2种物质。研究表明,植物释放的某些化学物质通过破坏藻类的细胞结构,影响藻类的光合作用等生理反应,是抑制藻类生长的主要原因[3-4]。然而,植物化感物质的产生和释放在不同物种之间以及同一物种的不同器官(根、茎、叶)之间存在差异[7-8]。
水芹[Oenanthejavanica(Blume) DC.]为伞形科多年生宿根草本水生植物,又名小叶芹、水芹菜、野芹等,一般生长在低湿洼地、浅水沼泽与河流岸边。是我国常见的一种兼具食用和药用功能的食用蔬菜,在江苏、安徽、湖北、江西、浙江和海南等地的采集和种植食用历史悠久,具有生长速度快、营养吸收和繁殖能力强、季节适应性好、易于收获管理等生存特征[9],是污水植物修复的理想材料[10-11]。生态浮床又称生态浮岛或人工浮床,具有可移动、易维护、相兼生物修复与景观打造等特点,广泛应用于富营养化水体修复。水芹由于其可食的蔬菜特性,用于生物修复后存在一定的食用安全风险;而水芹浸提物对水华藻类具有化感抑制作用[12]。因此,生物修复后的水芹可转化为生物质资源以制备生物抑藻剂。与水华蓝藻处理的超声波[13]、化学氧化剂[14]、光催化[15]、改性生物炭[16]、灭藻剂[17]、生物絮凝剂[18]等物理化学法相比,生物抑藻具有绿色、环保和低碳的特点,开发应用的前景广阔。然而,目前对水芹不同生长阶段和不同器官中的化感物质研究未见报道,这不利于生物修复后水芹的资源化利用与生物抑藻剂的开发。
目前,水体富营养化形势依旧严峻,开发高效、经济、环境友好型的生物控藻华技术,对水资源保护和生态系统管理具有重要意义,也成为研究热点之一。该研究以浮床种植水芹为研究材料,明确了水芹种植水的化感抑藻效应,分析不同发育阶段水芹中化感物质的种类、含量和释放可能性,并对幼苗期水芹各器官中的主要化感物质进行靶向分析,研究结果为水芹生物抑藻剂的开发利用提供了科学依据。
1 材料与方法
1.1 材料
1.1.1 植物材料
水芹为四季常绿金陵1号品种,采用浮床技术无土种植于江苏省宿迁市渔樵专业合作社的富营养化水体水面。
1.1.2 藻类材料
藻类为铜绿微囊藻(MicrocystisaeruginosaKützing),购自中国科学院水生生物淡水藻种库,编号为FACHB-524。供试藻种采用pH值7.0±0.1的BG-11培养基培养,培养条件:光照强度4 000 lx [光源灯光型号BN058C LED11/CW L1200,光合有效辐射强度(PPFD) 54 μmol·m-2·s-1],每日光照时长12 h,温度(25 ± 1)℃。每日摇动培养瓶1~2次,每7~10 d转接1次。
1.2 方法
1.2.1 藻类生长抑制实验
将取回的水芹用自来水清洗,包括根部,并用无菌水冲洗3次。称取鲜重150 g的整株植物样本在BG-11培养液中种植7 d。分别用3层无菌纱布和0.22 μm过滤器过滤,去除植物残体和微生物,得到种植水。将100 mL处于指数生长期的铜绿微囊藻(细胞密度为1×107mL-1)接种至装有BG-11培养液的三角瓶进行培养。然后将制备好的水芹种植水分别按0、25、50 mL添加到含有100 mL铜绿微囊藻的三角瓶中,再用BG11培养液将总体积调节至200 mL,此时三角瓶中的藻类细胞浓度为2×107mL-1(初始浓度)。所有处理均有3个重复,无种植水的处理组为对照。藻类培养温度25 ℃,光照强度4 000 lx (光源灯光型号BN058C LED11/CW L1200,光合有效辐射强度54 μmol·m-2·s-1),每日光照时长为12 h。每日摇动三角瓶各3次,并随机改变位置以减少光线对藻类生长的影响。
1.2.2 水芹种植水处理
于2019年11月中旬,分别将处于繁殖期、幼苗期和成熟期的水芹取回,取各阶段水芹鲜重150 g,用超纯水清洗表面附着物,迅速置于1 L BG-11培养液中。各阶段植物样品设置3个重复,其中繁殖期的匍匐茎直接置于培养液中,而幼苗期和成熟期种苗将根部置于培养液中。7 d后分别取出水样,用3层无菌纱布和0.22 μm过滤器过滤,分为45 mL并冷冻干燥,然后添加500 μL甲醇:水(体积比7:3,含0.1%甲酸)溶液溶解。随后,样品在4 ℃下以离心力11 200×g离心10 min,然后冷冻干燥,在-20 ℃储存。最后,将冷冻样品在200 μL 体积分数30%乙腈中溶解,进行非靶向代谢组学分析。
1.2.3 植物样品处理
挑选大小均一、生长正常、无机械损伤的幼苗期水芹植株的茎、叶和根(各0.1 g)研磨并放入15 mL玻璃管中冷冻。称取约100 mg冷冻植物样品,用2 mL 4 mol·L-1NaOH水溶液处理。混合溶液在40 ℃下,置于具有摇动和避光保护的气浴中水解2 h。用4 mol·L-1HCl溶液将pH值调整为2。在室温下,用2 mL正己烷摇动混合物20 min,以除去正己烷层。使用乙酸乙酯(2 mL×2次)提取水层,并将混合提取物在35 ℃旋转蒸发器上减压浓缩至接近干燥。将残余物溶解在200 μL体积分数50%的甲醇-水溶液中,并转移到配有插入装置的小瓶中,以进行下一步的目标代谢组学分析。
1.3 检测方法
1.3.1 水芹种植水代谢物非靶向测定分析
采用液相色谱-电喷雾离子源-质谱联用(liquid chromatography-electrospray ionization-mass spectrometry, LC-ESI-MS)分析方法进行检测,其中色谱条件为:色谱系统采用的是Thermo DGLC双三元超高效液相系统,根据化合物的性质,分别采用Waters BEH C18 (100 mm×2.1 mm,1.8 μm)和Waters BEH Amide(100 mm×2.1 mm,1.8 μm)液相色谱柱进行分离,进样量为2 μL。反相色谱条件:流动相A(体积分数0.1%甲酸-水溶液),流动相B(体积分数0.1%甲酸-乙腈),流速为0.30 mL·min-1,进样量为5 μL,柱温为40 ℃。正相色谱条件:流动相A(100 mmol·L-1乙酸铵-水溶液),流动相B(乙腈),流速为0.30 mL·min-1,进样量为5 μL,柱温为40 ℃。质谱条件为:质谱系统采用的是美国Thermo公司的Q exactive高分辨质谱检测系统,配有电喷雾离子源和Xcalibur工作站。采用电喷雾离子源(electrospray ionization, ESI),分析物在正负离子同时扫描下以全扫描检测(Full MS)模式进行分析,该模式可以最大程度地检测到可能的化合物。
1.3.2 水芹体内代谢物靶向测定分析
采用LC-ESI-MS方法,对样品中酚酸进行定性定量检测,色谱参数为:采用超高效液相系统(Vanquish, Thermo, USA),利用Waters HSS T3 (50 mm× 2.1 mm,1.8 μm)液相色谱柱,进样量为2 μL,柱温为40 ℃。使用Agilent气象色谱系统(Agilent 6 890; Agilent Technologies, USA),根据化合物的性质,采用CP-Sil 88(100 m × 0.25 mm × 0.25 μm)气相色谱柱,对植物样品中的脂肪酸进行分离检测。流动相A(体积分数0.1%甲酸-乙腈),流动相B(体积分数0.1%甲酸-水溶液);质谱参数为:采用美国Thermo公司的Q Exactive高分辨质谱检测系统,配有ESI和Xcalibur工作站。采用ESI,分析物在负离子扫描下以单离子检测(SIM)模式进行分析,该模式可以大大提高灵敏度。优化的质谱分析条件如下:鞘气40 arb;辅助气10 arb;离子喷雾电压+3 000 V;温度350 ℃;离子传输管温度320 ℃。
1.4 数据处理
使用Xcalibur 4.1(Thermo Scientific)在Q-Exactive上采集数据,并使用TraceFinderTM4.1 Clinical(Thermo Scientific)进行处理。量化数据输出为Excel格式。所有数据图表均在RStudio、Origin 2021、Adobe illustrator 2020软件中绘制,采用SPSS 26.0软件对实验结果进行单因素方差分析(ANOVA)、显著性分析(t检验)和相关性分析(Pearson),数值以平均值±标准误表示。
2 结果与分析
2.1 水芹种植水对铜绿微囊藻的生长抑制
水芹种植水对铜绿微囊藻的生长抑制效果如表1和图1所示。在蓝藻细胞接种后的第7天,对照组细胞生长迅速,密度达(18.6×108±103) mL-1,蓝藻培养液为墨绿色(图1)。在培养液中加入占比为12.5%的种植水,尽管铜绿微囊藻保持稳定生长状态,但是与对照相比,细胞颜色从正常绿色变为黄色(图1),并且细胞密度也降低到(10.9×107±87) mL-1,显著低于对照组,表明铜绿微囊藻处于亚健康状态,细胞生长受到抑制。在加入25%种植水处理组中,细胞密度显著降低,并在第7天变成絮状沉淀(图1),表明铜绿微囊藻无法在这种比例的种植水下存活。可见,水芹种植水中存在抑制或阻止铜绿微囊藻生长的化学物质。

图1 第7天水芹种植水对铜绿微囊藻的抑制作用

表1 水芹种植水对铜绿微囊藻的生长影响
2.2 水芹种植水检测数据质量控制分析
为鉴定水芹种植水中具有抑藻作用的化学物质的组成,明确不同生长阶段水芹种植水中是否均具有抑藻作用的化学物质,对繁殖期、幼苗期和成熟期3个生长阶段水芹种植水进行了非靶向代谢组学分析。采用Waters BEH C18 (100 mm×2.1 mm, 1.8 μm)液相色谱柱,样品正、负(图2-A和图2-B)模式总离子流谱(total ion chromatogram, TIC)图显示,该检测条件下峰形良好,分布相对均匀。采用Waters BEH Amide (100 mm×2.1 mm, 1.8 μm)液相色谱柱,样品正、负(图2-C和图2-D)模式TIC图显示,峰分离度高、峰形良好,表明种植水中化感物质检测数据质量控制良好,测试平台可靠有效。

3条曲线为3个样品重复,3条曲线重合度越高,说明试验重复性越好;图中数字为出现峰值的时间(min)。
2.3 水芹种植水不同生长阶段非靶向分析
利用LC-ESI-MS检测法对不同生长阶段水芹种植水进行非靶向分析,发现各个生长阶段均具有306种相同的代谢物(图3),即不同生长阶段水芹种植水中均具有抑藻作用的化学物质。这些代谢物中2类常见化感物质酚酸类和脂肪酸类[19]的多样性丰富、相对含量较高。酚酸类化感物质有36种,其中咖啡酸、阿魏酸、水杨酸和苯甲酸的含量相对较高;脂肪酸类化感物质有24种,含量较高的包括正壬酸、肉豆蔻酸、棕榈酸和硬脂酸等。
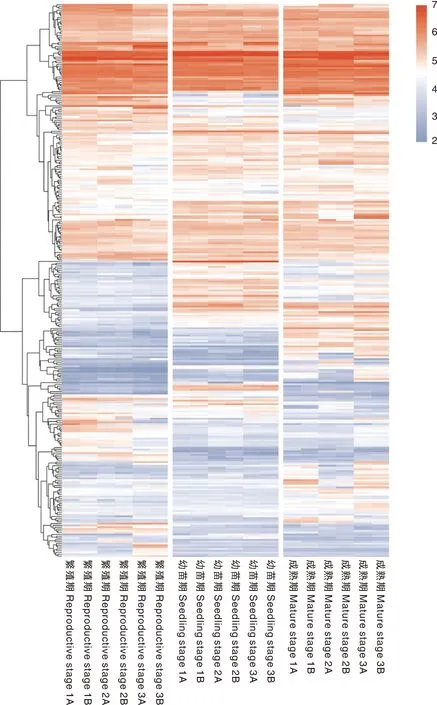
每个方块代表一个样品中某一代谢物的含量,颜色越红代表含量越高,颜色越蓝代表含量越低,各时期1~3为3个生物学重复,A、B为2个技术重复。下同。
2.3.1 种植水酚酸类化感物质分析
3个不同发育阶段水芹种植水中的酚酸类化感物质含量差异如图4所示,上部粉色部分代表每个发育阶段种植水中酚酸类化感物质相对含量最高的13种物质。幼苗期酚酸类化感物质的相对含量显著高于繁殖期和成熟期,如阿魏酸、咖啡酸、水杨酸、儿茶酚、龙胆酸、4-羟基苯甲酸和2-(2′-羟基-3,5′-二叔丁基苯基)-5-氯苯并三唑这7种酚酸。对不同发育阶段水芹种植水中差异显著的酚酸类化感物质进行比较分析,36种酚酸类化感物质中,幼苗期与繁殖期在P<0.05水平上存在显著差异的酚酸有4种,分别为苯甲酸、弗拉西汀、对羟基苯甲酸丙酯和3′,4′-二羟基苯基丙酮;而幼苗期与成熟期在P<0.05水平上存在显著性差异且差异倍数均大于1的酚酸类物质有11种,分别为阿魏酸、咖啡酸、水杨酸、2-甲基-4,6-二硝基苯酚、4-羟基苯甲醛、3-氨基水杨酸、儿茶酚、2-(2′-羟基-3,5′-二叔丁基苯基)-5-氯苯并三唑、3,5-二羟基苯甲酸和4-二硝基苯酚(表2)。因此,浮床水芹幼苗期种植水中的酚酸类化感物质相对含量较高。
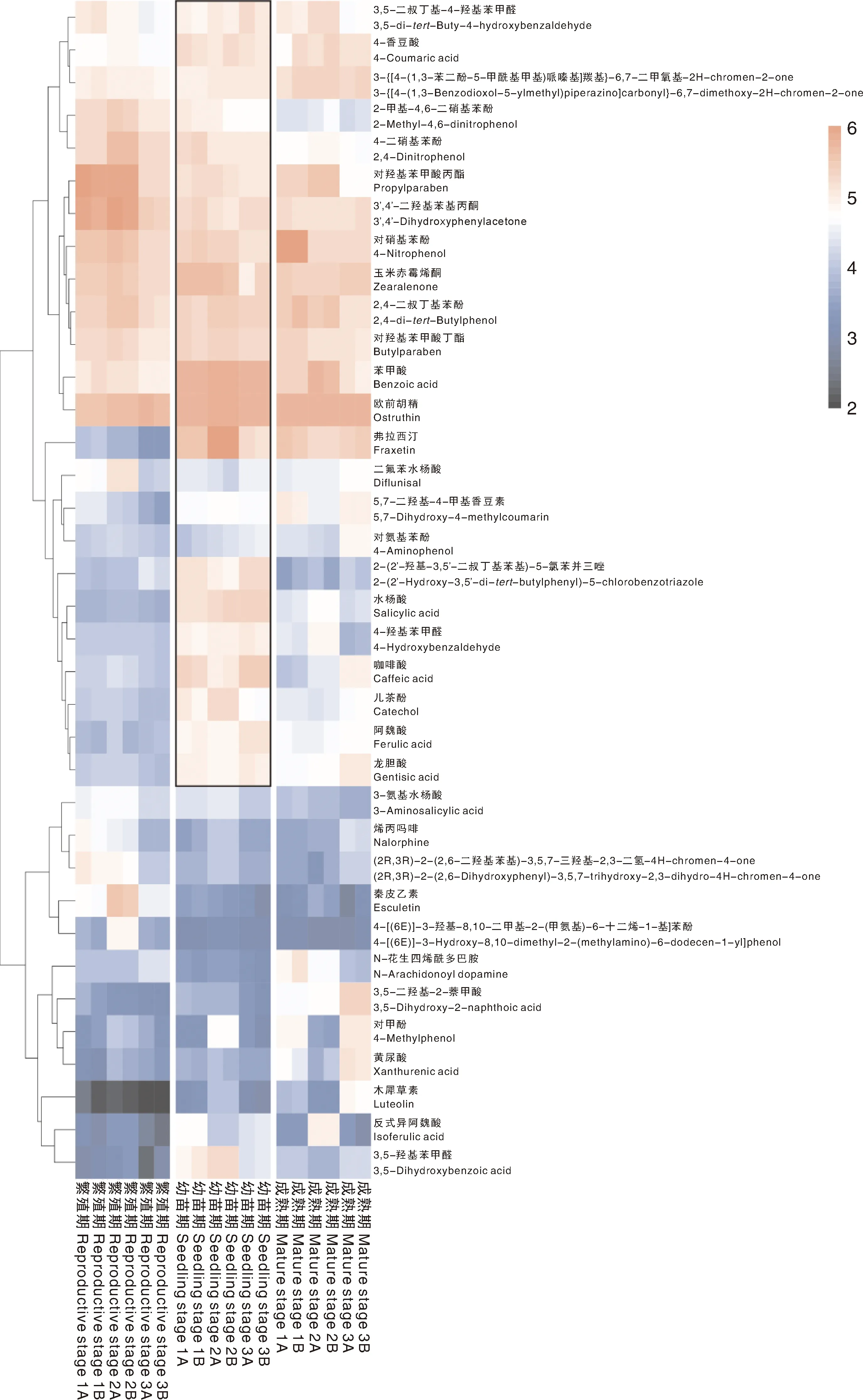
图4 不同时期水芹种植水中酚酸含量热图
2.3.2 种植水脂肪酸类化感物质分析
图5为3个不同发育阶段水芹种植水中的脂肪酸类化感物质含量差异,上部红色部分代表每个发育阶段种植水中脂肪酸类化感物质相对含量最高的15种物质。在3个不同发育阶段,幼苗期脂肪酸类化感物质的相对含量高于繁殖期和成熟期,如硬脂酸、肉豆蔻酸、DL-乳酸、丙酮酸、壬二酸等脂肪酸。对不同发育阶段水芹种植水中存在差异显著的脂肪酸类化感物质进行比较分析,结果见表3。24种脂肪酸类化感物质中,幼苗期与繁殖期在P<0.05水平上存在显著差异的脂肪酸共有3种,分别为DL-乳酸、硬脂酸和壬二酸;而幼苗期与成熟期比较发现,幼苗期有6种脂肪酸类化感物质在P<0.05水平上存在显著性差异,且差异倍数大于1,分别为羟基丁酸、柠檬酸、3,3-二甲基戊二酸、硬脂酸、3-叔丁基己二酸和癸酸。因此,在浮床水芹3个不同发育阶段中,幼苗期种植水中脂肪酸类化感物质的相对含量最高。
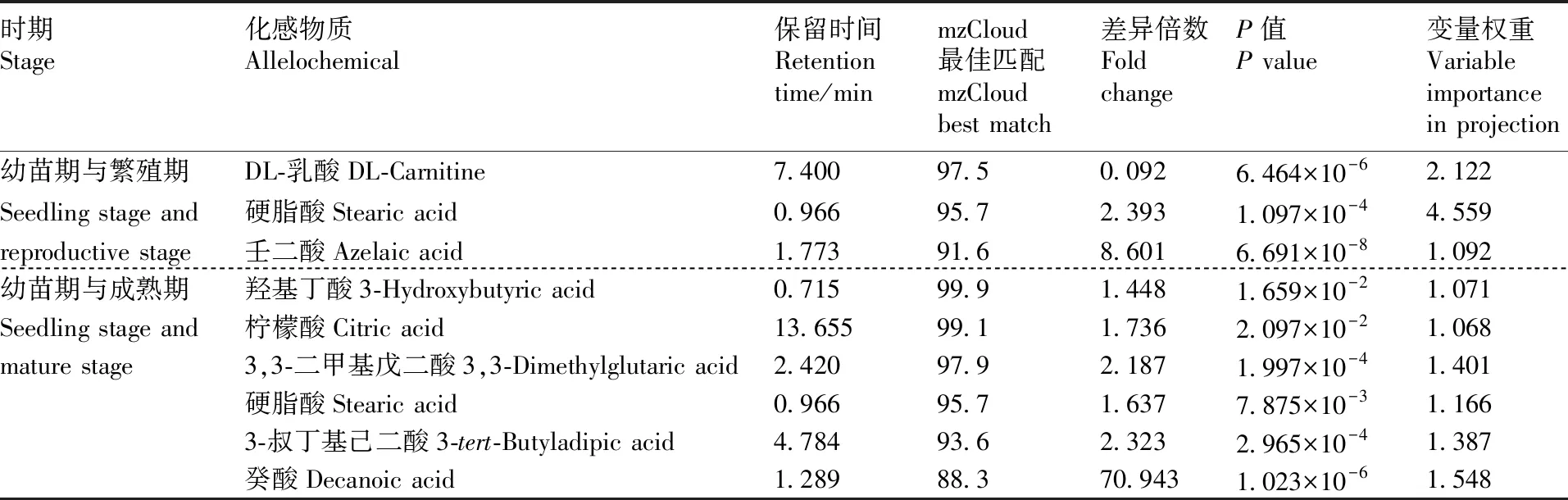
表3 不同发育时期水芹种植水中存在显著差异的脂肪酸类化感物质
2.4 水芹植株检测数据质量控制分析
为进一步确认水芹种植水中所含酚酸类和脂肪酸类化感物质是否由水芹自身合成和释放,对水芹幼苗期整个植株的根、茎和叶进行了以酚酸和脂肪酸为目标的靶向分析。如图6所示,本研究检测条件下分别采用Waters HSS T3 (50 mm×2.1 mm, 1.8 μm)液相色谱柱和CP-Sil 88(100 m×0.25 mm×0.25 μm)气相色谱柱的样品峰形良好,分布相对均匀。
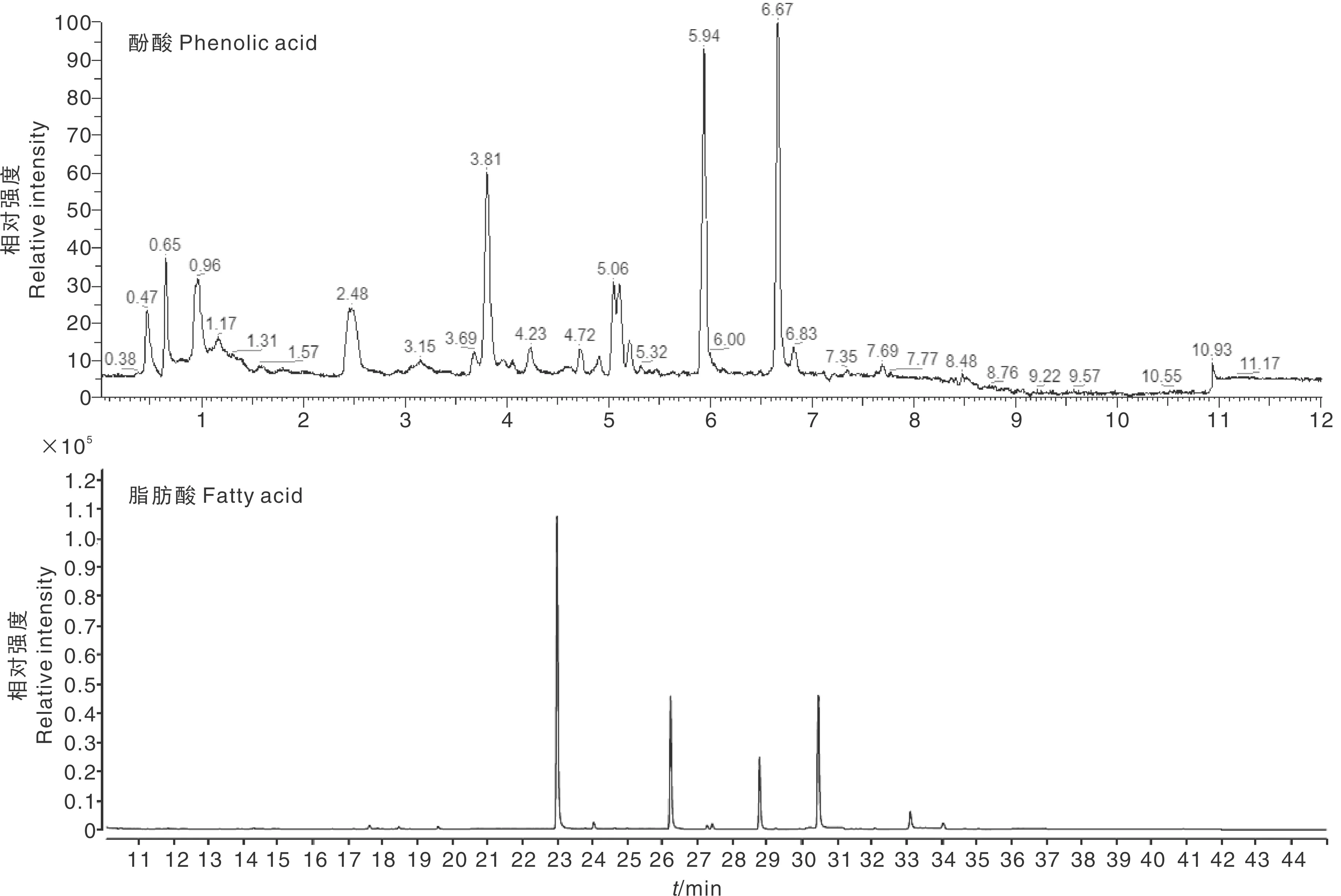
图6 水芹中的酚酸类和脂肪酸类化感物质色谱图
2.5 水芹体内不同器官靶向分析
2.5.1 水芹体内酚酸类物质靶向分析
水芹体内不同器官中酚酸类化感物质占比和含量差异分析结果如表4所示,通过对水芹幼苗期的根、茎和叶进行靶向分析,检测出阿魏酸、咖啡酸、水杨酸、苯甲酸等18种酚酸类化感物质。在水芹3个不同器官中,阿魏酸和咖啡酸的占比显著高于其他酚酸类化感物质,阿魏酸在根、茎和叶中的占比分别达到41.26%、52.54%和21.69%,在茎中占比最高;咖啡酸在3个不同器官中的占比分别达到28.76%、18.77%和53.16%,在叶中占比最高;此外,没食子酸、香草酸、4-羟基苯甲酸、香草醛和4-羟基肉桂酸5种酚酸类化感物质在水芹根、茎和叶3个不同器官中占比较高。根据水芹3个不同器官中酚酸类化感物质含量差异分析得出,整体而言,根、茎和叶中酚酸类化感物质含量由高到低分别为叶>根>茎。咖啡酸和阿魏酸的含量显著高于其他酚酸类化感物质,且咖啡酸和阿魏酸在叶中的含量均显著高于根和茎,分别达到(37.26±2.21)ng·mg-1和(15.20±1.98)ng·mg-1。另外,没食子酸、香草酸、4-羟基苯甲酸、香草醛和4-羟基肉桂酸5种酚酸类化感物质均在水芹叶中含量最高。
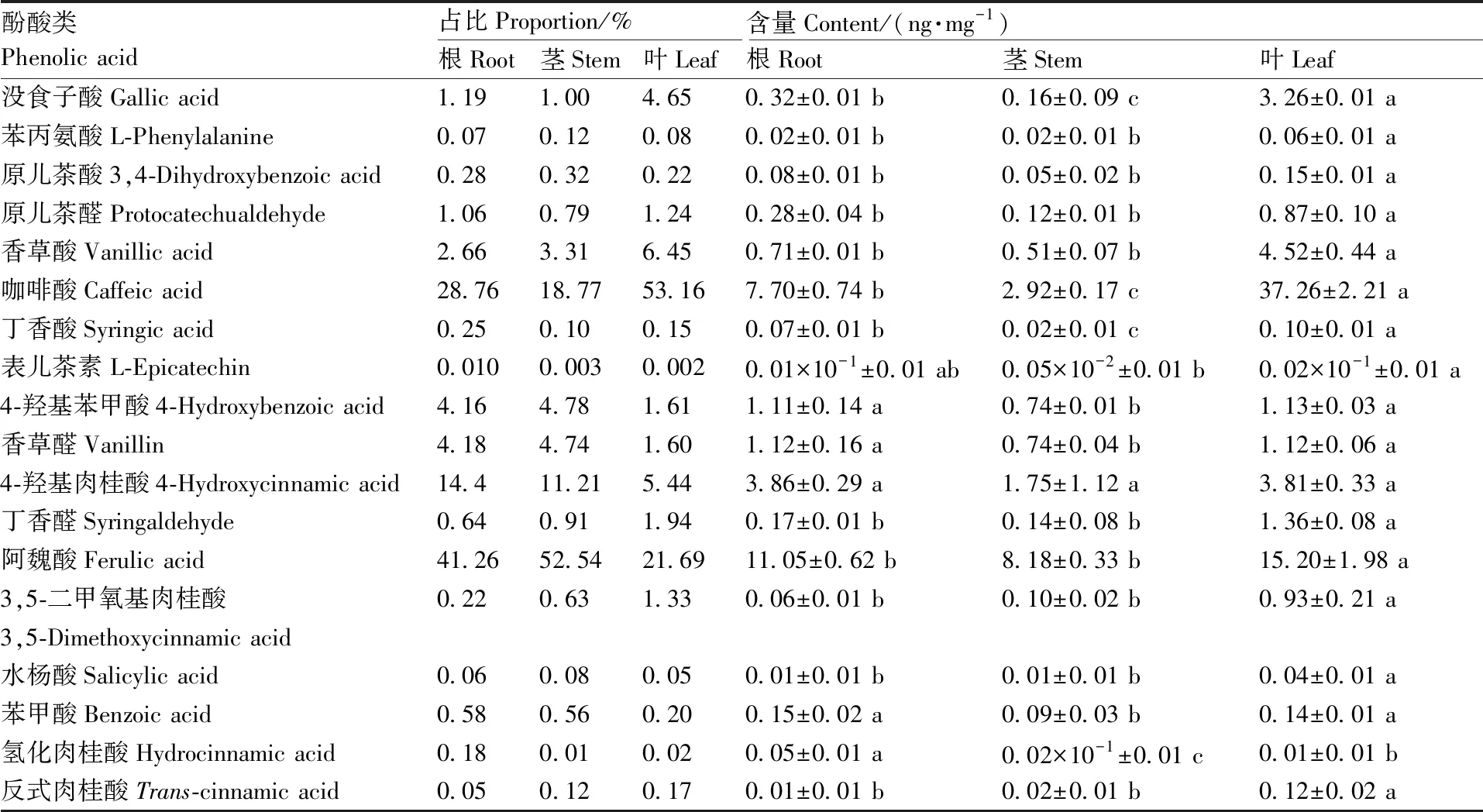
表4 水芹根、茎和叶3个不同器官中酚酸占比和含量
2.5.2 水芹体内脂肪酸类物质靶向分析
对幼苗期水芹的不同器官进行靶向分析,在根、茎和叶中均检测出33种脂肪酸类化感物质(表5)。在根、茎和叶中,棕榈酸、十七碳烯酸、硬脂酸和反油酸的占比显著高于其他脂肪酸类化感物质,且棕榈酸的占比最高,在根、茎和叶中分别达到20.53%、19.75%和16.78%;其次为硬脂酸,占比分别为14.42%、12.65%和8.67%。另外,亚油酸、反亚油酸和芥酸这3种脂肪酸类化感物质在水芹不同器官中具有较高比重。整体而言,根、茎和叶中脂肪酸类化感物质含量由高到低分别为叶>根>茎。棕榈酸、十七碳烯酸、硬脂酸和反油酸4种脂肪酸类化感物质含量显著高于其他脂肪酸,棕榈酸在叶中含量最高,为(778.74±8.22)ng·mg-1,十七碳烯酸和硬脂酸均在根中含量最高,分别为(294.44±15.07)ng·mg-1和(450.70±14.32)ng·mg-1,反油酸在根和茎中含量显著高于叶。此外,亚油酸、反亚油酸和芥酸3种脂肪酸类化感物质在水芹叶中含量最高。
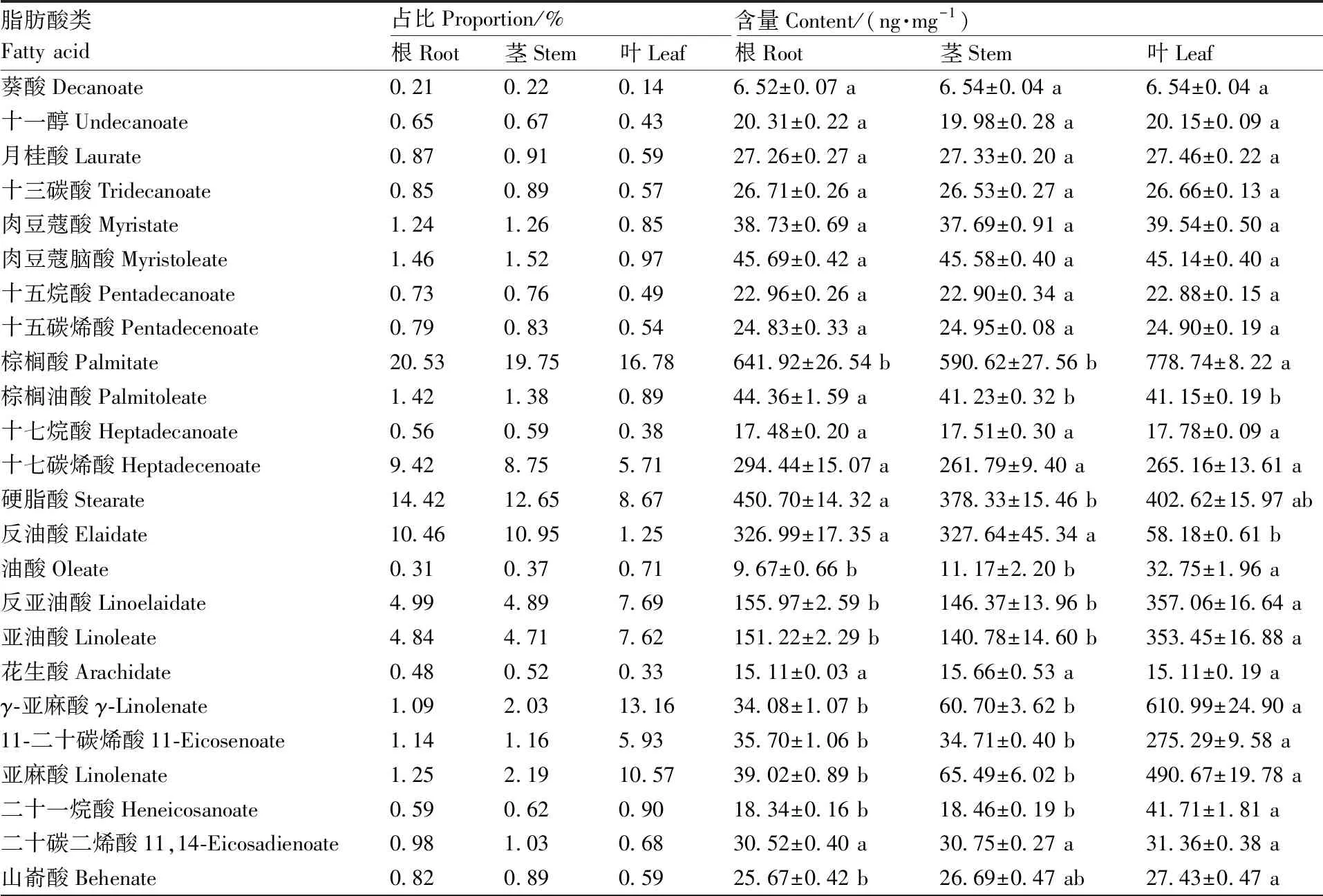
表5 水芹根、茎和叶中脂肪酸占比和含量
3 结论与讨论
酚酸类和脂肪酸类化合物是自然界中种类较多、存在较为广泛的化感物质[20]。陆生植物的化感物质主要通过凋落物降解、土壤冲洗、雨雾淋溶和人工投放等途径释放到水体,对蓝藻生长发挥着显著的抑制效用[21]。如菊科、罂粟科、百合科和禾本科等陆生草本植物种植水和浸提液中的酚酸、脂肪酸、萜类和含氮化合物等物质对铜绿微囊藻的生长表现出不同程度抑制,同时降低叶绿素含量[22]。木本植物的壳斗科栎属17种植物的树皮浸提液中酚酸类化合物对铜绿微囊藻的生长抑制率均超过50%[23]。水生植物的种植水和浸提液同样对藻类的生长具有抑制作用,其通过根、茎和叶直接释放化感物质至水环境,可对藻类生长产生影响,沉水植物苦草(Vallisnerianatans)[24]和穗花狐尾藻(Myriophyllumspicatum)[25]、挺水植物菖蒲(Acoruscalamus)[26]和梭鱼草(Pontederiacordata)[27]、浮水植物萍蓬草(Nupharpumilum)[28]等浸提液中的酚酸、脂肪酸等化合物对藻类的有效抑制率可达52.9%~94.6%。因此,陆生和水生植物分泌的化感物质均可对藻类产生抑制效应,其中酚酸类和脂肪酸类较为常见。现已提取并鉴定的抑藻化感物质有90余种,常见类型有酚类化合物、脂肪酸/酯类、萜类和含氮化合物等[29]。
植物的生长状态对其表现的化感抑藻作用也有较大的影响。通过对水芹种植水的非靶向分析发现,水芹在繁殖期、幼苗期和成熟期3个不同生长阶段具有相同的化感物质(36种酚酸和24种脂肪酸类化感物质),但在幼苗期的种植水中,酚酸和脂肪酸类化感物质的含量显著高于另外2个生长阶段。Mulderij等[36]通过对轮藻的研究发现,其幼芽时期化感作用最强烈,可明显延长藻类的停滞期,其次为生长周期较短的轮藻,生长周期较长的轮藻化感抑藻效果相对最弱。Hootsmans等[37]发现,篦齿眼子菜在生长过程中其化感活性持续减弱。水芹表现与上述研究结果一致,说明幼苗期种植水的抑藻效果高于繁殖期和成熟期。
植物化感物质的合成和释放在同一物种的不同器官或组织间也存在差异。对水芹植株进行靶向分析发现了18种酚酸和33种脂肪酸类化感物质,经过对比分析得出叶片中酚酸类化感物质含量显著高于茎中,且咖啡酸和阿魏酸2种酚酸类化感物质含量最高;叶片中脂肪酸类化感物质含量最高,尤其是棕榈酸和硬脂酸的含量。徐贵华等[38]对柑橘果实研究发现,果肉中酚酸含量随成熟阶段提高而减少,果皮中酚酸含量在半成熟阶段显著高于未成熟和成熟阶段,且果皮中酚酸含量显著高于果肉。将芦苇不同部位(根、地下茎、茎和叶片)的浸提液对蛋白核小球藻的生长抑制作用进行比较发现,叶片的抑藻效果最好[39]。水芹叶片中化感物质含量最高,其次是根,最后是茎,这与柑橘和芦苇中的研究结果类似。
通过对繁殖期、幼苗期和成熟期水芹种植水,以及水芹根、茎和叶的代谢组学分析发现,水芹种植水和其体内酚酸和脂肪酸类化感物质种类丰富。种植水中幼苗期化感物质相对含量显著高于繁殖期和成熟期;幼苗期水芹叶中酚酸和脂肪酸类化感物质含量高于根和茎中的含量。水芹种植水和其体内的化感物质种类存在较多重复。因此,种植水中的化感物质可能由水芹自身释放,这些物质的释放是水芹种植水和浮床水芹在富营养化水体中化感抑藻的主要原因。
水芹的叶片和根是制作抑藻剂的最佳原材料。水生植物在自然状态下生长代谢所分泌的化感物质含量较少,释放到水体中后又受到水中生物和非生物因子的影响,当水华藻类大量暴发时难以起到很好的抑制效果。因此,人工提取或合成具有高效抑藻作用的化感物质和原材料的筛选迫在眉睫[20]。水芹具有根系发达、适应性强、生长迅速、易扦插繁殖、个体生物量大等特点[40],且自身能够合成、释放丰富的化感物质。另外,水芹的化感物质主要在叶片和根中富集,而茎是主要的食用部位。水芹中酚酸类和脂肪酸类化感物质丰富,作为提取制作抑藻剂的原材料,后续还需以水芹酚酸类和脂肪酸类化感物质抑制单一和混合水华蓝藻的功效为导向,建立水芹立体化、精细化、深加工利用方法;从靶向物质含量测定、活性评价和环境影响等方面建立对提取物的质量评定方法与标准,以期实现靶向物质的低碳、经济、无污染提取和应用。
