中华鳖性别分子鉴定方法开发与验证
2023-12-03葛健辉任晋东关文志牛宝龙许晓军
葛健辉,任晋东,关文志,牛宝龙,王 伟,楼 宝,于 瑾,许晓军,*
(1. 浙江省农业科学院 水生生物研究所,浙江 杭州 310021; 2.浙江万里学院 生物与环境学院,浙江 宁波 315100; 3.龙游县养殖业发展中心,浙江 衢州 324000)
中华鳖(Pelodiscussinensis)隶属于爬行纲龟鳖目鳖科(Trionychidae)中华鳖属(Pelodiscus),俗称甲鱼、团鱼、王八等,在我国分布于除新疆、西藏和青海以外的各个省份。中华鳖2021年全国养殖总产量达36.5万t,是我国重要的特种水产养殖品种之一[1]。中华鳖作为重要的名贵水产品,其养殖生产性能存在显著的性别二态性,雄鳖生长速度较雌鳖快25%~30%,生长速度差异十分显著[2]。因此,中华鳖产业对单性养殖和性控育种有强烈需求。
为实现中华鳖单性养殖与性控育种,首先需要确定中华鳖的性别决定类型。脊椎动物中存在2种性别决定类型,分别为环境性别决定(environmental sex determination, ESD)和基因型性别决定(genetic sex determination, GSD)[3]。在ESD类型中,动物的性别受各种环境因素的影响,例如:长日光周期条件下,端足目动物钩虾(Echinogammarusmarinus)群体中雄性性别比例提高,而短日光周期条件下群体中雌性性别比例提高;小丑鱼(Amphiprion)群体中雌鱼消失或死亡时,会导致雄鱼性逆转为雌鱼;鳄鱼(Crocodylia)在低温和高温孵化产生雌性,而在中等温度孵化则雄性占优势;锦龟(Chrysemyspicta)和巨型侧颈龟(Podocnemisexpansa)在低温孵化产生雄性,而高温孵化产生雌性[3-8]。GSD类型分为XX/XY性染色体和ZZ/ZW性染色体2种不同的异配系统[9-10]。中华鳖属于ZZ/ZW类型[11]。中华鳖养殖周期长,生态养殖模式下需要1冬龄才可能通过外观进行性别鉴别。因此,开发出中华鳖早期性别分子鉴定技术,准确鉴别初孵稚鳖性别,有助于实现稚鳖期单性分塘养殖,降低成本、提高效益。对中华鳖性控育种研究而言,性别分子鉴定技术直接服务性别逆转效果评估和核心种质筛选。目前已报道的中华鳖性别鉴定方法有核型分析、比较基因组杂交(comparative genome hybridization, CGH)和qPCR检测18S-28S rRNA拷贝数量差异等[10,12-15]。
有研究采用荧光原位杂交技术(FISH)发现中华鳖Strawberry Notch 1(SBNO1)基因同时定位在Z和W两条染色体上[10]。在小鼠中,SBNO1基因与早期睾丸发育相关[16]。以上文献提示SBNO1基因可能与中华鳖性别决定或性别分化相关。本研究针对雌雄中华鳖SBNO1基因内含子差异设计特异性引物并进行扩增验证,开发出一种微创、简便快捷的性别分子鉴定方法。
1 材料与方法
1.1 实验样本
中华鳖日本品系作为参考基因组种群,而清溪乌鳖为我国本土种群。因此,本研究选用24只中华鳖日本品系和24只清溪乌鳖成体,分别采集于浙江萧山天福省级中华鳖日本品系良种场和浙江清溪鳖业股份有限公司,2个种群的中华鳖均为雌雄各半。所有待检个体经解剖性腺验证生理性别后,剪取后肢肌肉组织样本,于液氮闪冻后保存于-80 ℃,待用。
1.2 DNA的提取
参照天根组织基因组DNA提取试剂盒说明书提取中华鳖雌雄个体基因组DNA,通过1.0%琼脂糖凝胶电泳和NanoDrop-2000紫外分光光度仪检测基因组DNA纯度和浓度,将基因组DNA置于-20 ℃保存。
1.3 引物设计
根据SBNO1基因cDNA序列(accession number: AB478253),在NCBI中华鳖日本品系参考基因组(GenBank assembly accession number: GCA_000230535.1)中检索,得到Scaffold1(GenBank: JH206134.1)和Scaffold2(GenBank: JH208507.1)。使用Clustalw对SBNO1基因外显子(accession number: XM_006113718)与Scaffold1和Scaffold2进行在线比对。查找并标注外显子与内含子后,发现Scaffold1的第4个和第5个外显子与Scaffold2的第4个和第5个外显子高度同源,但Scaffold1第4个和第5个外显子之间的内含子(1 892 bp)与Scaffold2第4个和第5个外显子之间的内含子(1 488 bp)存在明显差异。使用Primer 5.0软件对2个Scaffold第4个和第5个外显子区段序列设计引物,正向引物序列为:5′-TGGTGCTGTRAAGAAGGMRRCT-3′,反向引物序列为:5′-TTCTTCATCTTCCTCCTCRGGT-3′。
1.4 PCR扩增与验证
以中华鳖日本品系雌鳖13号与雄鳖1号基因组DNA为模板进行PCR扩增。PCR反应体系:中华鳖基因组DNA(50 ng·μL-1)1 μL,正反向引物(20 μmol·μL-1)各2 μL,10× ExTaqBuffer(Mg2+free)5 μL,MgCl2(25 mmol·μL-1)3.3 μL,dNTP mixture(各碱基浓度2.5 mmol·μL-1)4 μL,TaKaRa ExTaq(5 U·μL-1)0.25 μL,ddH2O补足至50 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 100 s,35个循环;72 ℃ 5 min。扩增完成后,取5 μL反应产物用1.0%琼脂糖凝胶电泳检验。扩增产物转化测序,各挑取10个克隆子送生工生物工程(上海)股份有限公司进行测序验证。
1.5 中华鳖性别鉴定准确率检验
以各24个雌雄中华鳖基因组DNA为模板进行PCR扩增。PCR反应体系与反应条件同1.4节。扩增完成后,取5 μL扩增产物进行琼脂糖凝胶电泳,记录各样本的扩增产物条带。结合各样本解剖性腺记录,计算性别鉴定准确率。
2 结果与分析
2.1 引物扩增验证
引物扩增验证电泳结果如图1所示,中华鳖日本品系雌鳖13号样本扩增产物为2 031 bp和1 624 bp双条带;中华鳖日本品系雄鳖1号样本扩增产物为2 031 bp单一条带。并发现PCR体系中DNA模板量在25~75 ng、退火温度在60~64 ℃,对电泳条带结果无影响;而改变延伸时间对2 031 bp条带的亮度有一定的影响。延伸时间过短会导致在相同延伸时间条件下,小片段扩增效率较高,延长延伸时间可以使2 031 bp片段得到充分延伸,条带亮度会有一定改善。克隆测序结果显示,雌鳖13号样本扩增出现的2 031 bp条带序列与Scaffold1中引物设计扩增序列一致,1 624 bp条带序列与Scaffold2中引物设计扩增序列一致;雄鳖1号样本扩增出现的2 031 bp条带序列与Scaffold1中引物设计扩增序列一致。
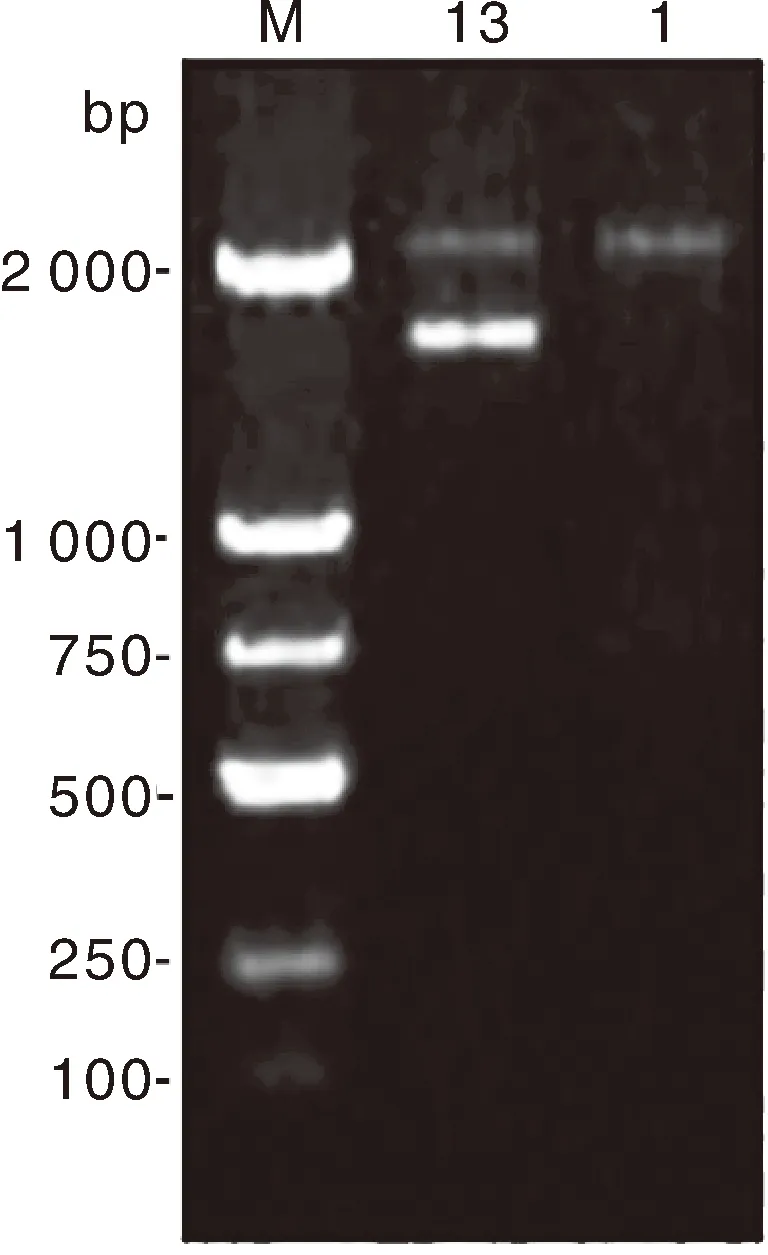
M,DL2000 DNA分子量标准;13,中华鳖日本品系雌鳖扩增产物;1,中华鳖日本品系雄鳖扩增产物。
2.2 中华鳖性别鉴定准确率
48只雌雄中华鳖PCR性别检验电泳结果如图2所示,1~12号和25~36号雄性中华鳖样本扩增产物为2 031 bp单一条带;13~24号和37~48号雌性中华鳖样本扩增产物为2 031 bp和1 624 bp双条带。结合解剖学性别鉴定记录,判别准确率为100%。
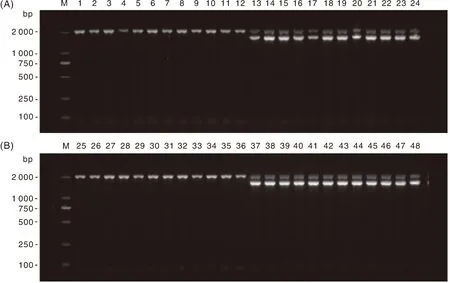
A:M,DL2000分子量标准;1~12号样本为中华鳖日本品系雄鳖扩增产物;13~24号样本为中华鳖日本品系雌鳖扩增产物。B:M,DL2000分子量标准;25~36号样本为清溪乌鳖雄鳖扩增产物;37~48号样本为清溪乌鳖雌鳖扩增产物。
3 讨论
爬行动物中存在温度依赖型性别决定(temperature-depende sex determination, TSD)和GSD两种性别决定类型[3],并且GSD类型有XX/XY性染色体决定型和ZZ/ZW性染色体决定型2种不同的异配系统[9-10]。在蜥蜴中存在TSD类型和GSD类型,并且其GSD类型中包含了(XY)雄性异配和(ZW)雌性异配[17]。在龟鳖目动物中同样也包含TSD和GSD两种性别决定类型[3]。目前已报道属于TSD类型的有乌龟(Mauremysreevesii)、黄喉拟水龟(Mauremysmutica)、巴西红耳龟(Trachemysscriptaelegans)等[18-20];属于GSD类型的有三弦巨型鹰嘴泥龟(Staurotypustriporcatus)、巨型麝香龟(Staurotypussalvinii)、木雕水龟(Glyptemysinsculpta)、牟氏水龟(Glyptemysmuhlenbergii)、粗颈龟(Siebenrockiellacrassicollis)、巨蛇颈龟(Chelodinalongicollis)、角鳖(Apalonespinifera)、美国鳖(Apalonemutica)、中华鳖(Pelodiscussinensis)等[9,10,14,18,21-24]。其中属于XX/XY性染色体决定型的有三弦巨型鹰嘴泥龟、巨型麝香龟、木雕水龟、牟氏水龟、巨蛇颈龟[9,14,22],属于ZZ/ZW性染色体决定型的有角鳖、中华鳖[10,21]。
关于中华鳖性别决定机制的早期研究认为其属于TSD类型[25-27],而后续CGH和核型分析研究发现了中华鳖异形微型性染色体的存在,证实中华鳖属于ZZ/ZW性染色体决定型[10,15]。本研究根据雌雄中华鳖SBNO1基因内含子差异设计引物并进行PCR扩增检测,雄性个体中出现2 031 bp大小的1条条带,雌性个体中出现2 031 bp和1 624 bp大小的2条条带,印证中华鳖属于ZZ/ZW性染色体异配类型,推测Scaffold1属于中华鳖Z染色体,Scaffold2属于中华鳖W染色体。
通过克隆测序验证发现,雄性与雌性中华鳖的2 031 bp条带序列完全一致,但是雌性中华鳖PCR产物中2 031 bp条带亮度显著弱于1 624 bp条带。这可能是由于PCR偏倚性导致的,在相同延伸时间条件下,单对引物扩增的PCR产物为大小不同的两条带时,小片段扩增效率较高,导致小片段产物量大于大片段。通过适当延长延伸时间可以改善这种现象,但无法完全消除。
中华鳖单性养殖和性控育种需要建立微创、简便快捷的性别鉴定技术。采用核型分析和CGH技术进行中华鳖性别鉴定时,均需要3~5 d完成染色体标本制备。制作染色体标本还需要牺牲待检个体收集骨髓细胞。核型分析操作繁琐,需要大量时间用于镜检、拍照和图像分析等工作[15]。CGH还需要合成荧光探针,成本较高[10,12]。采用qPCR检测18S-28S rRNA拷贝数量进行性别鉴定时,需要荧光定量PCR仪,操作繁琐程度和成本均高于普通PCR检测方法[13]。本研究方法具有以下2个优点:首先,本方法采用常规PCR检测平台,通过微创采血进行检测,可在12 h内完成对初孵稚鳖的早期性别鉴定,无需牺牲待检个体且成本低廉;其次,本方法采用的技术路线为单对引物PCR扩增,根据雌雄扩增产物条带数目差异进行鉴别,相较于扩增检测(Y/W)异配性染色体特异片段的技术路线而言,本方法无需增扩内参基因和优化多重PCR条件,鉴别逻辑更为科学高效。综上所述,本研究提供了一种微创、简便快捷且成本低廉的中华鳖性别分子鉴定技术。该技术可用于中华鳖早期性别鉴定和性控育种研究,促进中华鳖单性养殖和中华鳖全雄品种选育,提高中华鳖养殖效益,促进产业发展。
