内生细菌ZN-S10的鉴定及其对番茄青枯病菌的抑菌作用
2023-12-03王晓楠冯晓晓陈恩磊陈梦丽郑永利吴慧明
王晓楠,冯晓晓,施 斌,陈恩磊,陈梦丽,郑永利,吴慧明,*
(1.浙江农林大学 现代农学院,浙江 杭州 311300; 2.浙江大学 农业试验站,浙江 杭州 310058; 3.浙江省农产品绿色发展中心,浙江 杭州 310003)
番茄(Solanumlycopersicum)是世界上重要的蔬菜作物,在全球广泛种植,番茄含有番茄红素和番茄碱,研究表明,使用番茄或番茄制品对人的健康有益,可以预防癌症和炎症相关疾病[1-3],近年来,番茄在中国的种植面积也不断增加[4],是种植面积超过66万hm2的几种蔬菜之一,2022年种植面积达111.3万hm2。番茄种植过程,是人类与病虫害、异常气候等威胁番茄健康生长的生态因子抗争的过程,灾变的生态因子也常常导致产量下降[5-6]。其中病虫害常造成毁灭性损害[7],目前利用抗病育种和施用化学农药是病虫害防控的主要手段,但长期依靠化学药物,致使病原菌抗药性频率快速提高,同时引发人们对生态系统安全性的担忧[8]。尽管化学农药对虫害、病害有良好的防效,但对番茄青枯病等系统性病害的防治中常出现脱靶现象,导致防控失败,造成不可挽回的经济损失[9]。
植物内生菌和根际微生物是重要的生防菌来源,是研究作物健康生产的热点。其中植物内生细菌在耕作中应用的优势日渐明显,不仅可以通过自身优势占据生态位,还可以与病原菌争夺营养物质,如芽孢杆菌产生的抗菌素[10]或表面活性素等物质可以抑制病原菌的生长[11],破坏病原菌的生物膜,最终导致病原菌死亡。芽孢杆菌属(Bacillus)可以适应多变复杂的环境[12],且功能多样。BacilluspumilusLZP02可以通过改善碳水化合物代谢和苯丙素类生物合成促进水稻根系的生长[13]。BacillusamyloliquefaciensSQRT3可以使番茄叶片中的防御相关基因上调,使番茄青枯病发病率降低68.1%[14]。李生樟等[15]从蕹菜根际土壤中分离到一株贝莱斯芽孢杆菌(Bacillusvelezensis),对水稻细菌性条斑病菌(Xanthomonasoryzaepv.oryzicola,Xoc)具有显著的拮抗活性。Upreti 等[16]从抗病番茄与感病番茄根部分离到的8~9株拮抗细菌可以有效控制番茄青枯病。黄银等[17]从甘草中筛选到234株具有拮抗苹果腐烂病菌(Cytosporamali)的内生细菌,为苹果腐烂病生物防治提供了丰富的菌株资源。众多学者从多种作物中分离到有显著抑菌作用的内生细菌[18-20]。一些植物内生细菌具有促进寄主植物生长、产生抑菌物质、诱导植物抗性等功能而成为重点研究对象。
本实验室从番茄根部分离得到一株具有促生作用的芽孢杆菌,根据形态特征、生理生化特征、脂肪酸测定和分子生物学鉴定明确其分类地位,通过平板对峙法发现其对植物致病黄单胞菌Xanthomonas、欧文氏菌Erwinia和假单胞菌Pseudomonas等具有抑菌活性,最后选取番茄青枯病菌ZAFU0005通过盆栽试验验证其生物防治效果,为植物内生细菌的生物防治作用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 供试菌种及植物
供试菌株:ZN-S10分离自健康的番茄根部(杭州,萧山)。供试的病原细菌共5个,其中番茄细菌性髓部坏死病菌(Pseudomonasviridifiava)ZJUP0398-2、花椰菜细菌性软腐病菌(Erwiniacarotovora)ZJUP0154-1、李细菌性穿孔病菌(Xanthomonascampestris)ZJUP0463-1由浙江大学提供;甘薯茎腐病菌(Dickeyadadantii)ZAFU0898、 番茄青枯病菌(Ralstoniasolanacearum)ZAFU0005由本实验分离保存。
供试植株:黛安娜F1大粉果(河北茂华种业有限公司)。
1.1.2 主要试剂、培养基和引物
试剂:4S Green Plus无毒核酸染料、革兰氏染色液(试剂盒)、DNA分子量标准Marker(100~2 000 bp)、氢氧化钠AR(生工生物工程上海股份有限公司);GreenTaqMix酶(浙江尚亚生物技术有限公司);甲基红(杭州微生物试剂有限公司),肌醇(国药集团化学试剂有限公司),40%过氧化氢(西陇化工股份有限公司);3%中生菌素(WP)(福建凯立生物制品有限公司)。
培养基:NA培养基、LB培养基、TSBA培养基、甲基红测定培养基、V-P测定培养基和淀粉酶测定培养基等[21](生工生物工程上海股份有限公司)。
引物:16S rDNA(27F: 5′-AGAGTTTGATCMTGGCTCAG-3′/1492R: 5′-GGTTACCTTG TTACGACTT-3′);rpoB(F:5′-AGGTCAACTAGTTCAGTATGGAC-3′,R: 5′-AGGAACC GTAACCGGCAACTT-3′);gyrA(F:5′-GCGTCACGGCGRATCCTCAA-3′,R:5′-AAATC TGCCCGTATCGTCG-3′),由浙江尚亚生物技术有限公司合成。
1.2 菌株ZN-S10的鉴定
在30 ℃条件下NA 平板上培养24 h后观察菌株ZN-S10生长状况、菌落形态特征及菌体大小等[10]。菌株在TSBA培养基上培养后,提取脂肪酸,利用美国Aglient 6890 型气相色谱系统测定脂肪酸,鉴定结果通过与Sherlock 6.0 微生物鉴定系统的MIDI数据库对比后获得。参照文献[21]测定菌株的氧化酶、卵磷脂酶、过氧化氢酶、甲基红、抗生素抗性、吲哚等生理生化特征。取2.0 mL培养过夜的菌液,10 000 r·min-1离心1 min,用无菌水重悬并调节至D600=1.0的菌液作为DNA模板进行直接扩增,16S rDNA基因用细菌通用引物进行PCR扩增;rpoB基因和gyrA基因用上述设计的引物进行扩增[22]。PCR反应体系20 μL:GreenTaqMix酶10 μL,正向引物0.8 μL,反向引物0.8 μL,DNA模板0.8 μL,ddH2O 7.6 μL。扩增条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。将扩增产物送浙江尚亚生物技术有限公司测序。测序结果与GenBank数据库中的序列对比,并使用MEGA7.0,邻接法构建多基因进化树。
1.3 纸碟法测定ZN-S10对常见病原细菌的抑制作用
采用纸碟法测定菌株ZN-S10对番茄青枯病ZAFU0005等5种病害的病原细菌的抑制作用。在事先准备好的NA平板上分别涂100 μL浓度为1×106CFU·mL-1的病原细菌菌液,每个病原菌重复4次(涂4块板),在两侧各放入一片无菌的滤纸片(直径5 mm),然后在其中一片滴加10 μL ZN-S10菌液(1×106CFU·mL-1),将平板置于30 ℃培养箱中,避光培养48 h后观察抑菌圈大小。
1.4 ZN-S10防治番茄青枯病的盆栽试验
试验共设置4个处理,MOCK1(T1),清水;MOCK2(T2),接种番茄青枯病菌ZAFU0005(1×106CFU·mL-1);T3,3%中生菌素WP稀释600倍(50 mg·L-1)灌根;T4,ZN-S10稀释液(1×106CFU·mL-1)灌根。每个处理重复3次,每个重复4株番茄。
将番茄种子表面消毒后,播于无菌营养土中育苗(25 ℃,相对湿度 60%,光暗时间16 h∶8 h)。番茄长出2片真叶时,将其移栽至9 cm×9 cm盆钵(装有无菌营养土)中,移栽2 d后按试验设计进行灌根处理(ZN-S10、中生菌素或清水);7 d后,T2、T3和T4组的番茄苗,分别用灌根法接种番茄青枯病菌ZAFU0005(1×106CFU·mL-1),然后置于人工气候箱(30 ℃,相对湿度 80%,光暗时间16 h∶8 h)中培养,观察番茄植株发病率。至T2组全部植株发病(出现萎蔫)时停止试验(约移栽后15 d)。用病情指数来记录植株的发病状况并计算防效[23-24],病情指数设定为5级:0级,植株正常;1级,整株叶片≤25%枯萎;2级,整株叶片25%~≤50%枯萎;3级,整株叶片50%~≤75%枯萎;4级,整株叶片75%~整株枯萎或死亡。然后计算病情指数和防治效果。病情指数=∑[(各级病株数×相对级数值)]/调查总株数×最高级数值;防治效果=(对照病情指数-处理病情指数)/对照病情指数×100。
1.5 ZN-S10 对番茄抗性相关酶活性及丙二醛含量的影响
盆栽试验法测定ZN-S10对番茄抗病性的影响。以番茄青枯病为目标病害,将ZN-S10与番茄青枯病菌ZAFU0005接种按1.4节所述方法处理,编号分别为:MOCK,清水;T1,ZN-S10稀释液(1×106CFU·mL-1)灌根;T2,番茄青枯病菌ZAFU0005稀释液(1×106CFU·mL-1)灌根;T3,ZN-S10稀释液(1×106CFU·mL-1)灌根,7 d后,番茄青枯病菌ZAFU0005稀释液(1×106CFU·mL-1)灌根。分别在处理后3、5、7 d采集叶片进行检测。接种病原菌后,每个处理取适量植株,用试剂盒(上海生工生物工程公司)测定还原型谷胱甘肽(GSH)含量、丙二醛(MDA)含量和苯丙氨酸解氨酶(PAL)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)的活性。
2 结果与分析
2.1 ZN-S10菌株的鉴定
2.1.1 菌株的菌落形态和革兰氏染色结果
在NA平板上,30 ℃条件下培养24 h后ZN-S10的菌落形态特征及大小等如图1-A所示。单菌落形态呈现乳白色,边缘不规则,中间微凸,表面粗糙,具有黏性。在液体培养基中摇培生长后,静置一段时间,液体表面会产生一层白色的生物膜,与芽孢杆菌属的菌株相似。革兰氏染色结果表明,ZN-S10为革兰氏阳性菌(图1-B)。
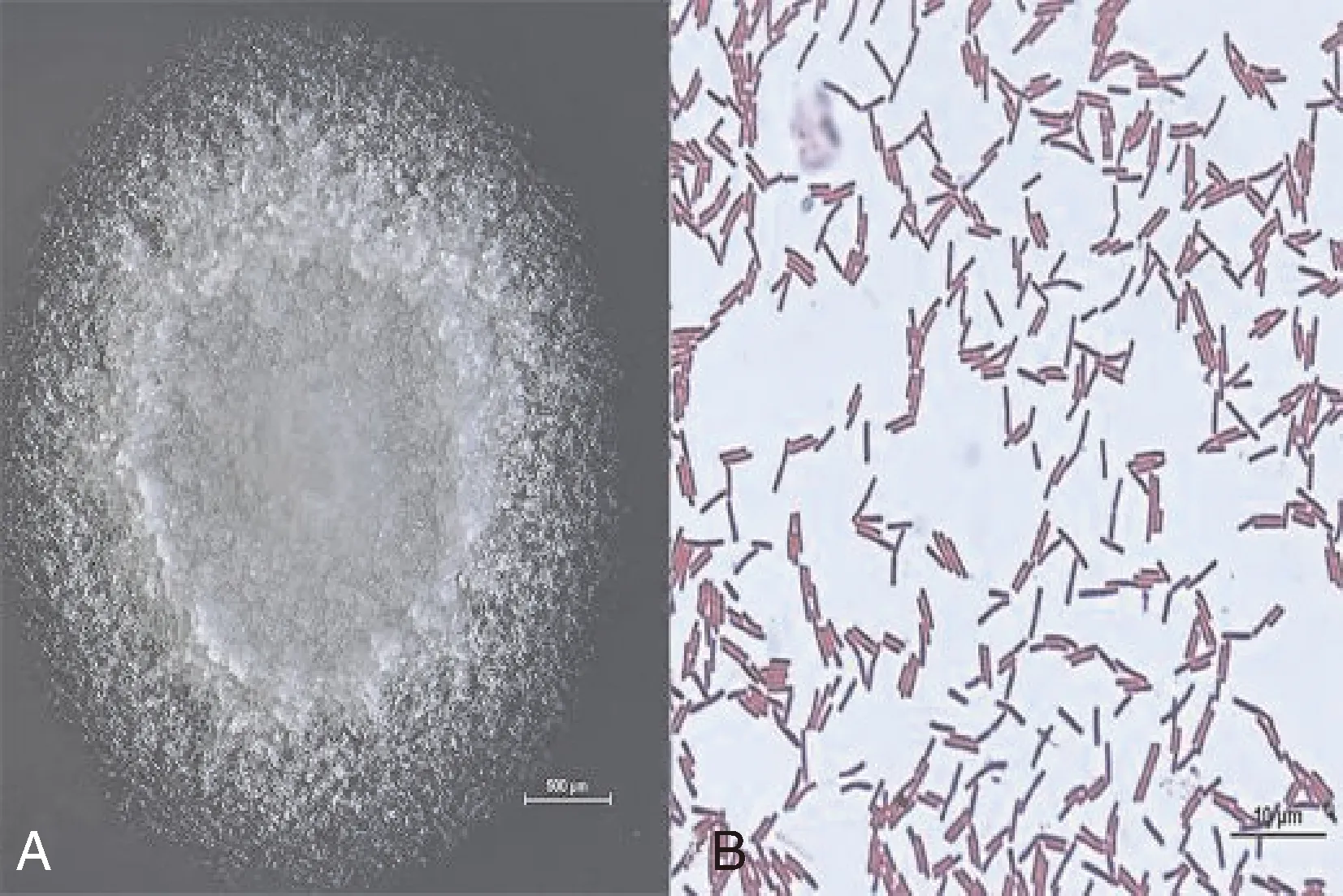
图1 ZN-S10菌株的菌落形态和革兰氏染色结果
2.1.2 脂肪酸测试
提取脂肪酸后对其进行测定,比对系统大数据发现,ZN-S10的主要脂肪酸包括iosC14:0(0.97%)、anteiso C15:0(45.88%)、iosC15:0(20.74%)、iosC16:0(2.08%)、C16:0(7.13%)、anteisoC17:0(11.44%),与MIDI数据库进行比对,结果显示,菌株ZN-S10与芽孢杆菌-GC亚组b的相似指数为0.598,与芽孢杆菌属的贝莱斯芽孢杆菌相似。
2.1.3 生理生化测试
ZN-S10 的生理生化鉴定结果见表1。检测结果显示:甲基红试验中,溶液呈黄色,即pH≥6.2,菌株生长过程中,没有产酸;V-P 反应为阴性,菌株生长的过程中不能产生丙酮酸脱羧酶。过氧化氢酶、淀粉水解、氧化酶、吲哚和卵磷脂酶均为阳性,卵磷脂酶和吲哚检测为阳性,说明ZN-S10不是枯草芽孢杆菌或解淀粉芽孢杆菌[21]。ZN-S10的生理生化结果与成娜娜[25]的鉴定结果基本一致,疑为贝莱斯芽孢杆菌。
2.1.4 分子生物学鉴定
经过16S rDNA测序,在GenBank上进行序列同源比对,初步表明ZN-S10与BacillusvelezensisSQR9(GCA_000685725.1)的同源性较好(100%)。进一步测定2对保守基因rpoB、gyrA序列,进行多重比对并构建双基因进化树后发现ZN-S10与贝莱斯芽孢杆菌SQR9的遗传距离最近,在同一分支上。结合形态学、脂肪酸测定、生化反应测定结果,确定菌株ZN-S10为贝莱斯芽孢杆菌(Bacillusvelezensis)(图2)。
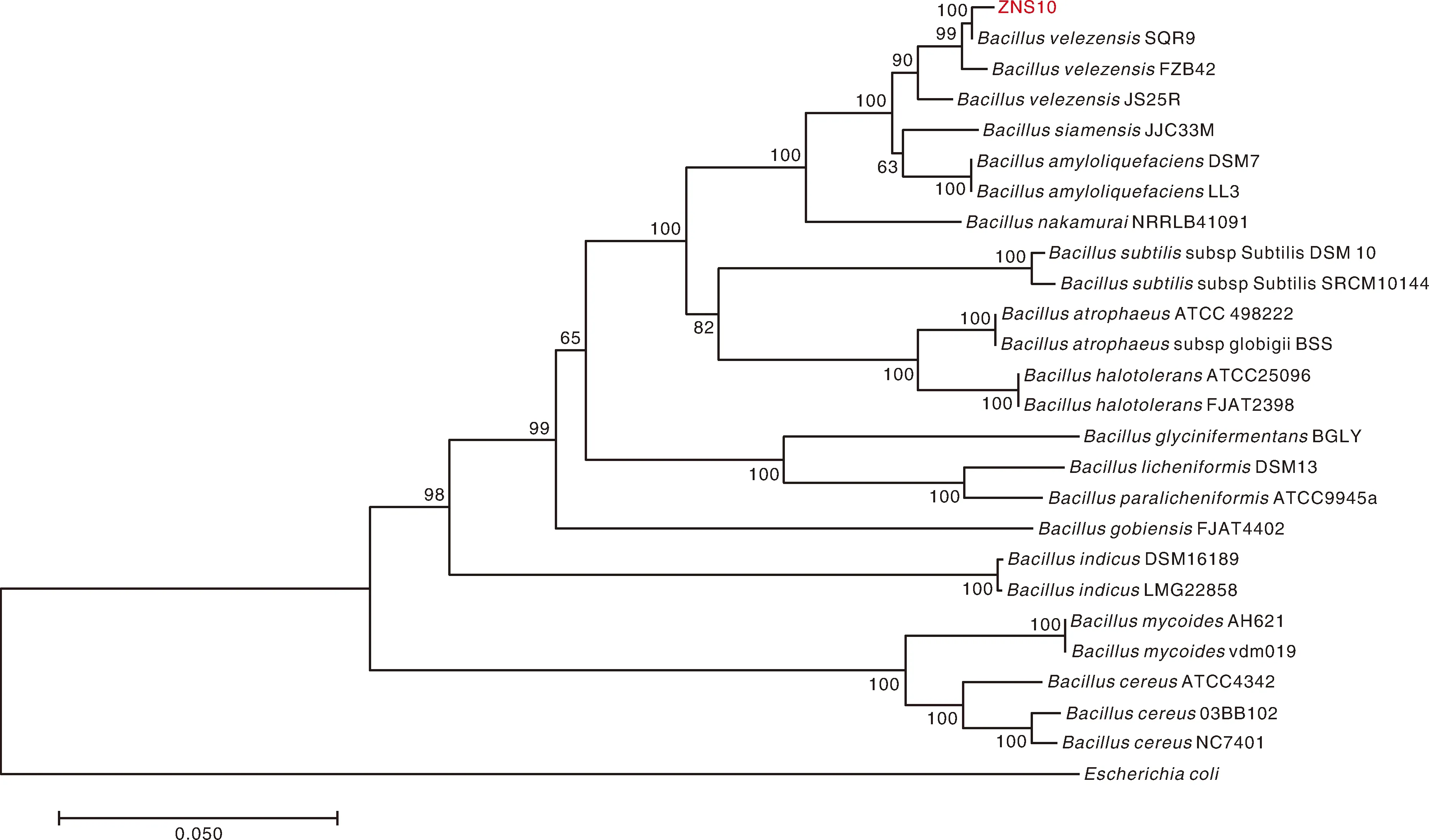
分支处的数值为Bootstrap法重复 1 000次评估得到的各节点支持率,标尺0.050为进化距离。
2.2 ZN-S10对不同植物病原细菌的拮抗作用
采用纸碟法,通过抑菌圈的大小来比较B.velezensisZN-10对5种病原细菌的抑菌活性,结果(图3)可见,ZN-S10对花椰菜细菌性软腐病菌ZJUP0154-1、番茄青枯病菌ZAFU0005有着比较明显的抑制效果,对其他3种病原细菌均有着不同程度的抑制活性(图4)。
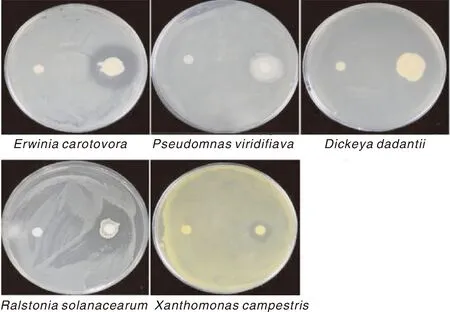
图中平板左侧滤纸片为CK,右侧为ZN-S10。从左到右依次为 花椰菜细菌性软腐病菌ZJUP0154-1、番茄细菌性髓部坏死病菌ZJUP0398-2、甘薯茎腐病菌ZAFU0898、番茄青枯病菌ZAFU0005、李细菌性穿孔病菌ZJUP0463-1。
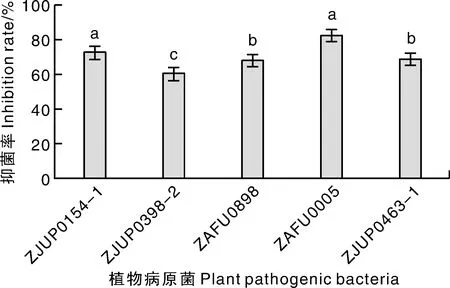
数据为平均值±标准误,柱上没有相同小写字母表示差异显著(P<0.05)。下同。
2.3 ZN-S10灌根对番茄青枯病的预防作用
试验结果表明,15 d后MOCK2组番茄植株全部发病时的病情指数为72.92%(表2),症状从叶片发黄到植物萎蔫并死亡(图5)。试验结果可知,3%中生菌素WP稀释600倍灌根处理(T3)后,对番茄青枯病的防治效果为57.14%; 1×106CFU·mL-1ZN-S10菌液灌根处理(T4)后,对青枯病的防治效果为57.14%(表2),两者对番茄青枯病的防治效果无显著差异(P<0.05),说明ZN-S10灌根处理对番茄青枯病有一定的防效。
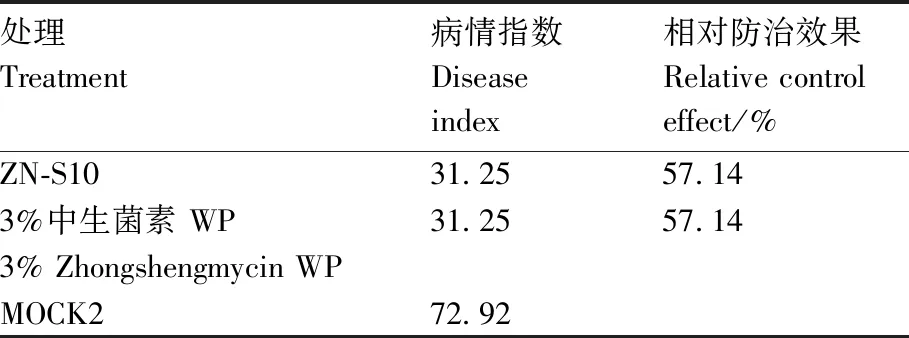
表2 Bacillus velezensis ZN-S10与3%中生菌素对番茄青枯病的防治效果

A, 清水;B,接种番茄青枯病菌ZAFU0005;C,3%中生菌素WP灌根7 d后接种番茄青枯病菌ZAFU0005;D,ZN-S10灌根7 d后接种番茄青枯病菌ZAFU0005。
2.4 ZN-S10和青枯病菌处理对番茄氧化应激系统的影响
外来物或菌物会刺激植物的氧化应激系统,细胞膜会因此受到损伤,植株体内的MDA含量会上升,MDA含量是指示细胞膜损伤程度的重要指标。根据图6可知,相比于CK,T2处理组的MDA含量显著升高,并且在第7天达到高峰;T3组在接种青枯菌的第3天含量显著高于CK、T1组,这时植物受到了青枯菌的侵染,表现出MDA含量快速上升,第7天与T2组相比含量显著下降。结果说明,ZN-S10灌根,可以在番茄遭受青枯菌侵染后,显著降低MDA浓度,减缓细胞膜的损伤或促进细胞膜修复。
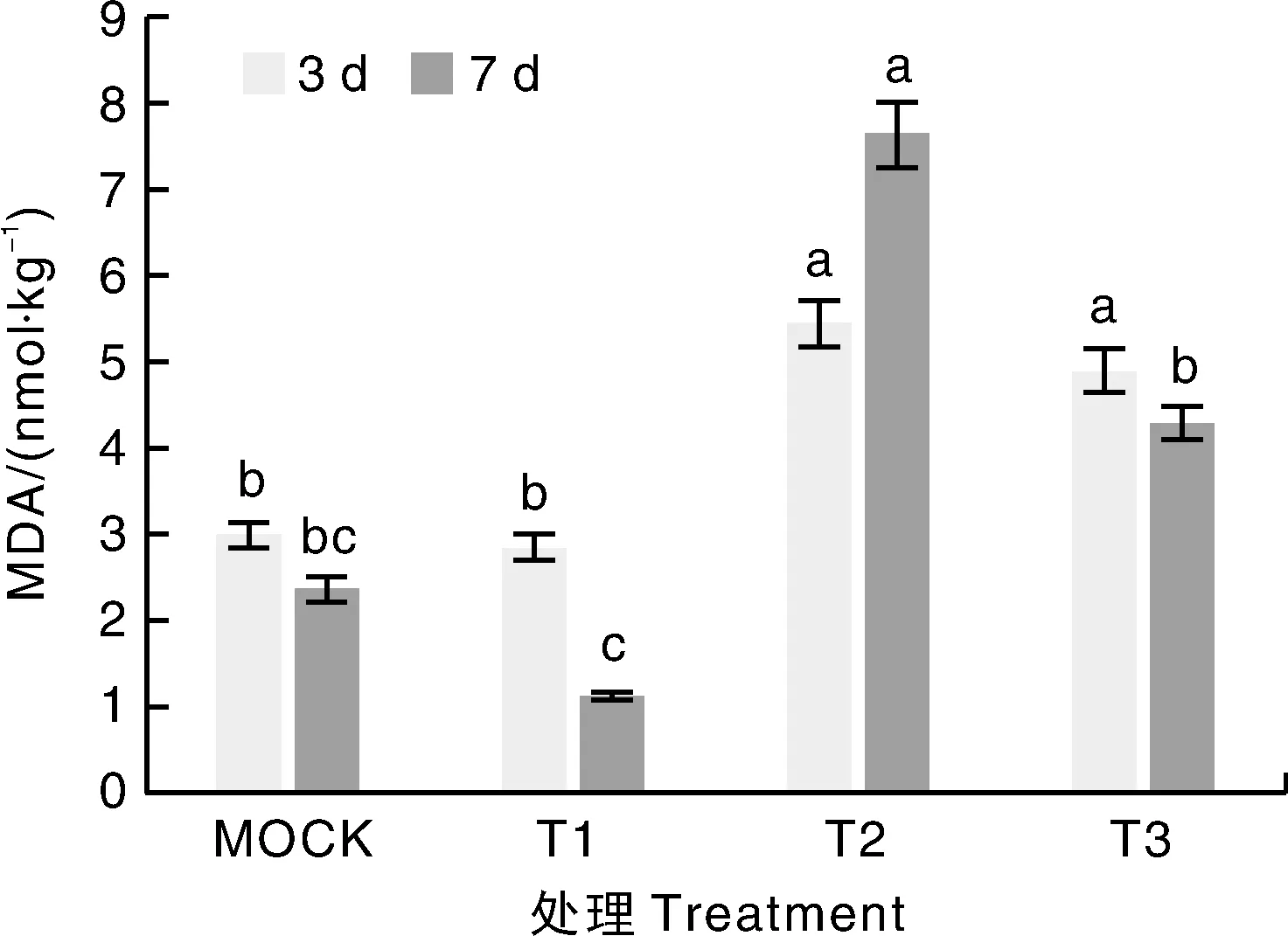
MOCK,清水;T1,ZN-S10;T2,ZAFU0005;T3,ZN-S10+ZAFU0005 。同一处理时间下不同处理间没有相同小写字母表示差异显著(P<0.05)。下同。
从图7中可以看出,CK组番茄的GSH含量在第3、5、7天都显著低于T1和T3,T1的含量显著高于CK和T2处理,在第7天,T1的GSH含量为148.8 μg·g-1,T3的GSH含量为144.9 μg·g-1,T2组的GSH含量则显著下降,只有76.34 μg·g-1,说明ZN-S10灌根后,刺激番茄的氧化应激系统,提高了番茄的GSH含量。CAT和POD的活性变化与GSH的含量变化趋势相似,T2和CK组先上升后下降又缓慢回升,但是幅度不大,第7天,T1组的CAT活性分别为同期CK和T2组的2.7倍和1.4倍,T3组的CAT活性分别为同期CK和T2组的3.3倍和1.72倍;T1组的POD活性分别为同期CK和T2组的1.67倍和1.45倍,T3组的POD活性分别为同期CK和T2组的1.79倍和1.56倍。由以上结果可知,ZN-S10灌根可提高番茄对青枯病的抗性。
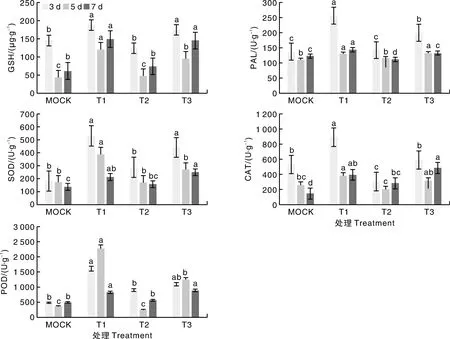
图7 番茄的GSH含量及PAL、SOD、CAT、POD活性的变化
3 讨论与结论
3.1 讨论
细菌是原核生物,其鉴定方法除形态学鉴定外,还要结合革兰氏染色、脂肪酸测定、生理生化反应,以及分子生物学手段。随着测序技术的进一步发展,通过测定细菌特有基因片段序列,为细菌的准确鉴定提供了更为便捷的方法。如利用16S rDNA、rpoA、rpoB、gyrA、gyrB等基因[26]。gyrA基因序列的变异可区分枯草芽孢杆菌组的成员[27]。本实验中,形态学鉴定、脂肪酸测定和生理生化测试结果表明,菌株ZN-S10为某种芽孢杆菌,但不能确定到种。通过测定ZN-S10菌株的16S rDNA,初步鉴定为贝莱斯芽孢杆菌,进一步测定rpoB、gyrA序列并联合建树,与菌株BacillusvelezensisSQR9分为同一支,遂将ZN-S10确定为贝莱斯芽孢杆菌。
贝莱斯芽孢杆菌是广泛存在于自然界中的芽孢杆菌属的一类生防细菌,具有良好的研究与应用前景[18,28-29],其对病原菌的生防机制主要是产生抗菌素、铁载体或影响生物膜形成[30]。据报道,贝莱斯芽孢杆菌HN-2产生的C15surfactin A[31]是一种脂肽化合物类的表面活性素,可以使白叶枯病原菌细胞壁穿孔和扭曲,从而有效防治水稻白叶枯病。B.velezensisZN-S10的平板试验结果显示,其对假单胞菌、欧文氏菌和黄单胞菌均有一定的抑制活性,出现明显的抑菌圈,可能是B.velezensisZN-S10在生长的过程中产生了类似surfactin A的次生代谢物。对番茄青枯病菌ZAFU0005和花椰菜细菌性软腐病ZJUP0154-1的抑制作用最明显。盆栽试验中,ZN-S10灌根处理后,番茄青枯病的病程发展明显减缓,青枯病的病情指数从对照的72.92%降低至31.25%(表2),表现出明显的防治效果。
当植物受到损伤或者外来物的侵入时会激活植物的诱导抗性,增强体内防御酶的活性,抑制病原菌的繁殖[32]。其中,氧化应激是植物体防御病原菌侵染的主要反应,氧化应激系统相关酶如SOD、CAT、PAL可以清除氧自由基,GSH参与机体衰老和自身免疫等作用[33],MDA含量是衡量细胞受损程度的主要指标。ZN-S10处理可显著降低因青枯菌侵染而升高的MDA含量,减少病菌对植物的伤害(图6),这可能与ZN-S10灌根处理显著提高番茄5种抗氧化酶活性(图7),减少氧自由基对机体的损伤,提高番茄植株对青枯病菌的损伤抗性有关。
3.2 结论
番茄中分离到的内生菌 ZN-S10是贝莱斯芽孢杆菌,灌根处理对番茄青枯病的防效约57.14%。其对番茄青枯病的防效可能与提高番茄5种抗氧化酶活性,产生抗菌素有关。此外,该菌株在平板拮抗的试验中表现出对黄单胞菌属、假单胞菌属、欧文氏菌属等属的多种致病细菌具有一定的抑制活性。
