饲粮中小麦颗粒用量对藏羊公羔瘤胃内环境的影响
2023-12-03桂林生
周 力,桂林生
(青海大学 农牧学院, 青海 西宁 810016)
饲料资源短缺是当今全球的突出问题之一,在粮食供给相对不足的背景下,饲料原料的价格涨幅较大[1]。青海并非玉米的主产区,当地饲料生产所需的玉米需从外地调入,增加了饲养成本。如何因地制宜寻找合适替代物用于畜禽生产,是缓解当地饲料资源短缺和提高养殖效益的重要途径。尽管小麦中的淀粉、亚油酸和能量水平低于玉米,但其蛋白质、钙、磷和部分氨基酸的含量却高于玉米[2]。小麦中含有较多的非淀粉多糖(non-starch polysaccharides, NSP),会抑制畜禽对营养物质的消化吸收。如何合理地使用小麦已成为当前动物饲料营养调控领域的研究热点之一,但关于小麦型饲粮对羊瘤胃内环境影响的研究还相对较少。
反刍动物拥有复杂的发酵系统,其瘤胃中含有大量的细菌、真菌、原生虫和古生菌等微生物[3],pH值、挥发性脂肪酸(volatile fatty acid, VFA)含量、氨态氮(NH3-N)含量,以及微生物蛋白(microbial proteins,MCP)产量等均是衡量瘤胃发酵功能的主要指标[4]。饲料中的碳水化合物、蛋白质、淀粉等营养物质会被瘤胃微生物分泌的分解酶降解为乙酸盐、丙酸盐和丁酸盐等物质,进而为宿主提供能量和氮源[5-6]。由此可见,瘤胃微生物对机体内环境稳定的维持至关重要[7]。瘤胃的免疫与抗氧化水平是衡量机体免疫能力和抗氧化功能的重要指标[8]。一旦反刍动物的瘤胃内环境失去平衡,便会引起机体抵抗力与免疫力的同步下降,同时可能诱发一系列的疾病[9]。所以,在生产实践中,可以考虑通过检测反刍动物瘤胃液的免疫与抗氧化能力来反映其内环境是否处于动态平衡中。
基于此,本试验拟以高原型藏羊为研究对象,通过分析小麦替代玉米对其瘤胃细菌菌群、发酵功能、消化酶活性、免疫机能和抗氧化特性的影响,为青海省饲料资源的开发利用提供基础数据。
1 材料与方法
1.1 试验设计
采用单因素试验设计,选用体重相近[(21.87±2.35) kg]、体况良好的90日龄高原型藏羊公羔90只,随机均分为3组,分别使用0(CPW)、10%(LPW)、15%(HPW)的小麦替代精料中的玉米。每个处理设置6个重复。整个试验周期105 d,包括预试期15 d和正试期90 d。
1.2 基础饲粮组成与饲养管理
基础饲粮由精料和粗饲料组成,参照NY/T 816—2004《肉羊饲养标准》进行设计。将各处理的饲粮组成与营养水平分别整理于表1、表2,其中,粗饲料由燕麦干草与燕麦青贮各占50%组成,精料为颗粒。将整个试验的正试期分为试验前期和后期:试验前期长30 d,饲粮由60%精料+40%粗饲料组成;试验后期长60 d,饲粮由70%精料+30%粗饲料。试验期间,各组羔羊的饲养管理条件一致,通风、干燥、卫生,每天饲喂两次(08:00和17:00各一次),自由饮水,自由采食,定时清扫羊舍,检查羊只健康状况,进行消毒与免疫。
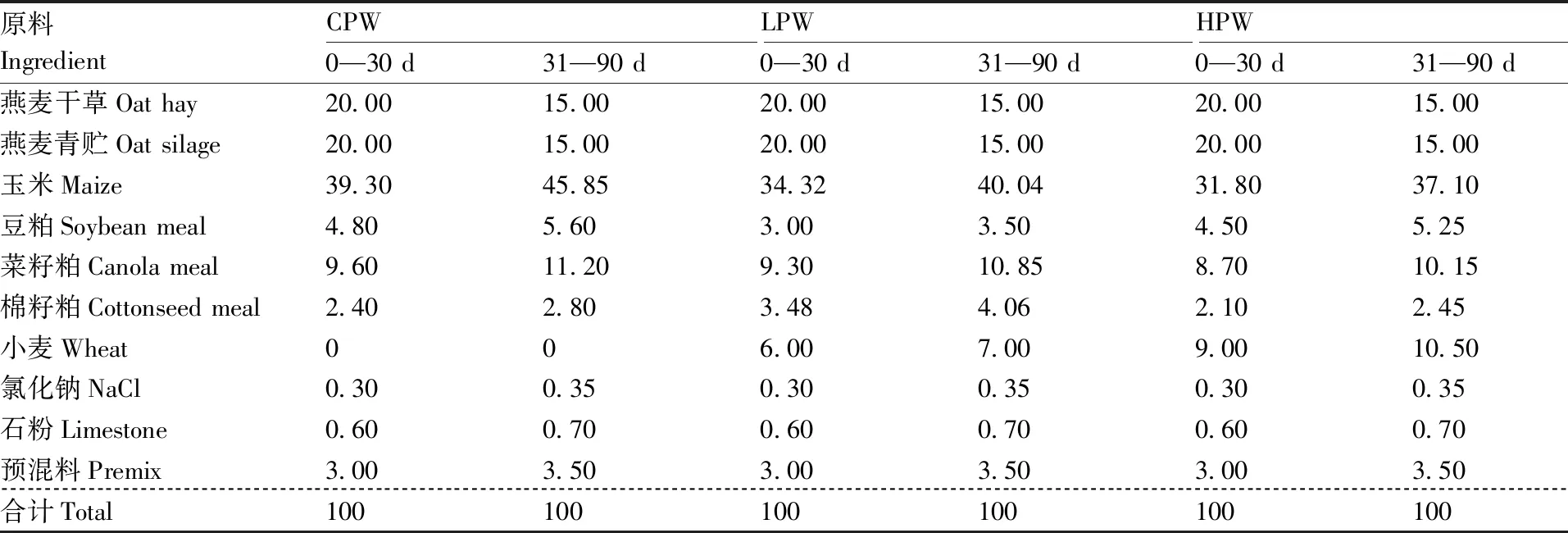
表1 基础饲粮的组成(以干重计)

表2 基础饲粮的营养水平(以干重计)
1.3 样品采集与制备
于正式期第90天(07:30)从每个重复中随机选择1只羊,每组选择6只羊进行颈静脉放血屠宰,并立即从瘤胃中采集20 mL内容物,经4层纱布过滤后,将滤液分装于1.5 mL无菌离心管中,置于液氮中速冻。
1.4 指标测定与方法
1.4.1 瘤胃发酵参数测定
现场将经过校准的PHS-3C型便携式pH计(上海坤诚科学仪器有限公司)直接插入羔羊瘤胃液中,待pH值稳定后再读数,每个样品重复测定5次,取其平均值。NH3-N含量参考冯宗慈等[10]的方法测定;VFA含量参照Liang等[11]的方法检测。
1.4.2 瘤胃消化酶活性测定
采用酶联免疫吸附测定(ELISA)检测瘤胃液中的α-淀粉酶、纤维素酶、糜蛋白酶、脂肪酶、胰蛋白酶活性,相应的试剂盒均购自江苏酶标生物科技有限公司,所用仪器为Varioskan LUX多功能酶标仪[赛默飞世尔(中国)科技有限公司]。
1.4.3 瘤胃免疫功能测定
采用ELISA检测瘤胃液中的免疫球蛋白A(IgA)、免疫球蛋白M(IgM)、免疫球蛋白G(IgG)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)含量,相应的试剂盒均购自北京华英生物技术研究所,所用仪器同样为多功能酶标仪。
1.4.4 瘤胃抗氧化功能测定
采用ELISA检测瘤胃液的总抗氧化能力、丙二醛(MDA)含量,以及过氧化氢酶(CAT)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性,相应的试剂盒均购自南京建成生物工程研究所有限公司,所用仪器同样为多功能酶标仪。
1.4.5 瘤胃菌群测序分析
在Illumina HiSeq测序平台上对采集到的瘤胃液进行细菌检测,具体由杭州联川生物技术股份有限公司完成。
1.5 数据分析
使用SPSS 25.0软件进行单因素方差分析(one-way ANOVA),对有显著(P<0.05)差异的,采用Duncan法进行多重比较。
2 结果与分析
2.1 饲粮中小麦颗粒用量对藏羊公羔瘤胃发酵特性的影响
各组藏羊瘤胃液的NH3-N、丙酸、异丁酸、异戊酸、戊酸含量,以及乙酸含量/丙酸含量、pH值均无显著差异(表3),CPW组藏羊瘤胃液的乙酸、丁酸含量显著高于HPW组,但与LPW组无显著差异。此外,HPW组的丁酸含量还显著低于LPW组。
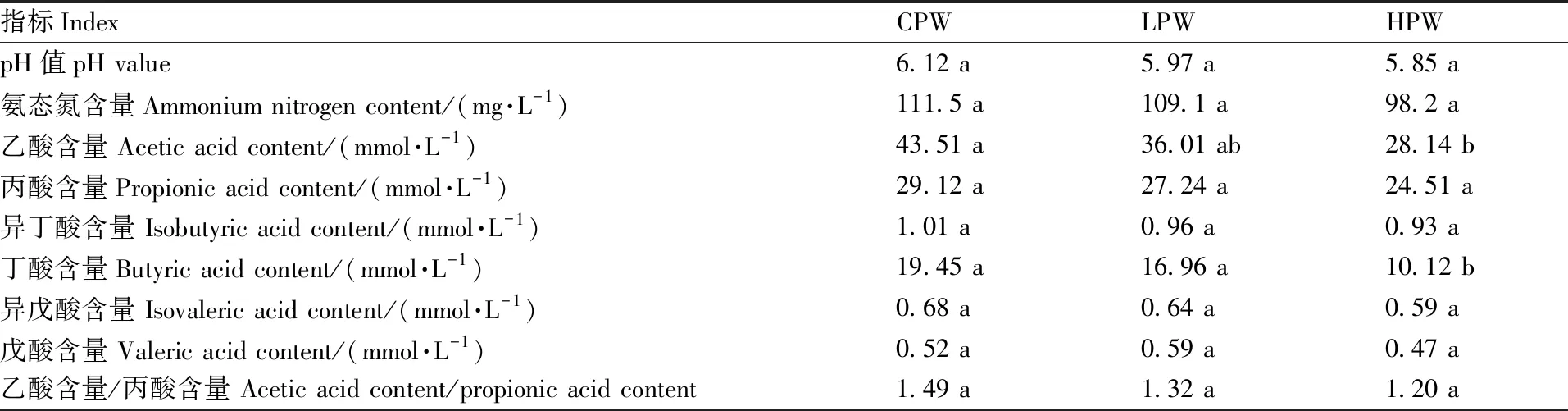
表3 各组藏羊瘤胃液的发酵特性
2.2 饲粮中小麦颗粒用量对藏羊公羔瘤胃消化酶活性的影响
CPW组藏羊瘤胃液的α-淀粉酶、糜蛋白酶、胰蛋白酶活性显著低于LPW组(表4),但二者均与HPW组差异不显著。CPW、HPW组藏羊瘤胃液的纤维素酶活性无显著差异,二者均显著低于LPW组。各组藏羊瘤胃液的脂肪酶活性差异不显著。
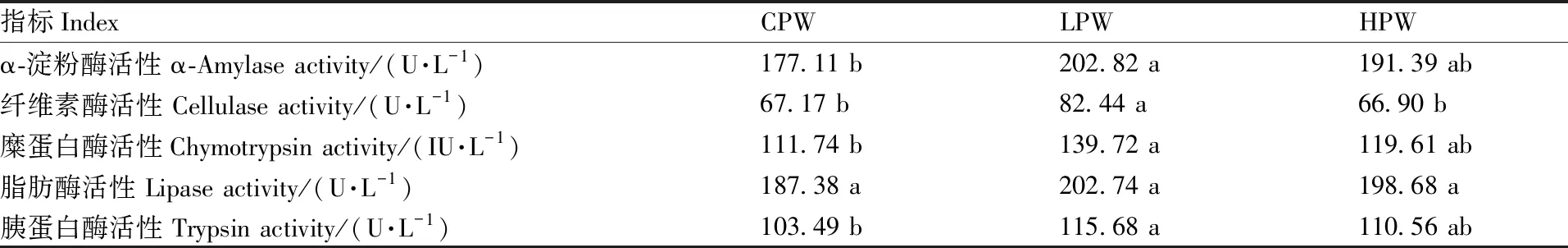
表4 各组藏羊瘤胃液的消化酶活性
2.3 饲粮中小麦颗粒用量对藏羊公羔瘤胃免疫机能的影响
LPW组藏羊瘤胃液的IgA、IgG含量显著高于其他2组(表5)。各组藏羊瘤胃液的IgM、IL-1β含量均无显著差异。LPW组藏羊瘤胃液的TNF-α含量显著低于CPW组,但二者均与HPW组差异不显著。
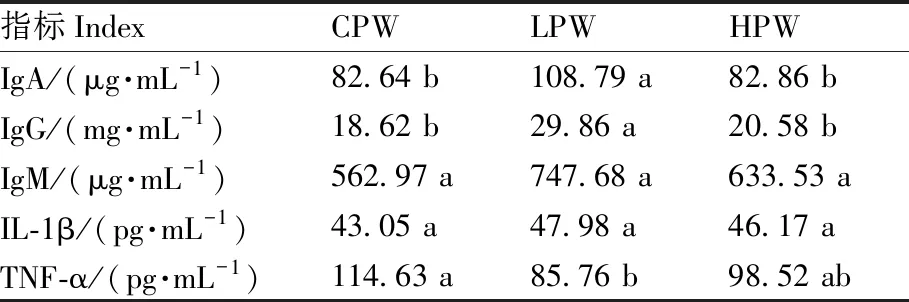
表5 各组藏羊瘤胃液的免疫功能
2.4 饲粮中小麦颗粒用量水平对藏羊公羔瘤胃抗氧化能力的影响
随着饲料中小麦颗粒用量的提高,藏羊瘤胃液的总抗氧化能力呈上升趋势,其中,CPW与HPW组差异显著(表6)。LPW组藏羊瘤胃液的CAT活性显著高于HPW,但二者与CPW组均无显著差异。各组藏羊瘤胃液的GSH-Px、SOD活性,以及MDA含量差异均无显著差异。
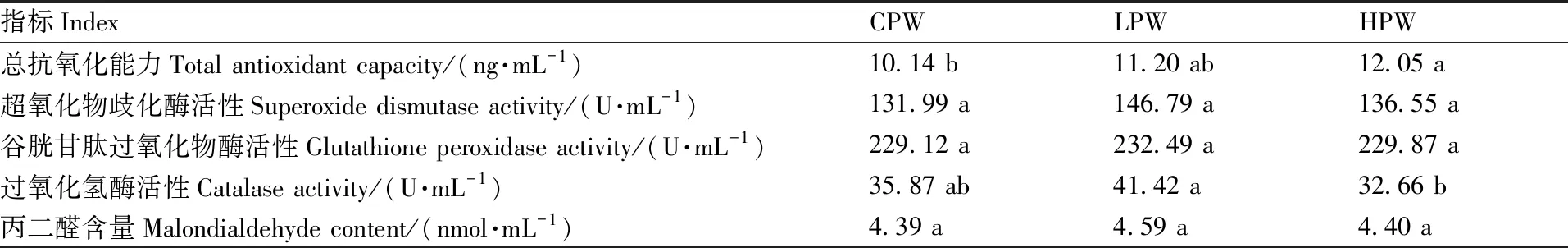
表6 各组藏羊瘤胃液的抗氧化功能
2.5 饲粮中小麦颗粒用量对藏羊公羔瘤胃菌群组成的影响
2.5.1 OTU聚类分析
各组样品的稀释曲线均较为平缓,说明测序量较为合理。基于相似性>97%的原则,将测序获得的有效序列归类成运算分类单元(OTU),共从瘤胃内容物中获得2 272个OTU(图1),其中CPW组有1 559个,LPW组有537个,HPW组有659个,3组共有的有102个,仅占总OTU的4.49%。
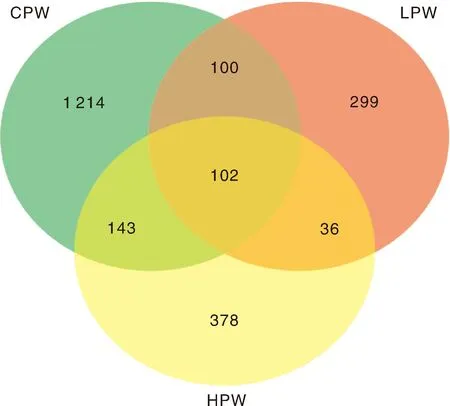
图1 各组样品的维恩图
2.5.2 细菌Alpha多样性分析
各组样本的覆盖率都在99%以上(表7),说明测序结果可较为全面地覆盖样本多样性。总的来看,各组藏羊瘤胃液的细菌Alpha多样性指数差异均不显著。
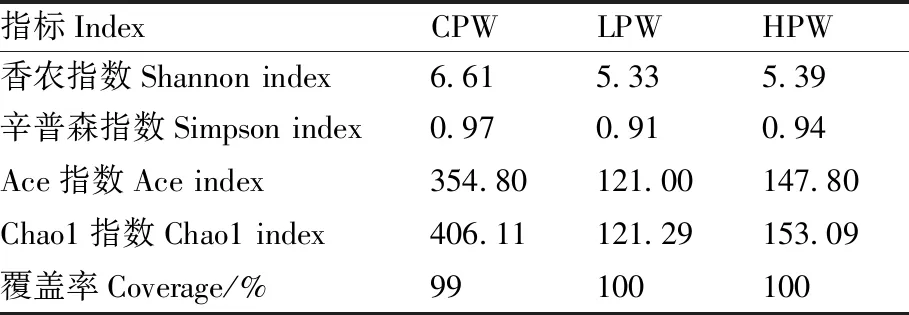
表7 各组藏羊瘤胃液的细菌Alpha多样性
2.5.3 细菌Beta多样性分析
对藏羊瘤胃液中的细菌开展主成分分析(PCA),主成分1(PCA1)和主成分2(PCA2)对样本组成差异的贡献值分别为17.83%和9.78%(图2),说明饲粮中的小麦颗粒用量对藏羊瘤胃内容物中微生物菌群组成的影响较小。对各组藏羊的瘤胃内容物进行非度量多维排列(NMDS)分析[胁强系数(stress)为0.09],结果进一步证明各组藏羊瘤胃内容物中细菌的差异较小。
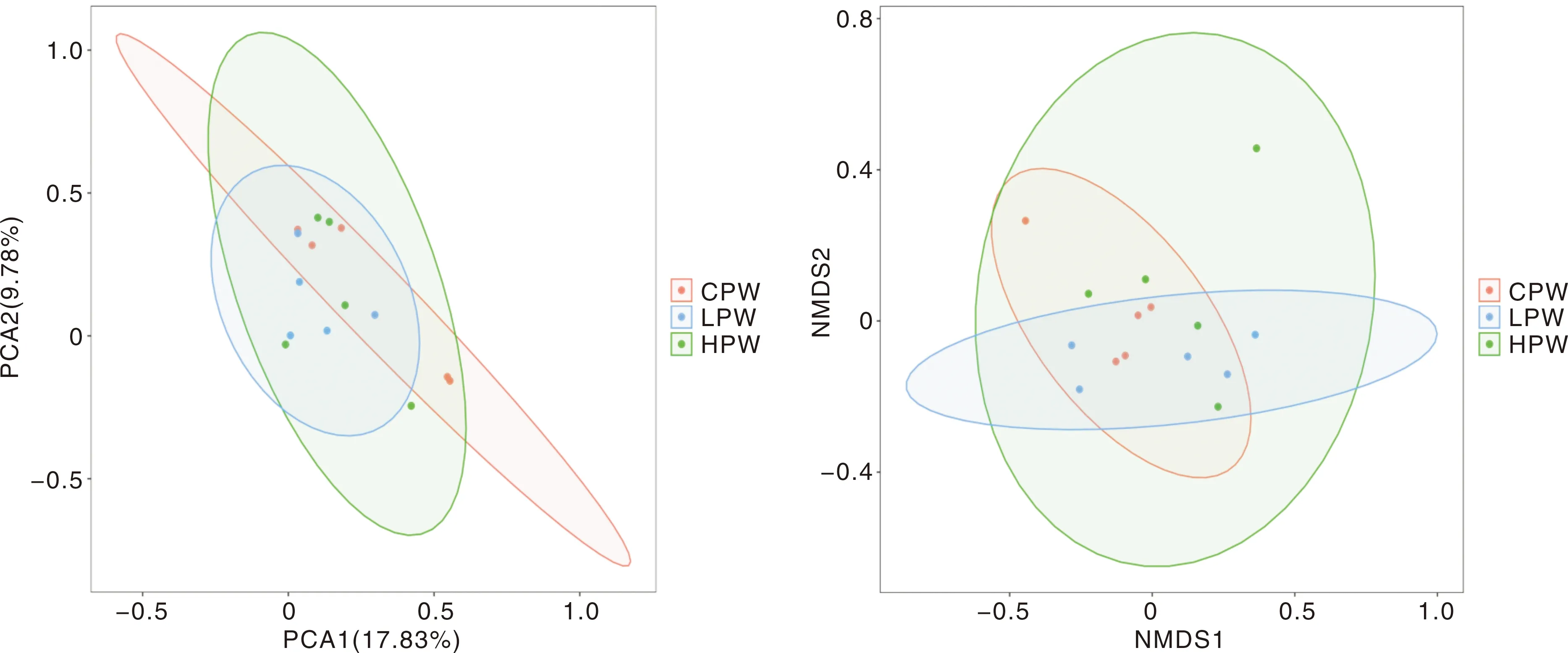
图2 各组藏羊瘤胃液的细菌Beta多样性分析
2.5.4 细菌门分类水平上的比较
本研究在门水平上共鉴定出21种菌门(图3),其中,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、髌骨细菌门(Patescibacteria)等为藏羊瘤胃中的优势菌门,分别占比61.53%、23.96%、7.74%、3.36%、1.16%。选取相对丰度排名前3的菌门在不同样本间进行对比,结果表明,不同组藏羊瘤胃中厚壁菌门、拟杆菌门、放线菌门的相对丰度差异不显著。
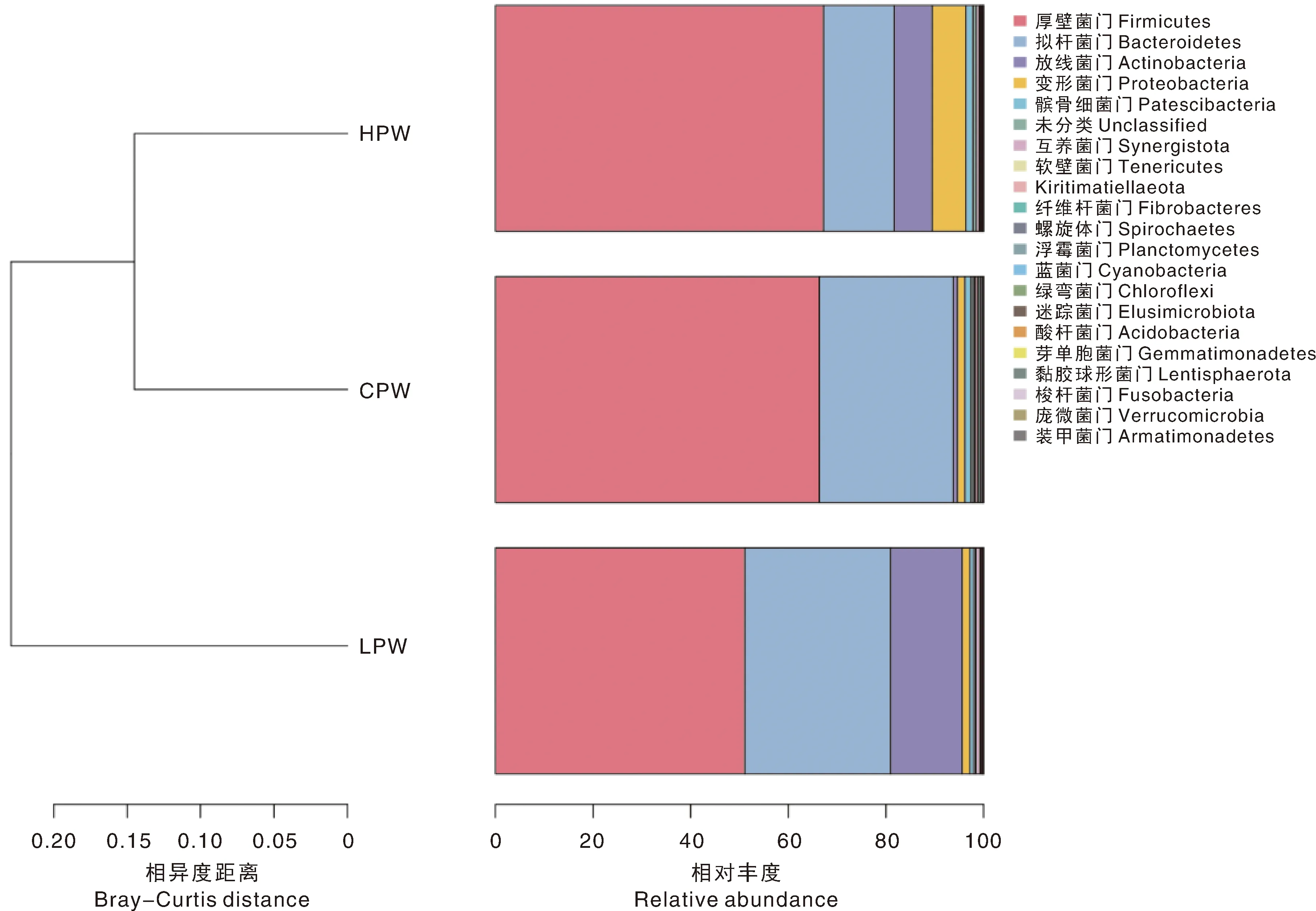
图3 各组藏羊瘤胃液细菌门水平上的相对丰度
2.5.5 细菌属分类水平上的比较
在属水平上,F082_未分类(F082_unclassified)、瘤胃球菌科_NK4A214_群(Ruminococcaceae_NK4A214_group)、琥珀酸菌属(Succiniclasticum)、Shuttleworthia、普雷沃氏菌属_1(Prevotella_1)等为藏羊瘤胃中的优势菌属(图4),分别占比6.78%、5.94、4.85%、4.58%、4.44%。选取相对丰度排名前3的菌属在不同样本间进行对比,结果表明,不同组藏羊瘤胃中F082_未分类、瘤胃球菌科NK4A214_属、琥珀酸菌属的相对丰度差异不显著。

图4 各组藏羊瘤胃液细菌属水平上的相对丰度
2.5.6 细菌功能预测比较
基于京都基因和基因组数据库(KEGG),利用PICRUSt 2.2.0b软件对测得的细菌进行KEGG水平上的功能预测(图5),各组藏羊瘤胃中的细菌主要富集于氨基酸代谢、辅因子与维生素代谢、翻译、糖生物合成与代谢、细胞生长与死亡等通路上,各组样本间无显著差异。
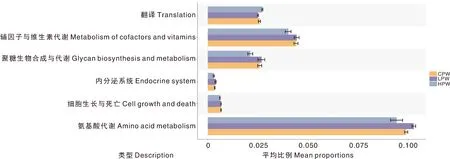
图5 各组藏羊瘤胃液细菌的功能注释
3 讨论
3.1 饲粮中小麦颗粒用量对藏羊公羔瘤胃发酵参数的影响
瘤胃发酵参数是衡量反刍动物瘤胃内环境稳定性的主要指标之一[12]。适宜的pH值可保证瘤胃中微生物的健康活动,正常情况下,瘤胃液的pH值维持在5.0~7.5[13]。本试验中,各组藏羊瘤胃液的pH值无显著差异,说明用本试验设定比例的小麦替代饲料中的玉米对藏羊瘤胃液的pH值无显著影响。瘤胃液中的NH3-N是瘤胃微生物生长的主要氮源[14]。据报道,反刍动物瘤胃液NH3-N含量的适宜范围为50~300 mg·L-1[15]。从本试验结果来看,各组藏羊瘤胃液的NH3-N含量均处于正常范围内,可满足微生物生长所需。碳水化合物发酵后所产生的挥发性脂肪酸可为反刍动物提供70%~80%的能量[16],是机体能量的主要来源[17]。挥发性脂肪酸的含量及其组成比例可评价反刍动物瘤胃的消化代谢情况,同时也是维持机体正常生长繁殖的关键因素[18]。本试验结果表明,CPW组藏羊瘤胃液的乙酸含量显著高于HPW组,且CPW与LPW组藏羊瘤胃液的丁酸含量均显著高于HPW组,意味着饲喂适宜比例的小麦饲粮有利于促进藏羊瘤胃内乙酸、丁酸的生成,继而增加挥发性脂肪酸的产量。
3.2 饲粮中小麦颗粒用量对藏羊公羔瘤胃消化酶活性的影响
消化酶可促进动物胃肠道中养分的分解与利用,从而提高其对饲料的利用效率[19]。目前,关于用不同比例的小麦替代玉米对藏羊瘤胃消化酶活性影响的研究较少。消化酶(如蛋白酶、脂肪酶和淀粉酶)主要负责水解膳食营养素,其活性与机体对养分的消化吸收紧密相关[20]。蛋白酶能够使蛋白质水解成小分子的氨基酸,α-淀粉酶主要消化碳水化合物[21]。本试验中,LPW组藏羊瘤胃液的糜蛋白酶、胰蛋白酶、α-淀粉酶活性显著高于CPW组,推测可能与动物的采食量有关。脂肪酶能水解多种含长链脂肪酸的甘油酯。本研究发现,各组藏羊瘤胃液的脂肪酶活性无显著差异。这可能是因为各组饲粮中提供的脂肪水平基本相同。饲料中的纤维素仅能通过纤维消化酶进行分解吸收[22]。本试验中,LPW组藏羊瘤胃液的纤维素酶活性显著高于其他2组,提示用适宜比例的小麦替代饲粮中的玉米可以增强高原型藏羊瘤胃液纤维素酶的活性。
3.3 饲粮中小麦颗粒用量对藏羊公羔瘤胃免疫机能的影响
免疫球蛋白是具有抗体活性的球蛋白,主要包括IgA、IgG和IgM[23]。其中,IgA是阻止病原体入侵机体的第1道防线;IgM作为动物感染初期最早产生的免疫球蛋白,溶解消除病原体的能力较强;而IgG具有激活补体、抗细菌与中和毒素的作用[24]。本试验中,LPW组瘤胃液的IgA、IgG含量显著高于其他2组,表明在饲料中用10%的小麦替代玉米可以促进羔羊瘤胃中免疫球蛋白,尤其是IgA、IgG的分泌合成,增强其免疫功能。细胞因子是由多种细胞经刺激后分泌的活性因子,具有调节机体免疫应答和参与炎症反应的作用。TNF-α、IL-1β均会对机体的免疫应答造成负面影响[25]。TNF-α由单核细胞/巨噬细胞释放,在炎症反应时主要参与机体免疫反应[26]。IL-1β是炎症的关键介质,具有促炎功能[27]。IL-1β含量的升高不仅会引起炎症反应,还会影响血糖含量,损害机体健康[28]。本研究中,各组瘤胃IL-1β含量差异不显著,说明掺杂不同比例小麦的饲料未对藏羊瘤胃造成免疫缺陷的不良影响。此外,本研究表明,CPW组藏羊瘤胃液的TNF-α含量显著高于LPW组。由此可见,使用10%的小麦替代玉米有利于进一步缓解藏羊瘤胃的炎症反应。
3.4 饲粮中小麦颗粒用量对藏羊公羔瘤胃抗氧化能力的影响
氧化应激一般被认为是引起动物疾病的主要原因,能够造成细胞、组织、器官的损伤[29]。总抗氯化能力、MDA含量,以及GSH-Px、SOD、CAT活性是衡量机体抗氧化水平的重要指标。其中,CAT、GSH-Px和SOD作为机体最主要的酶促抗氧化系统,构成了清除机体内自由基的第一道酶防御机制,可防止脂质过氧化物的生成[30]。从本试验结果来看,各组藏羊瘤胃液的GSH-Px、SOD活性差异不显著,HPW组藏羊瘤胃液的CAT活性显著低于LPW,但二者均与CPW组差异不显著。这说明,在饲粮中添加适宜比例的小麦有利于增强高原型藏羊瘤胃的抗氧化能力。总抗氧化能力是反映机体对外来刺激代偿能力的综合性指标[31]。本试验发现,随着饲粮中小麦添加比例的增加,藏羊瘤胃液的总抗氧化能力呈上升趋势,说明使用适宜比例的小麦替代玉米能够提高藏羊瘤胃的抗氧化能力。MDA是机体脂质过氧化的最终产物,其含量越高,表明机体受到的氧化损伤越严重[32]。本试验中,饲喂添加不同比例小麦的饲粮未对高原型藏羊瘤胃液的MDA含量产生显著影响,说明用小麦替代饲粮中的部分玉米不致对藏羊造成明显的脂质过氧化损伤。
3.5 饲粮中小麦颗粒用量对藏羊公羔瘤胃菌群的影响
覆盖率越高,表明样本中未被检测出的物种所占比例越低。本次测序各组的覆盖率均在99%以上,说明测序结果能够很好地反映藏羊瘤胃细菌群落的丰度与多样性。瘤胃细菌的组成和结构在维持内环境稳态、提高养分消化吸收、维持机体健康等方面都具有重要意义[33]。Alpha多样性可用来评估反刍动物瘤胃内细菌的多样性,其中,香农指数和辛普森指数可反映瘤胃细菌的均匀度和多样性[34]。一般地,香农指数越高、辛普森指数越低,代表样品中的细菌多样性越高。在本试验中,各组样品的香农指数与辛普森指数差异均不显著,表明添加不同比例小麦的饲粮对藏羊瘤胃细菌多样性的影响较小。Ace指数和Chao1指数越大,表示样品中的细菌丰度越高[35]。本研究中,各组样品的Ace指数和Chao1指数差异不显著,表明添加不同比例小麦的饲粮对高原型藏羊瘤胃细菌丰度的影响较小。韦玥瑞等[36]研究发现,不同饲粮类型对内蒙古绒山羊瘤胃液优势细菌的多样性和丰度无显著影响。赵娜等[37]发现,与对照组(青贮全株玉米)相比,试验组(青贮饲用油菜)白山羊瘤胃细菌的Alpha多样性指数差异不显著。
反刍动物瘤胃中,厚壁菌门与拟杆菌门的占比较高[38]。厚壁菌门含有许多纤维分解菌,能够将纤维降解为挥发性脂肪酸,从而为机体提供能量[39]。拟杆菌门具有分解植物多糖的能力,与非纤维多糖的降解关系密切[40]。杨硕等[41]的研究证实,拟杆菌门、厚壁菌门为大青山绒山羊瘤胃中的优势菌。本试验结果显示,藏羊瘤胃中厚壁菌门与放线菌门的相对丰度合计占85.49%。放线菌门中大部分为腐生菌,少数是寄生菌[42]。姜君等[43]研究表明,湖羊瘤胃中的主要细菌除了拟杆菌门、厚壁菌门和螺旋菌门外,还有放线菌门。本试验也得出同样的结论。琥珀酸菌属为本试验中各组瘤胃的优势菌属,与Van Gylswyk等[44]的研究结果一致。研究证实,碳水化合物代谢是反刍动物瘤胃中微生物代谢最丰富的途径,其次是辅因子和维生素代谢、氨基酸代谢等[45]。本试验同样发现,氨基酸代谢、辅因子与维生素代谢、翻译等为主要富集通路。
4 结论
使用10%的小麦替代精料中的玉米可明显提高藏羊公羔瘤胃的消化酶活性,增强其免疫机能,但对其细菌菌落结构、发酵功能影响较小。
