本土优选酿酒酵母高产生物量的半合成发酵培养基研究
2023-12-03罗亮王兴亚刘冠彤王辉焱王荣宋育阳秦义刘延琳
罗亮,王兴亚,刘冠彤,王辉焱,王荣,宋育阳,3,秦义,3*,刘延琳,3*
(1.西北农林科技大学葡萄酒学院,陕西杨凌 712100;2.宁夏贺兰山东麓产业技术协同创新中心,宁夏银川 750000;3.国家林业和草原局葡萄与葡萄酒工程技术研究中心/陕西省葡萄/酿酒酵母种质资源与葡萄酒风格创新引智基地,陕西杨凌 712100)
我国葡萄酒产业所需的酿酒酵母长期依赖进口,造成我国葡萄酒同质化问题严重[1-2]。为了酿造出具有中国风格的葡萄酒,本土酿酒酵母菌株的选育和高活性干粉制备是现阶段我国葡萄酒微生物学领域的重点研发方向。为了有效降低酵母菌培养成本,亟需开发高产生物量的适宜发酵培养基。
在实验室研究中,酵母菌的培养基碳源通常为葡萄糖,而氮源一般为酵母浸粉和蛋白胨等。但在工业发酵中,葡萄糖、酵母浸粉和蛋白胨作为碳、氮源加大了生产成本。糖蜜作为制糖工业的副产物,是最廉价的碳水化合物之一,含有大约50%的糖类,以及一些含氮物质、维生素和微量元素,可作为培养酵母的主要碳源[3-5]。De la Rosa等[6]研究表明,糖蜜作为微生物发酵培养的良好替代品,可降低生产成本。玉米浆是最廉价的氮源之一,含有约3.3%的可同化氮,富含粗蛋白质、有机酸、维生素和矿物元素,可以提供丰富的营养补充剂,促进发酵和微生物生长[7-8]。左莹等[9]研究表明,玉米浆可作为替代蛋白胨和酵母浸粉的氮源,能降低发酵成本。目前,玉米浆已应用于生物制药、氨基酸发酵和酶制剂等生产领域[10-11],有广阔的市场前景。
本土酿酒酵母菌株CEC D3-6筛选自宁夏贺兰山东麓葡萄酒地区,本团队对该菌株进行了多年的葡萄酒中试,其表现出了优异的葡萄酒酿造学特性,具有酿造‘赤霞珠’‘黑比诺’‘西拉’等优质葡萄酒的潜力,为“中国风土、国际品质”中国葡萄酒的风土表达和塑造提供了更多新型本土酿酒酵母菌株选择。为了进一步降低酿酒酵母菌株的生产成本,保障菌株干粉的高活性,本研究以本土优选酿酒酵母CEC D3-6为研究对象,以YPD培养基为基础,分别以甘蔗糖蜜和玉米浆作为培养基的碳源和氮源,采用单因素试验和响应面优化相结合的方法,优化了本土优选酿酒酵母菌株的半合成发酵培养基配方。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
酿酒酵母菌株(Saccharomyces cerevisiae)CEC D3-6,保藏于西北农林科技大学葡萄酒学院。
1.1.2 主要试剂
甘蔗糖蜜(生物试剂),广西糖业集团金光制糖有限公司生产,主要成分含量为:锤度75.16%、总糖48.24%、蔗糖35.5%、还原糖12.36%、胶体9.82%、酸度6.82%、灰分11.02%、总氮2.12%。
玉米浆(生物试剂),湖州天宏生物技术中心生产,主要成分含量为干物质72.50%、总蛋白质(以干基计)45.70%、氨基氮(以干品计)3.70%、总磷(以干基计)3.70%,pH 4.24。
糖、蔗糖、可溶性淀粉(分析纯),广东光华科技股份有限公司;酵母浸粉、蛋白胨(生物试剂),北京奥博星生物技术有限公司;尿素、硫酸铵、磷酸二氢钾、七水合硫酸镁、七水合硫酸锌、无水氯化钙(分析纯),四川西陇科学有限公司。
1.1.3 主要培养基
WL琼脂培养基参照薛军侠[12]的方法配制;YPD液体培养基参照张宸瑞[13]的方法配制。用3 mol·L-1NaOH溶液和3 mol·L-1H2SO4溶液调节母液pH;甘蔗糖蜜母液浓度300 g·L-1(以总糖计);玉米浆母液浓度400 g·L-1。
1.2 试验方法
1.2.1 菌株活化及种子液培养
取保藏于-80 ℃冰箱的酿酒酵母菌株CEC D3-6,用接种环挑取少量菌液于WL琼脂培养基中划线,将平板置于30 ℃恒温培养箱中培养36 h。
从WL平板上挑取一环单菌落接种于有100 mL YPD液体培养基的250 mL三角瓶中,于30 ℃、180 r·min-1的条件下培养18 h。
1.2.2 单因素试验
以下单因素试验均以无碳源的YPD液体培养基为对照,并在该基础培养基上进行。
最佳碳源筛选:在对照基础上,分别添加20 g·L-1的葡萄糖、蔗糖、果糖、甘蔗糖蜜和可溶性淀粉作为碳源,探究5种碳源对菌株生长的影响。
最佳氮源筛选:在对照基础上,分别添加20 g·L-1的酵母浸粉、蛋白胨、玉米浆、尿素和硫酸铵作为氮源,探究5种氮源对菌株生长的影响。
甘蔗糖蜜单因素:以对照为基础,用甘蔗糖蜜替换基础培养基中的碳源(葡萄糖),添加9个浓度梯度的糖蜜(以总糖计)20、40、60、80、100、120、140、160、180 g·L-1。
玉米浆单因素:以对照为基础,用玉米浆替换基础培养基中的氮源(蛋白胨、酵母浸粉),添加9个浓度梯度的玉米浆20、30、40、50、60、70、80、90、100 g·L-1。
无机盐单因素:以对照为基础,分别加入6个浓度梯度的磷酸二氢钾(0、2、4、6、8、10 g·L-1)、七水合硫酸镁(0、2、4、6、8、10 g·L-1)、七水合硫酸锌(0、0.1、0.2、0.3、0.4、0.5 g·L-1)和无水氯化钙(0、1、1.5、2、2.5、3 g·L-1)。
以上单因素试验的培养条件为:250 mL三角瓶装液量为100 mL,接种量2%,调节pH至5.5,灭菌温度及时间121℃、20 min,培养温度30 ℃,摇床转速180 r·min-1,培养时间18 h,测量菌体干质量,每组试验设置3个生物学重复。
1.2.3 Plackett-Burman试验设计
采用试验次数N=12的Plackett-Burman设计对影响酵母菌体干质量的6个因素甘蔗糖蜜(X1)、玉米浆(X2)、磷酸二氢钾(X3)、七水合硫酸镁(X4)、七水合硫酸锌(X5)、无水氯化钙(X6)进行探究,各代码所代表的因素及设计见表1。
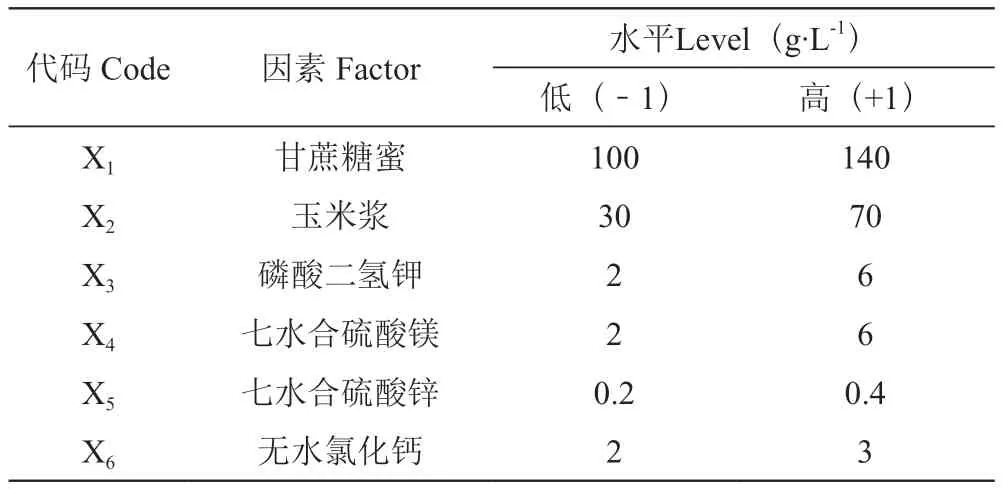
表1 Plackett-Burman试验设计的各因素水平Table1 Plackett-Burman test design of each factor level
1.2.4 最陡爬坡试验设计
根据Plackett-Burman试验结果,确定3个显著因子,根据因子的正负效应进行最陡爬坡试验的步长设计,以菌体干质量为响应值,菌体干质量最大的一组确定为中心点,随后进行下一步试验。
1.2.5 中心组合试验设计
通过Plackett-Burman试验以及最陡爬坡试验确定影响酿酒酵母菌体干质量显著的3个因素,得到响应区域的中心点,其中X1:-1、0、1分别代表95、100、105 g·L-1;X2:-1、0、1分别为25、30、35 g·L-1;X4:-1、0、1分别是2、4、6 g·L-1。然后利用Design-Expert 12软件进行Box-Behnken设计,以菌体干质量为考察指标,确定酿酒酵母CEC D3-6的最佳发酵培养基配方。
1.2.6 响应面验证试验
以YPD液体培养基为对照,在响应面预测所得最佳发酵培养基配方的基础上对酿酒酵母CEC D3-6进行培养,测量菌株生长曲线,以验证响应面预测结果。
1.3 指标测定
1.3.1 测定菌体浓度,得出菌株生长曲线
按照菌株的生长情况稀释样品,在600 nm处的吸光值(OD600)代表菌体浓度,菌体浓度=OD600×稀释倍数。根据菌体浓度绘制菌株生长曲线。
1.3.2 菌体干质量的测定
取4 mL菌液放入事先称重的4个5 mL的离心管中,离心机转速10 000 r·min-1离心5 min,蒸馏水洗涤3次,在105 ℃鼓风干燥箱中干燥至恒重,记录菌体干质量(Dry cell weight, DCW,g·L-1)。
1.3.3 总糖含量的测定
总糖含量的测定采用苯酚硫酸法[14]。
1.4 数据分析
采用Microsoft Excel 2019进行试验数据汇总,SPSS Statistics 21对数据进行单因素方差分析,并利用Duncan's多重比较在置信区间0.05内对数据进行显著性差异分析,采用Design-Expert 12软件进行响应面数据分析,采用GraphPad.Prism.7.00软件作图,每试验组设3个重复。
2 结果与分析
2.1 酿酒酵母菌株CEC D3-6生长曲线
菌株的生长曲线如图1所示,0~4 h处于生长迟缓期;4~16 h步入对数生长期,OD600急速增加;16~24 h进入生长稳定期,菌体浓度达到最大值10.05,24 h以后细胞进入衰亡期。根据菌株生长情况,确定菌株在培养16 h可用于接种。

图1 酿酒酵母CEC D3-6生长曲线Figure 1 Growth curve of Saccharomyces cerevisiae CEC D3-6
2.2 单因素试验结果
2.2.1 最佳碳源的确定
由图2A可知,在氮源等条件相同的情况下,不同碳源之间存在一定的差异,其中糖蜜对于菌体量的提升效果最为显著;淀粉提升情况最差,相较于葡萄糖在一定程度上抑制了菌体量的提升;蔗糖、果糖、糖蜜之间没有显著差异,但对比葡萄糖组都有所提升。碳源为甘蔗糖蜜时菌体干质量最高为3.58 g·L-1,且菌体生长较好。葡萄糖、蔗糖、果糖虽然对菌株生长较好,但会增加生产成本,因此,选择甘蔗糖蜜作为最佳碳源。
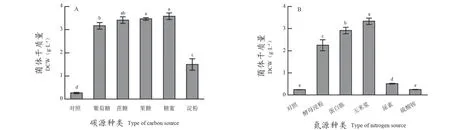
图2 不同种类的碳源(A)和氮源(B)对酿酒酵母CEC D3-6生物量的影响Figure 2 Effect of different carbon sources (A) and nitrogen source (B) on the biomass of Saccharomyces cerevisiae CEC D3-6
2.2.2 最佳氮源的确定
由图2B可知,不同氮源对酿酒酵母CEC D3-6菌体干质量的影响为玉米浆>蛋白胨>酵母浸粉>尿素>硫酸铵,玉米浆作为发酵培养基唯一氮源时,菌体干质量为3.33 g·L-1,生物量显著高于酵母浸粉等其它4种氮源,所以发酵培养基的氮源选择玉米浆。
2.2.3 糖蜜添加量对酿酒酵母生物量的影响
由图3A所示,随着糖蜜浓度的增加,菌体干质量呈现先升后降的趋势,当糖蜜添加量达到120 g·L-1时,生物量达到最大值8.5 g·L-1,后又逐渐下降。因此,糖蜜最适添加量为120 g·L-1。

图3 糖蜜(A)和玉米浆(B)添加量对酿酒酵母CEC D3-6生物量的影响Figure 3 Effects of molasses (A) and corn steep liquor (B) addition on the biomass of Saccharomyces cerevisiae CEC D3-6
2.2.4 玉米浆添加量对酿酒酵母生物量的影响
不同玉米浆添加量对酿酒酵母生物量的影响结果见图3B所示,玉米浆添加量为40~60 g·L-1时生物量没有显著变化,当玉米浆添加量为50 g·L-1时,此时生物量达到最大值,为3.75 g·L-1。因此,选择玉米浆最适添加量为50 g·L-1。
2.2.5 不同无机盐添加量对酿酒酵母生物量的影响
无机盐在微生物生长繁殖过程中有维持细胞内外渗透压、参与细胞代谢等功能[15]。由图4A可知,当KH2PO4为4 g·L-1时,菌株生长量最大,菌体干质量为3.76 g·L-1;由图4B可知,当MgSO4·7H2O为4 g·L-1时,菌株生长量最大,菌体干质量为3.64 g·L-1;由图4C可知,当ZnSO4·7H2O添加量为0.2 g·L-1时,菌株生长量最大,菌体干质量为3.47 g·L-1;由图4D可知,当CaCl2添加量为2.5 g·L-1,菌体生长量最大,菌体干质量为3.49 g·L-1。
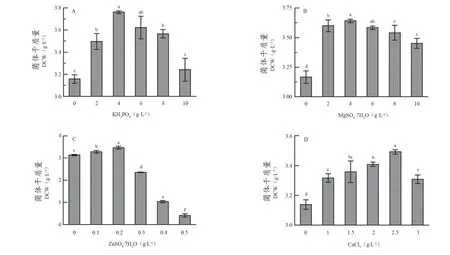
图4 不同无机盐添加量对酿酒酵母CEC D3-6生物量的影响Figure 4 Effects of different inorganic salt addition on the biomass of Saccharomyces cerevisiae CEC D3-6
2.3 Placket-Burman试验结果确定
以菌体干质量(X)作为响应值,采用Plackett-Burman中N=12的设计方法,运用Design-Expert 12软件进行试验设计及结果分析。其相应菌体干质量(X)及因素效应评价见表2。表2中,选择置信度大于95%较高的X1(甘蔗糖蜜)、X2(玉米浆)和X4(七水合硫酸镁)为显著影响因素进行下一步试验。

表2 PB试验设计及结果Table 2 PB Test Design and Results
2.4 最陡爬坡试验
根据Plackett-Burman试验筛选出的显著因素的效应大小设计其步长,进行最陡爬坡试验设计,寻找菌体浓度最大区域。最陡爬坡试验设计及结果见表3。由表3可知,最大菌体干质量9.15 g·L-1在试验3附近,故以试验3的条件为响应面试验因素水平的中心点。
2.5 响应面试验优化设计
试验以甘蔗糖蜜添加量(X1)、玉米添加量(X2)、七水合硫酸镁(X4)为自变量,以菌体干质量为响应值设计响应面优化试验,Box-Behnken试验设计及结果见表4,方差分析见表5。对表4试验结果进行分析,得到回归方程:

表4 响应面试验设计及结果Table 4 Design and results of response surface texts

表5 回归模型方差分析Table 5 Variance analysis of regression model
Y=8.84-0.0462X1+0.0437X2+0.0267X4-0.0417X1X2+0.0342X1X4+0.0175X2X4-0.2964X12-0.2397X22-0.0972X42
由表5可知,该回归方程模型p<0.0001,表示对结果影响极显著,失拟项P=0.7436>0.1证明该模型拟合较好,对本试验优化分析有意义;回归方程决定系数R2=0.9927>0.9,校正决定系数R2Adj=0.9834,说明模型相关性较好。变异系数(C.V.)0.3246%,说明模型方程可信度、精确度较好。该模型X1、X2、X12、X22、X42对结果影响极显著(P<0.01),X4、X1X2、X1X4对结果影响显著(P<0.05)。通过回归方程分析,得到最佳甘蔗糖蜜添加量X1、玉米浆添加量X2、七水合硫酸镁X4分别为102.49、30.30 、6.12 g·L-1时,菌体干质量的理论值为8.74 g·L-1。
响应面是响应值对试验因子所构成的三维空间曲面图,从响应面分析图上能清楚看出最佳条件及各参数之间的交互作用,响应面图形越陡峭,即其交互作用越明显,图形平稳则说明交互作用比较微弱。由图5、6和7可知,图形较为陡峭,说明所优化的因素有很强的交互作用,其中甘蔗糖蜜和玉米浆、甘蔗糖蜜和七水合硫酸镁交互作用相对较强,玉米浆和七水合硫酸镁交互作用相对较弱。
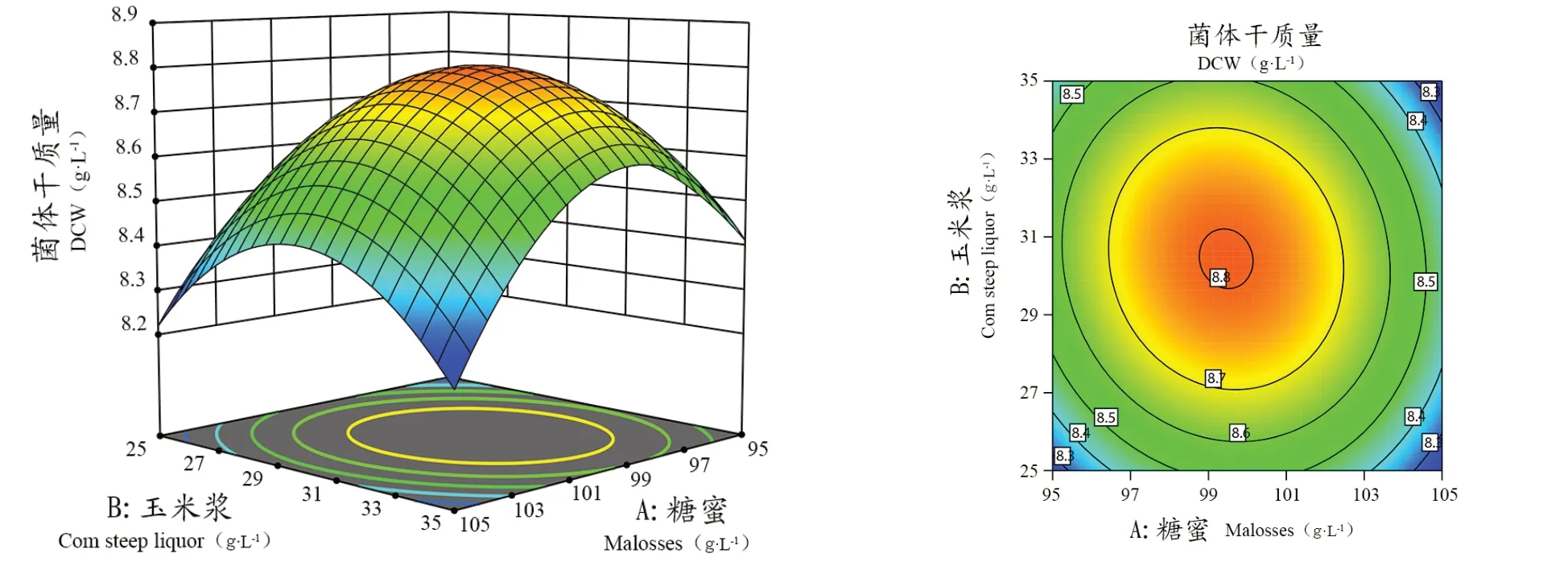
图5 糖蜜和玉米浆交互作用对酿酒酵母CEC D3-6菌体质量重的影响Figure 5 Effects of interaction between molasses and corn steep liquor on the dry cell weight of Saccharomyces cerevisiae CEC D3-6
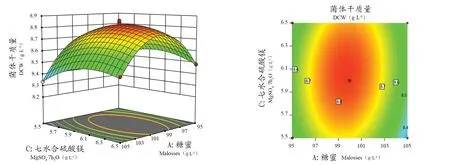
图6 糖蜜和七水合硫酸镁交互作用对酿酒酵母CEC D3-6菌体干质量的影响Figure 6 Effects of interaction between molasses and MgSO4·7H2O on the dry cell weight of Saccharomyces cerevisiae CEC D3-6

图7 七水合硫酸镁和玉米浆交互作用对酿酒酵母CEC D3-6菌体干质量的影响Figure 7 Effects of interaction between MgSO4·7H2O and corn steep liquor on the dry cell weight of Saccharomyces cerevisiae CEC D3-6
2.6 响应面试验结果的验证
由图8分析可知,使用优化培养基后,酵母在0~4 h为生长延滞期,生长延滞期较未优化前无明显变化;4~16 h为其对数生长期,16~48 h为菌体生长稳定期,而且稳定期的OD600显著提升。在优化培养基中培养20 h后,最大菌体浓度达到23.71,是优化前菌体浓度的3.06倍;最大菌体干质量达到8.37 g·L-1,是优化前的2.99倍,证明本试验提高了发酵效率。
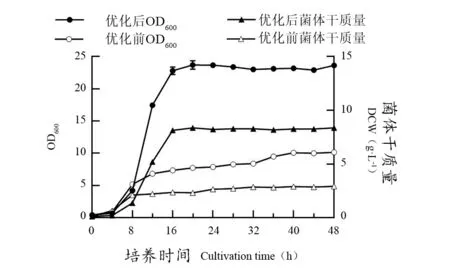
图8 酿酒酵母CEC D3-6的优化培养基与YPD液体培养基生长曲线对比Figure 8 Comparison of the growth curves of optimized medium and basal medium for Saccharomyces cerevisiae CEC D3-6
3 讨论与结论
微生物生长需要不断从外界摄取各种营养物质[16],甘蔗糖蜜和玉米浆中含有丰富的营养物质,被广泛应用于微生物的培养。陈雪等[17]在以甜菜糖蜜为碳源的试验中发现,在糖蜜添加量为8%的优化培养基中,酿酒酵母菌的干质量较优化前提高了23.3%。Vu等[18]研究表明,以9%(Vol)的糖蜜作为碳源进行单因素优化时,酿酒酵母KV-25的菌体干质量可达到4.4 g·L-1。向梦雄等[19]关于发酵培养基的优化试验表明,将玉米浆作为唯一氮源,可达到较好的试验目的。赵沁沁等[20]以33.90 g·L-1玉米浆作为氮源时发现,菌株的生物量显著提高了81.38%。Kitamura等[21]的研究以甘蔗糖蜜为唯一碳源对布拉氏酵母CCT 4308进行了优化培养,结果表明当甘蔗糖蜜最佳添加量为150 g·L-1时,培养48 h后生物量最大可达到9.89 g·L-1。这一结论与本研究结果相似。
本研究通过单因素试验确定了甘蔗糖蜜、玉米浆、磷酸二氢钾、七水合硫酸镁、七水合硫酸锌、无水氯化钙的临界值,然后利用响应面法进一步优化了培养基的组成,确定发酵培养基的最佳配方为:甘蔗糖蜜102.49 g·L-1、玉米浆30.30 g·L-1、七水合硫酸镁6.12 g·L-1、磷酸二氢钾4 g·L-1、七水合硫酸锌0.2 g·L-1、无水氯化钙2.5 g·L-1。利用该培养基,本土酿酒酵母CEC D3-6的菌体干质量可达到8.37 g·L-1,比在YPD液体培养基中培养提高了2.99倍。
本研究结果降低了本土酿酒酵母CEC D3-6的生产成本,为降低本土酿酒酵母高活性酵母干粉生产成本奠定了基础,有助于推动本土酿酒酵母对国外进口酵母的国产化替代。
