葡萄炭疽病病原菌的分离鉴定及防控药剂筛选
2023-12-03张新龙张国福杨素梅金岩张耀中范昆付丽
张新龙,张国福,杨素梅,金岩,张耀中,范昆,付丽*
(1.山东省阳谷县农业农村局,山东阳谷 252300;2.山东省农药检定所,山东济南 250131;3.山东省果树研究所,山东泰安 271000)
葡萄炭疽病又名晚腐病、苦腐病,主要危害果实,同时也危害穗轴、叶片、叶柄和新梢等部位。该病害是葡萄种植区内普遍存在的真菌性病害,多发生在果实近成熟期,严重影响果实品质和产量[1-2]。目前国内报道的葡萄炭疽病致病菌种大多为胶孢炭疽菌(Collectotrichum gloeosporioides)和尖孢炭疽菌(Colletotrichum acutatum)[3-7]。2015年Yan等[8]对北京、河北、河南和山东采集的34株葡萄炭疽病样本进行分离鉴定,又发现了葡萄炭疽菌(Colletotrichum viniferum)、隐秘刺盘孢(Colletotrichum aenigma)、果生刺盘孢(Colletotrichum fructicola)和Colletotrichum hebeiense,并指出葡萄炭疽菌(C.viniferum)是致病力较强的菌种,由该菌引起的病害发展速度快,是需要重点检测及防控的菌种。随后,刘梅等[9]在2018年发现,C.viniferum已经是北京地区葡萄炭疽病菌的优势菌种,分离率为90.3%。谭海芸等[10]对广西南宁的葡萄炭疽病病原菌进行鉴定发现,C.viniferum为主要致病菌种。许媛等[11]对江苏句容的葡萄炭疽病病原菌进行鉴定,C.viniferum的分离率为31.37%,且对苯并咪唑类杀菌剂产生中高抗性。因此,筛选C.viniferum的有效防治药剂迫在眉睫。
本研究选择戊唑醇、苯醚甲环唑、吡唑醚菌酯、咪鲜胺、二氰蒽醌、代森锰锌6种杀菌剂,通过测定其对C.viniferum菌丝生长的毒力,并在历年葡萄炭疽病发生严重的果园进行田间药剂防治试验,以期筛选防治葡萄炭疽病的高效杀菌剂。
1 材料与方法
1.1 供试材料及试剂
试验于2022年8月在山东省泰安市宁阳县蒋集镇石门庄彩山百果园(35°54′21″N,117°15′33″E)进行,葡萄品种为‘巨峰’‘红地球’‘夏黑’‘巨玫瑰’等,其中‘红地球’葡萄的炭疽病发病严重。本试验采集‘红地球’葡萄具有典型症状的病果进行菌种分离纯化。
培养基:PDA培养基(马铃薯200 g,葡萄糖20 g,琼脂18 g,水1000 mL)用于炭疽菌菌株的分离、保存及鉴定。
药剂及试剂:97%苯醚甲环唑原药、430 g·L-1戊唑醇悬浮剂,山东省联合农药工业有限公司;98%咪鲜胺锰盐原药、97%戊唑醇原药、90%代森锰锌原药,山东潍坊润丰化工股份有限公司;98%吡唑醚菌酯原药,山东海利尔化工有限公司;95%二氰蒽醌原药、22.7%二氰蒽醌悬浮剂,江西禾益化工股份有限公司;10%苯醚甲环唑水分散粒剂,山东富润实生物科技有限公司;450 g·L-1咪鲜胺水乳剂,山东禾宜生物科技有限公司;25%吡唑醚菌酯悬浮剂,山东胜邦绿野化学有限公司;80%代森锰锌可湿性粉剂,山东澳得利化工有限公司。
原药以丙酮溶解,制备成浓度为1×105mg·L-1的母液,于4 ℃保存备用。
主要仪器:人工气候箱(RXZ-380),宁波江南仪器厂;立式压力蒸汽灭菌器(YXQ-LB-100SII),上海博讯实业有限公司;光学显微镜(Axio Scope A1),蔡司光学;PCR仪(EppendorfMastercycler X50l),德国Eppendorf公司;琼脂糖水平凝胶电泳仪(DYCP-32C),北京六一仪器厂;凝胶成像分析系统(JS-2000),上海培清科技有限公司;16 L手动气压背负式农药喷雾器,山东省淄博华岳环保设备有限公司。
1.2 病原菌的分离纯化及形态鉴定
将病果洗净晾干,在超净工作台上用手术刀从病健交界处切取约0.5 cm2的组织块,75%乙醇消毒30 s后,再用1%次氯酸钠溶液消毒10 s,无菌水漂洗3次,最后用灭菌滤纸吸干多余水分,接种于PDA培养基中央,25 ℃恒温培养箱中倒置培养5 d,待菌丝长出后通过挑取菌丝尖端进行多次纯化。将各病原菌分离物的纯化菌株置于PDA培养基上,25 ℃条件下培养,7 d后观察在PDA培养基上的菌落形态、大小、色素分泌、产孢情况等性状,并挑取少许菌体在光学显微镜下观察分生孢子、分生孢子梗等的形态。将形态鉴定后的病原菌编号。
根据柯赫氏法则[12],用无菌水冲洗菌丝,配成孢子浓度约为1×105cfu·mL-1的悬浮液,用针刺法接种到健康的‘红地球’葡萄果粒上,以清水作对照。25 ℃条件下18 h光照6 h黑暗交替处理,湿度保持在90%下培养,5 d后调查发病情况。对发病果粒重新进行组织分离和单孢纯化,获得纯培养物并与原接种菌株进行比较。
1.3 分子生物学鉴定
采用CTAB法提取病原菌基因组DNA[9],以ITS通用引物(ITS1/ITS4)进行PCR扩增。PCR 扩增体系(25 μL):PCR mix 12.5 μL、上下游引物(10 μmol)各1 μL、DNA模板1 μL,加ddH2O 9.5 μL。PCR反应程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃延伸3 min。于4 ℃保存。PCR产物由生工生物工程(上海)股份有限公司测序。测序结果在DNAMAN软件中拼接后提交到GenBank进行比对,下载相关炭疽菌属菌株的相应序列,采用Clustal X对序列进行比对分析,并利用MEGA11.0软件中的邻接法构建系统发育树(NJ树),确定菌株的种类。
1.4 室内毒力测定
在预试验的基础上,对供试药剂母液进行梯度稀释。苯醚甲环唑、戊唑醇的试验终浓度为2.0、1.0、0.5、0.25、0.125 mg·L-1,吡唑醚菌酯、咪鲜胺试验终浓度为8.0、4.0、2.0、1.0、0.5 mg·L-1,二氰蒽醌试验终浓度为40.0、20.0、10.0、5.0、2.5 mg·L-1,代森锰锌试验终浓度为200.0、100.0、50.0、25.0、12.5 mg·L-1。
葡萄炭疽病菌的室内毒力测定采用生长速率法。取1 mL各浓度药液(50倍于终浓度)加入49 mL灭菌的50 ℃的PDA培养基中,摇匀后倾倒至直径9 cm的灭菌培养皿中,制成含药平板。在活化好的葡萄炭疽病菌菌落边缘,以直径7 mm的打孔器打取菌饼,菌丝面朝下接种至平板上。以无菌水代替药液为对照,每个平板为1个重复,每处理重复4次。25 ℃黑暗培养,待对照菌落长至培养皿2/3左右时,采用十字交叉法测量各处理菌落直径,计算各处理的菌丝生长抑制率。
1.5 田间防效试验
田间试验于2022年在山东省泰安市宁阳县蒋集镇石门庄彩山百果园‘红地球’葡萄上进行,树龄15年。于葡萄花后每隔10 d即5月23日、6月2日和6月12日进行喷雾施药,第3次药后当天完成果实套袋。根据各药剂在中国农药信息网上的标签信息确定施用浓度,施药液量以叶片、果面均匀着药、并稍有药液下滴为度,药液量约为1500 L·hm-2。每8株树为1个小区,每个处理重复4次,随机区组排列。
于果实近成熟期8月12日解袋调查发病情况。每小区随机选取不同部位果穗100个,调查记录每个果穗的总果粒数和病果粒数。
按下列公式计算药剂防效:
病果率(%)=(病果粒数/调查总果粒数)×100
防治效果(%)=(对照病果率-处理病果率)/对照病果率×100
1.6 数据分析
采用DPS软件进行数据统计分析,以药剂浓度对数作为横坐标,以抑制率转换为几率值作为纵坐标,求相关系数、毒力回归方程,从而计算各种供试药剂对病原菌的50%有效浓度(EC50)、95%最大有效浓度(EC95)及95%置信区间。采用Duncan's新复极差法进行处理间数据的差异显著性分析。
2 结果与分析
2.1 葡萄炭疽病病原菌分离及致病性测定
葡萄炭疽病菌在生长后期,果实着色成熟时发病,主要危害果实,也能侵染叶片、新梢、果梗等其他部位。发病最初在果面产生针头大小的褐色圆斑,病斑逐渐扩大并稍有凹陷,果肉变软腐烂,表面产生轮纹状排列的小黑点,为病原菌的分生孢子器。病害侵染后期,病斑中央有粉红色粘状物,即分生孢子团。发病严重时,病斑可扩展到整个果面乃至全穗。
从葡萄炭疽病果共分离得到36株真菌,去除葡萄白腐病菌、灰霉病菌、黑曲霉菌等非炭疽病菌,根据菌落形态、颜色、菌丝形态等特征,对其中形态相似的10株菌株编号(PTTJ 024-033),选取PTTJ 033进行后续试验,纯化后在PDA培养基平板生长的菌落形态如图1所示。菌落正面灰白色,呈棉絮状,背面淡橘黄色,气生菌丝致密,生长速度为5.5~6.8 mm·d-1。培养后期中央散生粉红色黏状分生孢子团,后期背面变黑色。分生孢子单孢、无色、圆柱形,有时具油球,大小为13.22 μm×4.68 μm(图2),根据形态学初步鉴定为C.viniferum。将纯化后的病原菌孢子液回接至‘红地球’葡萄果实上(图3),与原始症状相同。

图1 Colletotrichum viniferum在PDA平板上的形态学特征(PTTJ033)Figure 1 Morphological characteristics of Colletotrichum viniferum (PTTJ033) growing on PDA

图3 C.viniferum(PTTJ033)接种离体果实5 d后的发病情况Figure 3 Disease incidence within five days after vaccination of C.viniferum (PTTJ033)
2.2 葡萄炭疽病病原菌分子生物学鉴定
采用ITS通用引物ITS1/ITS4对PTTJ033菌株DNA进行PCR扩增,得到长度为565 bp的DNA序列。将其在NCBI数据库进行BLAST比对,发现其与葡萄炭疽菌(C.viniferum)同源性最高,采用C.karsti为外群,基于邻近法(NJ)对PTTJ033使用MEGA 11.0构建ITS序列系统发育树(图4),发现其与C.viniferum聚在一枝。

图4 基于rDNA-ITS序列采用邻近法构建代表菌株及其相似菌株的系统发育树Figure 4 The Neighbor-Joining polygenetic tree constructed by rDNA-ITS sequence
2.3 6种杀菌剂对葡萄炭疽病菌的毒力比较
试验结果得出,6种供试药剂对菌株均有一定的抑制作用,但敏感性存在差异。从药剂的EC50值来看,三唑类药剂戊唑醇、苯醚甲环唑的抑制作用最强,EC50值分别为0.1693、0.2780 mg·L-1;其次是咪鲜胺和吡唑醚菌酯的EC50值分别为0.7461、1.4123 mg·L-1;而二氰蒽醌和代森锰锌的敏感性相对较低,EC50值分别为6.1558、21.3142 mg·L-1(表1)。
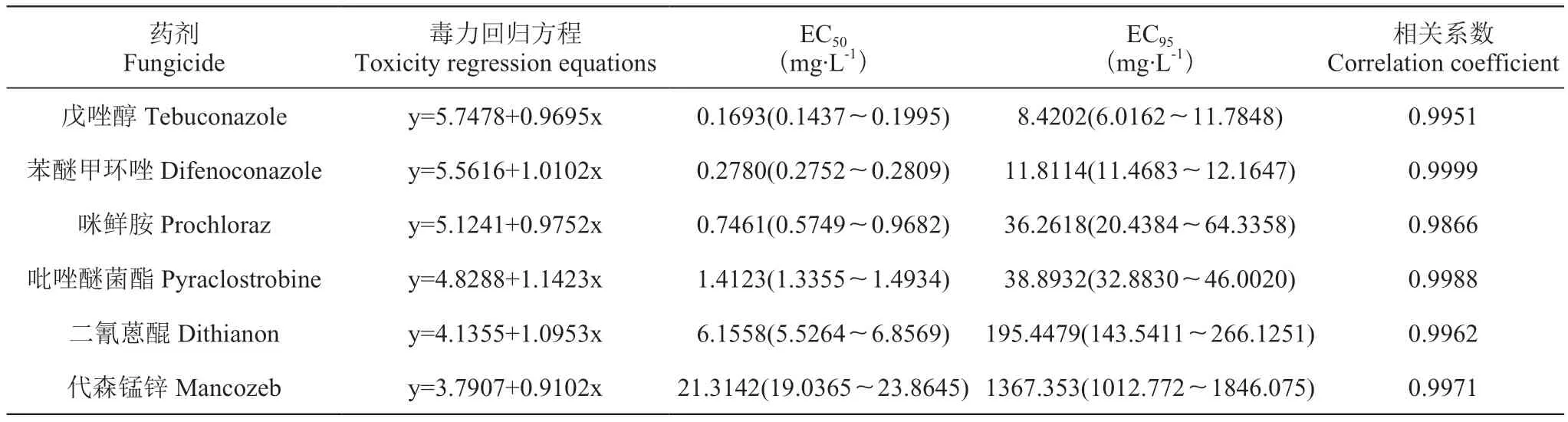
表1 6种杀菌剂对葡萄炭疽病菌菌丝生长的室内毒力Table 1 Indoor toxicity of six fungicides to Colletotrichum viniferum
2.4 6种杀菌剂对葡萄炭疽病的田间防效
进一步验证6种杀菌剂对葡萄炭疽病的田间防治效果。由表2可以看出,在试验浓度下,6种杀菌剂对葡萄炭疽病均表现出一定的田间防效,但药剂之间存在差异。430 g·L-1戊唑醇悬浮剂3000倍和10%苯醚甲环唑水分散粒剂600倍对葡萄炭疽病的防效位列前二,防效分别为81.16%和83.76%,显著优于其他4种杀菌剂;450 g·L-1咪鲜胺水乳剂1500倍和25%吡唑醚菌酯1500倍悬浮剂防效分别为77.38%和78.02%,显著优于22.7%二氰蒽醌悬浮剂800倍(73.55%)和80%代森锰锌可湿性粉剂600倍(71.25%)。22.7%二氰蒽醌悬浮剂800倍和80%代森锰锌可湿性粉剂600倍的防效显著低于其他4种杀菌剂。
3 讨论与结论
葡萄炭疽病是对葡萄危害较大的病害之一,严重影响了葡萄的产量和品质。本研究采集的PTTJ033菌种,根据形态学及与rDNA-ITS序列分析相结合,确定了引起宁阳县地区葡萄炭疽病的优势病原菌为C.viniferum,属于半知菌亚门腔孢纲黑盘孢科刺盘孢属的真菌。2011年,秦瑞凤[5]从陕西11个生产区的葡萄上首次分离到该菌种,Yan等[8]对北京、河北、河南和山东的多个葡萄炭疽病病原菌进行分离鉴定,发现了C.viniferum为葡萄炭疽病菌的致病菌,但菌种分离占比较低。近几年来,C.viniferum在北京、广西南宁、江苏句容等多个地区的葡萄炭疽病上被发现,菌种之间致病性差异较大,且强致病性菌株占比较大[9-11]。2022年,郝雨[13]选择了致病力强、产孢量大的C.viniferumcv YL2a进行葡萄与炭疽菌互作研究,并筛选出了较强的抗病资源。本研究中采集到的PTTJ033也具有较强的致病性,且分离比例较高,是宁阳地区葡萄炭疽病的主要致病菌,与以往报道的山东葡萄炭疽病主要致病菌种为C.gloeosporioides不同[14-15]。
为筛选防治该病菌的有效药剂,课题组选择6种杀菌剂对该病原菌进行了室内敏感性测定和大田药剂防治试验,发现大部分药剂对该病原菌有效,其中三唑类杀菌剂的防效显著优于其他药剂。孙行杰等[14]通过孢子萌发和菌丝生长抑制法试验得出,戊唑醇、吡唑醚菌酯、苯醚甲环唑等药剂对葡萄炭疽病菌C.gloeosporioides有较好的抑制作用。宗宇等[16]对C.gloeosporioides采用菌丝生长速率法测定了6种杀菌剂的室内防效,发现肟菌·戊唑醇抑制效果最好,苯醚甲环唑次之,嘧菌酯抑制效果最差。本试验结果与现有研究结果类似,也说明炭疽菌菌种之间防治药剂可以通用。但是,陈雷丽[17]指出,三唑类杀菌剂对炭疽菌易产生抗药性,且与丙环唑和咪鲜胺存在正交互抗性,生产中一定要注意使用频率。相较于本文研究结果,吡唑醚菌酯、二氢蒽醌、代森锰锌均可配合三唑类药剂轮流使用,以延缓抗药性的产生。
本文对宁阳县蒋集镇彩山百果园发病的葡萄炭疽病果实进行分离、纯化,得到炭疽菌属葡萄炭疽菌(C.viniferum),并确定为主要优势菌种。对生产上常用的6种杀菌剂进行室内药剂筛选和田间防治试验表明,三唑类药剂的杀菌效果显著优于其他药剂,但为了防止抗药性的产生,其他药剂也可配合轮流使用。相较于单剂的大田试验,下一步可以对复合杀菌剂的大田效果进行验证,避免单一药剂的过量使用,延缓抗药性的产生,为生产提供更多选择。
