T细胞在肺动脉高压发病中的作用
2023-12-02徐冲陈蕊周烨陈楠李波段俊颖夏浩袁伟
徐冲 陈蕊 周烨 陈楠 李波 段俊颖 夏浩 袁伟
肺动脉高压(PAH)是有高致死率的渐进性肺血管疾病,其特征为肺血管阻力增加和肺血管重构,进而引起右心衰。据统计,儿童PAH 的年发病率为4.8%~8.1%,特发性肺动脉高压(IPAH)为0.5%~0.9%[1]。在缺氧及炎症反应等因素刺激下,肺血管细胞过度增殖,导致肺血管重构[2-3]。不同的T 细胞亚群在PAH 中发挥不同作用,其相互作用促使炎症反应产生。充分了解T 细胞在PAH 中的作用,有助于寻求治疗PAH 的新靶点。
1 T细胞与PAH
根据细胞表型,T 细胞可分为CD4+、CD8+T细胞亚群[4]。在野百合碱诱导的PAH 动物模型中,肺动脉周围可见大量的T 细胞浸润,缺乏成熟T 细胞的无胸腺大鼠更容易发生PAH[5]。
CD4+T 细胞又称为辅助性T(Th)细胞,包括Th1、Th2、Th17 细胞等,能分泌一系列细胞因子,参与机体的免疫反应。Th1 和Th17 细胞可通过分泌白细胞介素(IL)-6 等,引起PAH 炎症反应。此外,Th17 细胞还可通过分泌IL-17A 促进大鼠PAH 进程,抑制Th17 细胞能显著减弱肺血管压力升高和重构[6]。研究表明,IPAH 患者外周血Th2 细胞比例升高,加剧了病情进展[7];阻断Th2 细胞上表达的趋化受体同源分子CD294 可抑制Th2 细胞活化以及IL-4、IL-13 的分泌,改善小鼠右室收缩压升高和肺血管重构[8]。
CD8+T 细胞也称为细胞毒T 细胞,主要通过其表面的T 细胞受体识别并结合主要组织相容性复合体抗原,从而激活并增殖分化为效应T 细胞,释放颗粒酶等杀伤靶细胞。研究发现,IPAH 患者外周血CD8+T 细胞减少,而肺组织中CD8+T 细胞异常增多;外周血中T 细胞亚群比例失调,具有细胞溶解活性的效应记忆性T 细胞比例增加,而幼稚CD8+T 细胞比例减少[9]。Edwards 等[10]进一步研究发现外周血CD8+T 细胞减少与PAH 患者死亡率增加独立相关。因此,CD8+T 细胞可能从血管腔迁移至肺组织,触发局部炎症反应,进而参与肺血管重构,但需进一步研究明确不同的CD8+T 细胞在肺血管重构中的作用及机制。
调节性T(Treg)细胞是一类具有免疫抑制功能的CD4+T 细胞亚群,负向调节机体的免疫反应。尽管有关PAH 患者外周血Treg 细胞数量变化的研究结果不一致,但是均提示Treg 细胞功能障碍引起的免疫失调是PAH 的重要特征。Treg 细胞与T 细胞亚群的比值改变,尤其是Th17 与Treg 细胞的比例失衡,即Treg 细胞减少和Th17 细胞增加,被认为是PAH 预后的关键生物标志物[11]。在结缔组织疾病相关的PAH 中,Th17 与Treg 细胞的比值越高,病情越重,预后越差[12]。Treg 细胞对女性PAH 患者的保护作用大于男性,这可能与雌激素介导Treg细胞活化有关[13]。
2 T细胞与肺血管细胞的相互作用
2.1 T细胞与肺动脉内皮细胞
肺动脉内皮细胞(PAEC)功能障碍通常被认为是导致PAH 的重要始动因素。在炎症反应刺激下,PAEC 可通过分泌趋化因子CX3CL1 将大量表达其受体的CX3CR1+白细胞募集至周围,尤其是T 细胞[14]。受损的PAEC 分泌的单核细胞趋化蛋白-1 增加,从而将CD4+T 细胞募集至肺血管周围并分泌IL-6 等促炎症因子[15]。Ye 等[16]发现低氧可下调PAEC 过氧化物酶增殖体激活受体-γ 辅助激活因子1,激活核因子κB,促进PAEC 分泌IL-6。IL-6 一方面可促进内皮-间充质转化,另一方面也能募集并活化中性粒细胞,造成内皮损伤[17]。在PAH患者中,PAEC 的糖酵解能力提高,从而引起乳酸堆积[18]。乳酸可使CD4+T 细胞聚集在PAEC 周围并分泌IL-17,促进CD4+T 细胞向Th 细胞分化,同时抑制CD8+T 细胞毒性[19]。此外,当PAEC 受损时,瘦素分泌增加,可上调Treg 细胞表面的瘦素受体,降低细胞磷酸化信号转导及转录激活蛋白(STAT)3水平,抑制Treg 细胞的功能[20]。Treg 细胞通过分泌IL-10,增加内皮一氧化氮合酶的磷酸化,抑制烟酰胺腺嘌呤二核苷酸磷酸氧化酶的活性,从而减少活性氧生成,调节血管内皮功能并抑制血管收缩[19]。Treg 细胞还能通过上调骨形成蛋白受体2表达,抑制内皮细胞凋亡和血管周围炎症反应[21]。总之,受损的PAEC 可抑制Treg 细胞功能,而Treg细胞通过修复受损的PAEC 和内皮完整性,改善PAH 的进程(见图1)。
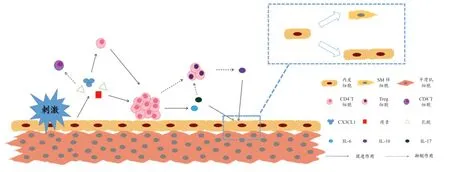
图1 PAEC受损时PAEC与T细胞之间的相互作用
2.2 T细胞与肺动脉平滑肌细胞
与PAEC 类似,在病理条件下,肺动脉平滑肌细胞(PASMC)表现出过度增殖和抗凋亡的特征,造成血管增厚。缺氧时PAEC 分泌CX3CL1 增多,诱导PASMC 表达CX3CR1,进而促进PASMC 增殖[22]。同时,Th2 细胞分泌IL-4 和IL-13,通过结合PASMC 自身受体(IL-4Rα 及IL-13Rα1)上调细胞内STAT6 磷酸化水平,促进PASMC 增殖[8]。相反,Treg 细胞通过分泌抗炎症因子IL-10 等,抑制炎症反应和PASMC 增殖[11]。此外,Treg 细胞也可下调PASMC 中蛋白激酶B 和细胞外调节蛋白激酶磷酸化水平,降低低氧诱导的细胞周期蛋白D1 和细胞周期蛋白依赖性激酶的表达水平,上调p27 水平,使细胞周期阻滞于G0/G1期,进而抑制PASMC 增殖[23]。PAH 大鼠模型外周血Treg细胞数量显著减少,并伴随Th17 细胞的增加,抑制 RhoA/Rho 激酶信号通路可逆转异常的Treg 与Th17 细胞的比值,从而抑制PASMC 过度增殖和肥大[24]。
2.3 T细胞与肺动脉外膜成纤维细胞
肺动脉外膜成纤维细胞(PAAF)可活化肌成纤维细胞,一方面分泌细胞因子,促进PASMC 增殖和收缩,另一方面分泌胶原蛋白和其他细胞外基质蛋白,造成肺血管纤维化。CD4+T 细胞可分泌IL-6,促进PAEC 的内皮-间充质转化,进而增加肌成纤维细胞数量[17],而Treg 细胞可以通过调节巨噬细胞活性影响PAAF 增殖[2]。在Treg 细胞缺乏的情况下,巨噬细胞会过度表达白三烯B4,上调烟酰胺腺嘌呤二核苷酸氧化酶和p38 丝裂原活化蛋白激酶,促进PAAF 增殖,加速肺血管纤维化[25]。
3 T细胞与右心室细胞的相互作用
随着肺动脉压力的增加,右心室会发生缺血、纤维化、代谢紊乱及运动水平的改变,从而引起右心衰。虽然目前没有直接的证据表明T 细胞对PAH 患者右心室细胞有直接作用,但Tamosiuniene等[13]发现在Treg 细胞与人心脏微血管内皮细胞共培养时,环氧酶2 等表达增多,这有助于抑制PAH进展。此外,Th2 细胞介导的炎症反应能加重右室肥大,Treg 细胞功能失调会促进缺血性心肌病中的心肌纤维化[26]。
4 T细胞与其他免疫细胞的相互作用
在PAH 动物模型中,IL-6 升高会诱导Th17细胞在肺组织中积聚并分泌IL-21,促进巨噬细胞的肺组织归巢及向M2 型极化,进而促进Th 细胞和中性粒细胞激活并分泌白三烯B4,加重局部炎症反应[2]。同时,肺血管内的巨噬细胞表达血小板反应蛋白-1 增多,从而激活Rho 激酶,引起血管收缩[27]。PAH 患者外周血单核细胞衍生树突状细胞(MoDC)通过高表达的p40 亚基(IL-12 和IL-23共享的亚单位),下调IL-4 和上调IL-17 水平,促进CD4+T 细胞向Th17 细胞分化[28]。经地塞米松处理后,MoDC 可表达更高水平的T 细胞活化分子CD86 和CD40[29]。相反,Treg 细胞可通过抑制CD4+T 细胞、CD8+T 细胞、自然杀伤细胞、抗原呈递细胞(包括树突状细胞、巨噬细胞和B 细胞)等多种免疫细胞,维持肺血管免疫稳态。总之,T细胞与其他免疫细胞形成复杂的相互作用网络,共同调节肺血管中促炎以及抗炎过程(见图2)。
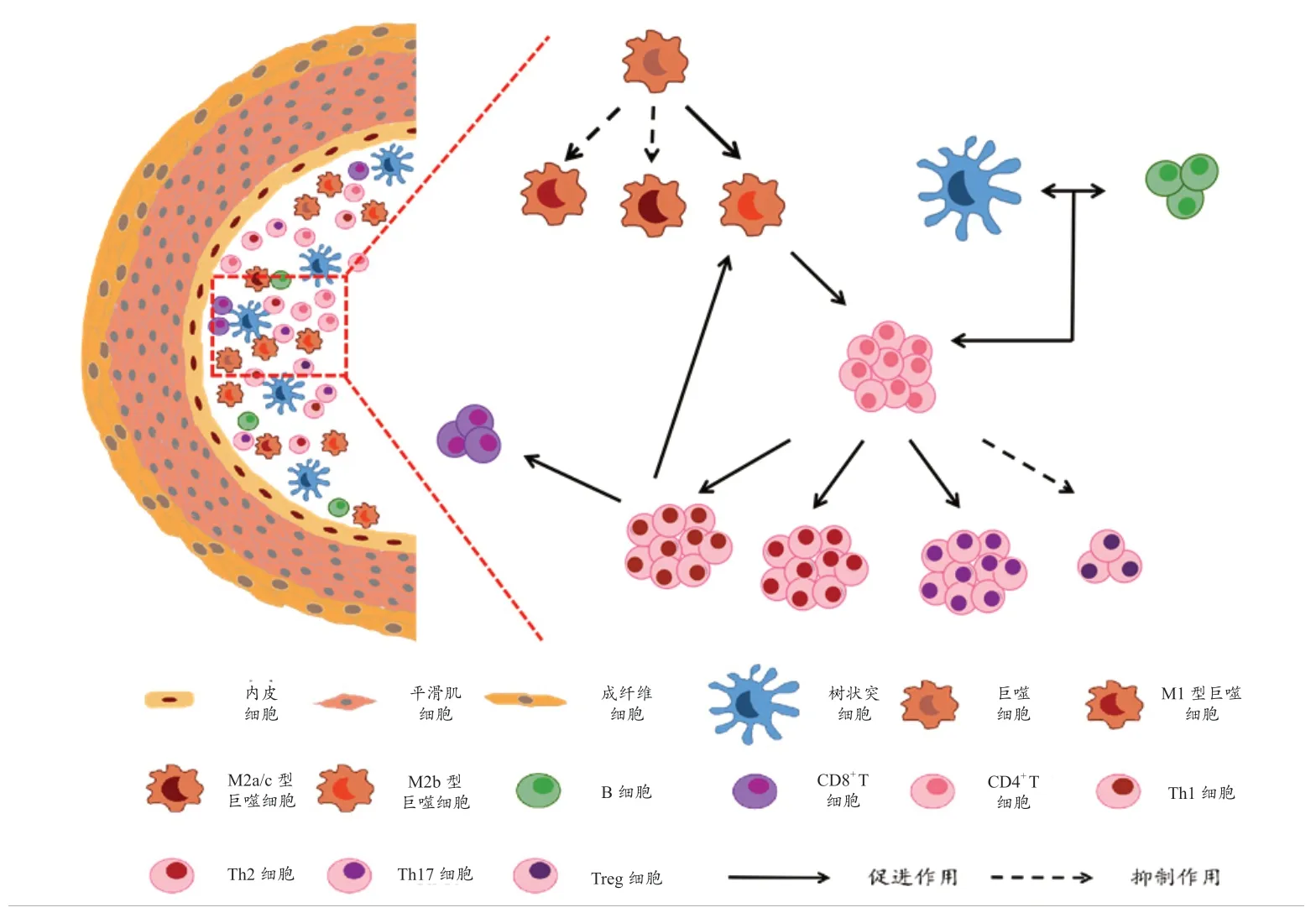
图2 肺血管重构中各炎症细胞之间的相互作用
5 靶向针对PAH T细胞的治疗
鉴于T 细胞在PAH 发病机制中的重要作用,针对T 细胞的免疫调节治疗是一种很有前景的干预措施。除糖皮质激素、他克莫司等免疫治疗外,雷帕霉素可作为较强的免疫抑制剂,通过抑制p70核糖体蛋白S6 激酶(p70S6K)等途径有效抑制Th 细胞的增殖[30]。McMurtry 等[31]发现,PAH 大鼠模型在接受雷帕霉素注射治疗2 周后,肺组织中的p70S6K 磷酸化减少,PAH 的病情进展有效缓解。然而,雷帕霉素治疗PAH 的临床应用仍有限。既往报道1 例患有胰岛细胞瘤合并肝转移的老年女性,在接受雷帕霉素治疗后PAH 有所改善[32]。此外,也有少数病例报道使用托珠单抗(IL-6 受体单克隆抗体)治疗后,成人斯蒂尔病并发的PAH 明显改善[33]。1 项评估托珠单抗治疗PAH 效果的开放标签的Ⅱ期临床试验(NCT02676947)表明,托珠单抗治疗PAH 是可行的,但对遗传性或特发性PAH没有显著影响[34]。利妥昔单抗为人源化小鼠抗CD20 单克隆抗体,1 项多中心随机对照双盲Ⅱ期临床研究(NCT01086540)评估利妥昔单抗治疗系统性硬皮病引起的 PAH 的有效性和安全性。研究结果表明,与安慰剂组相比,使用利妥昔单抗治疗24 周后,患者6 min 步行距离有增加趋势,利妥昔单抗可能通过耗竭B 细胞及降低IL-12 和IL-17水平发挥作用[35]。尽管目前有关PAH 的免疫靶向治疗研究越来越多,但是大规模、多中心及针对不同种族人群的临床研究仍亟待进行。
目前,PAH 的免疫治疗还没有明确的抗原靶点[36],多克隆Treg 细胞输注是最可行的方法。Tamosiuniene 等[13]研究发现,外源性移植Treg 细胞可延缓SU5416 或低氧诱导的Treg 细胞缺陷大鼠肺血管重构的进展。Liu 等[37]通过PAH 患者转录组数据库及PAH 小鼠模型进一步发现,肺组织 中MNDA/Ifi211、HCK、FGR、CSF3R、AQP9、S100A8、G6PD/G6pdx、PGD、NCF2和TXNRD1等10 个Treg 相关基因表达降低,可能是Treg 相关治疗靶点。尽管尚缺乏靶向针对PAH 患者Treg细胞进行治疗的临床研究,但是针对自身免疫性疾病等其他疾病的Treg 细胞输注的临床试验正在进行。Bluestone 等[38]研究发现,自体移植Treg 细胞可改善1 型糖尿病患者的免疫紊乱。给予不明原因复发性流产患者小剂量淋巴细胞治疗后,患者Th1 细胞数量降低,Th2、Treg 细胞数量显著升高,活产率提高[39]。此外,嵌合抗原受体T 细胞免疫疗法对多发性骨髓瘤和非霍奇金淋巴瘤有一定的疗效[40]。
6 小结
T 细胞亚群在PAH 的形成和发展中发挥着不同作用,Th 细胞起促炎作用,Treg 细胞起抗炎作用,而CD8+T 细胞的作用目前尚存在争议。T 细胞与肺血管细胞和其他免疫细胞交互作用,形成复杂网络共同参与肺血管重构。抑制Th 细胞的活化、改善Treg 细胞的功能障碍是治疗PAH 的重点,靶向治疗T 细胞免疫紊乱有望成为临床治疗PAH 的新策略。
