N6-腺苷酸甲基化修饰在心血管疾病中的研究进展
2023-12-02袁群凯张群吉侯经远钟志雄
袁群凯 张群吉 侯经远 钟志雄
心血管疾病(CVD)是世界范围内引起死亡的主要原因,迫切需要加强疾病机制研究,开发新的预防治疗策略[1]。近年来,随着N6-腺苷酸甲基化(m6A)测序(MeRIP Seq)技术的发展,m6A在CVD 领域的相关研究逐渐增多[2]。
1 m6A概述
m6A 是指RNA 的腺嘌呤N6位发生甲基化,是真核细胞中最常见的转录后修饰,参与多种细胞基因表达调控与生物学过程[3]。m6A 是动态、可逆的过程,受多种调节蛋白调控。m6A 的调节蛋白主要包括“Writers”甲基化酶、“Erasers”去甲基化酶和“Readers”甲基化阅读蛋白,分别发挥“写”“擦”“读”的作用[4]。甲基化酶包括肾母细胞瘤1 相关蛋白(WTAP)、甲基转移酶样3/14蛋白(METTL3/14)、CCCH 型锌指蛋白13(ZC3H13)等,主要以甲基化酶复合物(MTC)的形式发挥作用,催化RNA 的腺苷酸发生m6A。METTL3 和METTL14 形成的异质二聚体是MTC 的核心复合物,催化RNA 的甲基化修饰。其他蛋白包括WTAP、病毒样m6A 甲基转移酶相关蛋白(KIAA1429)、ZC3H13 和RNA 结合基序蛋白15/15B(RBM15/RBM15B),组成MTC 的调控亚基,引导MTC 的核心复合物到达特定区域,发挥重要的调控作用,如WTAP 可诱导MTC 在核斑点聚集,导致目标腺嘌呤甲基化[5]。此外,不同的MTC 调控亚基可诱导不同部位的RNA 修饰[6-7]。去甲基化酶包括肥胖相关基因蛋白(FTO)、α-酮戊二酸依赖性双加氧酶同源蛋白5(ALKBH5)等,可特异性识别并去除RNA 上的m6A。1999 年,Peters 等[8]在小鼠体内发现了第1 个去甲基化酶——FTO,提示m6A 是动态可逆的。现已证明FTO 存在于核斑点内,通过调控目标RNA 的 m6A,影响机体生物学功能[9]。甲基化阅读蛋白包括YTH 结构域家族蛋白(YTHDF1-3、YTHDC1-2),胰岛素样生长因子2 mRNA 结合蛋白1-3(IGF2BP1-3)等,可以通过识别特定位置的m6A,调控RNA 可变剪接,维持RNA 稳定性,诱导RNA 衰变,进而影响基因表达,调控细胞活动,如YTHDC1 可通过调节pre-mRNA剪接因子与目标mRNA的结合调控mRNA剪接[10]。m6A 在多种CVD 中发挥重要作用。既往对甲基化酶METTL3 及甲基化阅读蛋白YTHDC2 的研究较多,其主要参与调控动脉粥样硬化、急性心肌梗死、心力衰竭等CVD 的发生发展。
2 m6A与高血压
高血压是CVD 最主要的危险因素,目前认为其发病主要是遗传及环境因素共同作用的结果[11]。单核苷酸多态性(SNPs)指单个核苷酸改变导致的核酸序列多态性,研究发现发生在m6A 位点或临近位点的SNPs 可导致m6A 形成受阻,称为m6A相关的 SNP(m6A-SNPs)[12]。Mo 等[13]研究发现,m6A-SNPs 可能在血压调节中发挥重要作用,这为高血压发病机制的研究提供了新的线索。另外,Wu 等[14]研究发现,原发性高血压小鼠周细胞中m6A 水平较正常小鼠明显下降,这些甲基化的差异主要涉及炎症反应、近端小管发生、核糖核酸甲基转移酶活性改变等高血压相关信号通路,表明m6A 水平改变可能与高血压的发病机制密切相关。
3 m6A与动脉粥样硬化
动脉粥样硬化为慢性炎症及脂质代谢紊乱性疾病,巨噬细胞介导的炎症反应在动脉粥样硬化各个阶段中发挥重要作用,研究发现 m6A 与动脉粥样硬化有关[15]。RNA 结合基序蛋白4(RBM4)是参与RNA 剪接和翻译的RNA 结合蛋白,可与YTHDF2 相互作用,靶向作用于信号转导及转录激活因子1(STAT1)mRNA 的m6A 位点,降低STAT1 mRNA 的稳定性,抑制STAT1 介导的M1型巨噬细胞极化和炎症反应[16]。另有研究发现,METTL3、YTHDF2 等甲基化相关蛋白在M1 型巨噬细胞极化和巨噬细胞介导的炎症反应中发挥调控作用[17-18]。此外,METTL3 在低密度脂蛋白诱导的血管内皮细胞中表达升高,并通过IGF2BP1 结合JAK2 mRNA 的m6A 位点,作用于JAK2/STAT3信号通路,促进血管生成和动脉粥样硬化,敲除METTL3可发挥一定的抗动脉粥样硬化作用[19]。
4 m6A与心肌梗死
动脉粥样硬化进一步发展可导致管腔狭窄、闭塞,冠状动脉急性、持续性缺血缺氧造成心肌梗死。Shi 等[20]研究发现,梗死心肌组织与对照组织中FTO、YTHDF3、ZC3H13 和WTAP 的表达水平有明显差异,且WTAP 的SNPs 与心肌梗死进展显著相关。另有研究发现,心肌细胞缺氧应激时,METTL3 与RNA 的结合能力增强,促使METTL3介导的m6A 增加[21]。Yao 等[22]发现缺氧应激的血管内皮细胞中METTL3高表达,Wnt 信号通路的m6A 甲基化增强,进而促进血管生成,敲除METTL3后内皮细胞活力下降,细胞增殖、迁移及血管生成受抑。Wnt 蛋白家族成员Wnt5A 在促血管生成中发挥重要作用,Zhao 等[23]研究发现缺氧心肌中ALKBH5表达增加,导致Wnt5A 的m6A 水平降低,Wnt5A 表达减少,心肌细胞增殖、迁移及血管生成能力下降,敲除ALKBH5可减轻缺氧诱导的心肌细胞功能障碍,促进血管新生。Kumari 等[24]的研究也表明,ALKBH5 在心肌缺氧时通过调控mRNA甲基化水平,影响血管内皮的生成。另有研究表明,沉默METTL3和ALKBH5可通过调控m6A 水平,调控心肌缺血导致的细胞自噬和凋亡,促进心肌细胞存活[25-26]。METTL3 还可降低纤维化相关基因的m6A 水平,抑制心肌成纤维细胞的活化,减轻心肌梗死后的心肌纤维化[27]。m6A 在心肌细胞缺氧应激、血管再生及心肌梗死后心肌纤维化中发挥重要作用,为疾病提供了潜在的诊断标记物及治疗靶点。
5 m6A与心肌缺血再灌注损伤
及时有效的再灌注治疗是急性心肌梗死的首选治疗方法,但同时可能诱导缺血再灌注损伤(MIRI)[28],m6A 参与该过程。激活转录因子4(ATF4)是线粒体、内质网应激的关键转录因子,在线粒体缺氧时被激活[29]。WTAP 在缺氧/复氧的心肌细胞中表达升高,并通过调控m6A 影响ATF4 的表达,引起内质网应激和细胞凋亡增加,加重MIRI[30]。Pang 等[31]研究发现,在心肌缺血再灌注时,METTL14 表达明显升高,Wnt1 mRNA 的m6A 增加,引起Wnt1 蛋白表达水平升高,进而激活Wnt/β-catenin 信号通路,减轻MIRI。
6 m6A与心力衰竭
心室重构是心力衰竭发生的基本病理机制,m6A 可能参与心室重构,在心力衰竭治疗方面具有巨大潜力[32]。Xu 等[33]研究发现,在心力衰竭动物模型及心肌细胞中YTHDF2 的mRNA 表达水平均升高,YTHDF2 通过识别肌球蛋白重链7(MYH7)的m6A 甲基化位点,促进MYT7 蛋白降解,减少其合成,抑制心肌肥厚的进展。另有研究认为,当心脏后负荷增加时,METTL3 介导的m6A 水平提高可增强心肌细胞的反应,导致代偿性心肌肥厚,而METTL3缺失可导致正常心脏结构及功能的长期缺失;体外实验显示抑制METTL3 可导致心肌细胞失去适应性肥厚的能力。该研究证明METTL3 介导的m6A 水平提高对心肌细胞适应性肥厚是必要的,且在维持正常心脏功能方面具有重要作用[34]。Mathiyalagan 等[35]证实,FTO 在改善心力衰竭心脏收缩功能、延缓心室重构方面发挥重要作用。另外,Hinger 等[36]通过全基因组分析明确了人衰竭心脏中所有m6A 调控位点,与大鼠肥厚心肌细胞中m6A 调控位点进行比较,确定了跨物种保守的心肌细胞特异性m6A,提示m6A 在心力衰竭中的重要作用。
7 m6A与其他CVD
主动脉夹层是死亡率较高的CVD,发病机制尚不明确。Zhou 等[37]通过对主动脉夹层患者进行m6A 测序,筛选出1 790 个差异基因,结果显示主动脉夹层患者的METTL14 表达水平较对照组显著上调,而FTO 表达水平显著下调,提示m6A 与主动脉夹层的发生发展密切相关。另外,肥胖相关心肌病是发生在肥胖者的独立于高血压、冠状动脉粥样硬化性心脏病以及其他心脏疾病的心肌病变[38],控制饮食和体重是最有效的治疗方案。研究显示,间歇性禁食法能够降低实验动物的m6A 表达水平,减轻高脂饮食诱导的肥胖相关心肌病,改善心功能并减少心脏结构损伤[39]。
8 小结
CVD 的发生机制复杂,m6A 贯穿于CVD 由轻到重的各个阶段,影响疾病的发生发展,表1 和图1 总结了m6A 和m6A 调节蛋白在CVD 中的研究概况。然而,m6A 在CVD 研究中是相对较新的领域,相关研究仍有限,且多限于表达水平及功能研究,机制研究涉及较浅。需要进一步深入对CVD m6A 的研究,从表观遗传学角度了解CVD 的发病机制,以期为疾病的预防、诊断和治疗提供潜在的生物标志物及治疗靶点。

表1 m6A调节蛋白在心血管疾病中作用的相关研究
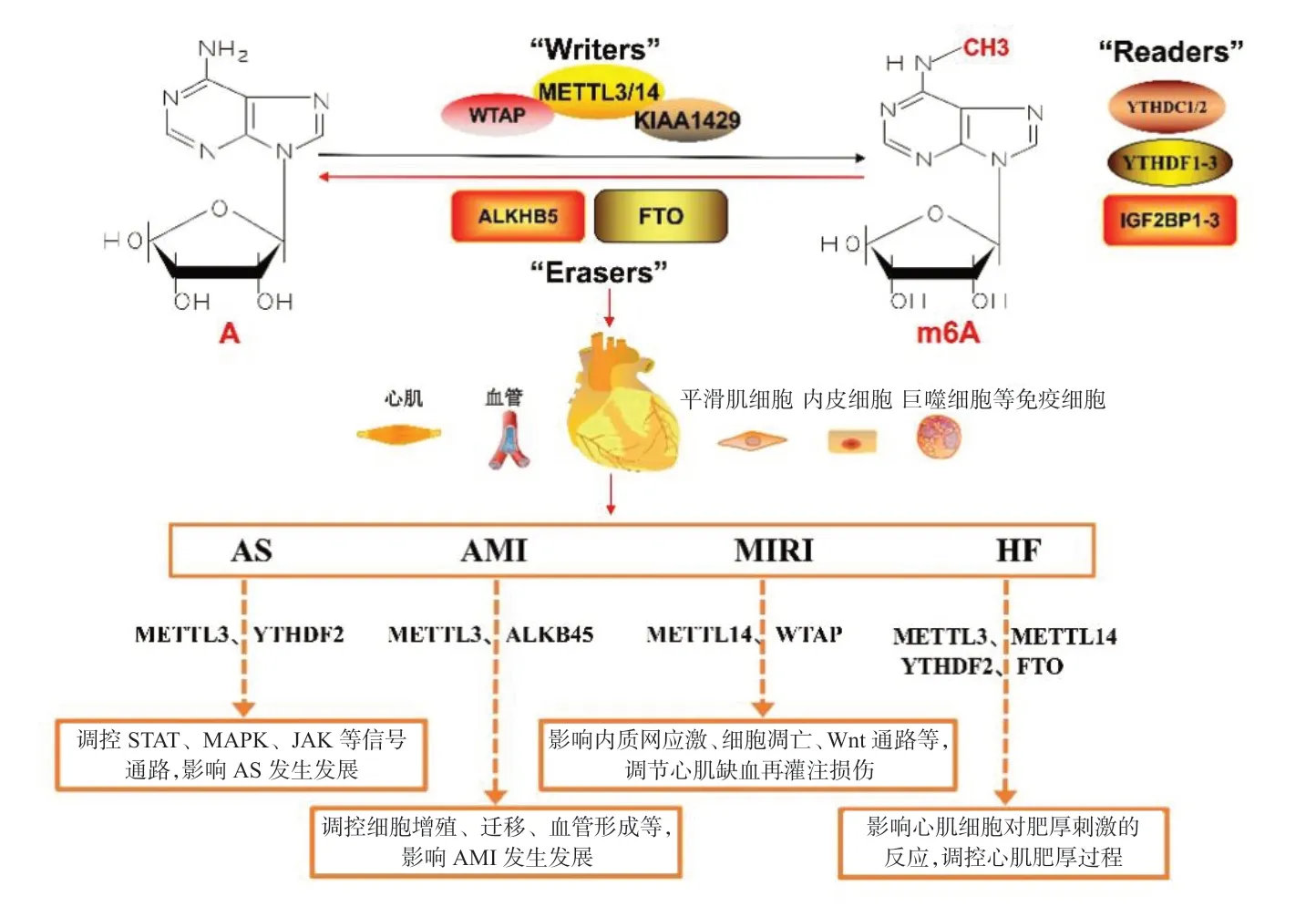
图1 m6A在心血管疾病中的作用
