miRNAs及其靶基因在膀胱癌诊治及预后中的研究进展
2023-12-02高小俊杨沁之综述审校
高小俊,林 芳,杨沁之,陈 果 综述 罗 茂 审校
1.西南医科大学 药学院(泸州 646000);2.西南医科大学 药物研究中心(泸州 646000);3.西南医科大学 临床医学院(泸州 646000)
膀胱癌是世界范围内常见的泌尿生殖系统恶性肿瘤,因膀胱癌早期无明显症状难以诊断和易转移、易复发的特点,其病因、诊断及治疗已成为当前临床研究关注的热点。目前学术界致力于开发膀胱癌的有效检测途径,但限制于科学技术的发展,临床上只能应用费用昂贵的膀胱镜检查和敏感性低的尿脱落细胞学检测。临床诊断的局限性使许多患者在诊断出病症时癌细胞早已发生转移,因而患者不能及时接受治疗或接受不到充分治疗。当前研究表明,膀胱癌的发生、侵袭和转移是多基因及相关分子共同参与所致,此过程涉及多种相关癌基因、抑癌基因、信号通路的关键蛋白[1]。因此,从分子水平上识别膀胱癌的病因和病程已成为当前膀胱癌临床治疗的关键。
微小RNA(microRNAs,miRNAs)是一类内源性的小分子非编码RNA,可于转录后调节目标基因。miRNAs主要来自编码基因的内含子或非编码基因,通过结合靶mRNAs 的3’端非编码区(3’-untranslated region,3’-UTR)起到抑制mRNAs 表达和影响其翻译途径的作用[2]。近来,鉴于miRNAs 在细胞生物学过程中的调控,部分研究揭示了miRNAs对肿瘤细胞转移过程的直接调控作用及在癌症发展中间接发挥原癌基因或抑癌基因作用[3]。此外,分子生物学研究指出miRNAs 积极参与膀胱癌病程,提示miRNAs有望单独或联合成为膀胱癌潜在的诊断标志物和治疗靶点[4]。本文对miRNAs在膀胱癌中的分子靶基因研究进展进行综述,揭示膀胱癌中miRNAs参与的基因表达调控机制,并探讨体液检测miRNAs 诊断膀胱癌的可能性,为miRNAs 作为膀胱癌临床诊断及治疗标志物提供了新的思路。
1 膀胱癌miRNAs的靶点研究
从分子机制上揭示膀胱癌的进展已成为当前临床研究关注的热点[5]。例如,在miR-143对膀胱癌的研究中,miR-143 通过与Kirsten 大鼠肉瘤病毒癌基因同源物(kirsten ratsarcoma viral oncogene homolog,K-RAS)基因的3′-UTR结合而调控RAS的表达,而RAS被证实是肿瘤中的癌基因[6]。此外,对miR-24的各种研究表明,miR-24-1-叉头盒M1(forkhead box protein M1,FOXM1)轴的功能与膀胱癌中癌细胞的增殖有关,下游信号转导可能导致膀胱癌发生过程中未知的分子机制[7]。miR-24 除通过影响半胱天冬酶募集结构域的膜相关鸟苷酸激酶蛋白(caspase recruitment domain and membrane-associated guanylate kinase-like protein 3,CARMA3)下调,抑制膀胱癌细胞的侵袭、增殖和上皮间质转化(epithelial to mesenchy-mal transition,EMT)外,还通过抑制死亡效应域蛋白(death effector domain containing Drotein,DEDD),改善膀胱癌[8]。
此前,许多研究已经揭示miR-130 家族在膀胱癌中发挥重要调控作用,充当肿瘤miRNAs。例如,蛋白质酪氨酸磷酸酶N1(protein tyrosine phosphatase nonreceptor type 1,PTPN1)与miR-130 家族靶基因受体酪氨酸激酶(receptor tyrosine kinase,RTK)下游多个信号通路的负调节因子有关,而PTPN1 敲低可导致膀胱癌细胞中肿瘤特性(细胞生长、侵袭和迁移)增加和Src在酪氨酸416位点磷酸化表达增加[9]。MiR-130还通过调节促进膀胱癌细胞自噬,从而促进肿瘤细胞增殖。此外,miR-130a-3p 对转化生长因子β 受体1(transforming growth factor beta receptor 1,TGFBR1)基因的3′-UTR 区域具有抑制作用,而TGFBR1 表达增强会上调TGF-β/SMAD3信号,进而血管内皮生长因子D生成增多,以促进膀胱癌淋巴管的生成与转移[10-11]。另有研究表明,T 盒转录因子3(t-box transcription factor 3,TBX3)是miR-143-3p 的靶基因,而TBX3 表达的下调会抑制膀胱癌肿瘤的增殖、迁移、侵袭和EMT[12]。MiR-143-3p 还可以靶向蛋白质-L-异天冬氨酸(D-天冬氨酸) -甲基转移酶(protein-l-Isoaspartate (DAspartate)o-methyltransferase,PCMT1)基因参与调控膀胱癌TCCSUP 或SW780 细胞的增殖、迁移和凋亡[13]。因此,通过识别miR-143-3p/TBX3 和miR-143-3p/PCMT1 轴设定的新的分子通路和目标,可能有助于更好地理解膀胱癌的进展和侵袭。
MiR-182-5p 在膀胱癌中通过几种途径促进癌细胞增殖、迁移和侵袭起到原癌基因的作用。ZHANG等[14]发现miR-182-5p 通过下调叉头盒F2(forkhead box F2,FOXF2)和激活音猬因子(sonic hedgehog,SHH)通路增强膀胱癌细胞的增殖和迁移。此外,另一项研究显示,miR-182-5p可以靶向调控p27蛋白,而p27蛋白的诱导与膀胱癌细胞增殖有关[15]。部分研究显示,miR-200a-3p通过靶向肿瘤坏死因子α诱导蛋白3(tumor necrosis factor,alpha-induced protein 3,TNFAIP3 A20 和(STMN1)基因作为人类膀胱癌的致癌基因。进一步研究发现,A20与膀胱癌细胞增殖、迁移、侵袭、细胞周期和炎性细胞因子的释放有关;STMN1与EMT的进程有关。因此,STMN1 和A20 可能作为膀胱癌的新治疗靶点。此外,miR-200b-3p 和miR-200c-3p 通过靶向增强E 盒结合锌指蛋白1(zinc finger e-box binding homeobox 1,ZEB1)表达促进间充质表型,加速膀胱癌的侵袭和转移。而miR-200c则通过下调多梳基因(ploycomb group genes,PcG)家族中的BMI-I 基因控制膀胱癌细胞的EMT 过程,并通过下调E2F3 抑制膀胱癌增殖。同时,有研究指出miR-141 与miR-429 在膀胱尿路上皮细胞癌的EMT中起重要作用[16-21]。这些数据表明,miR-200 家族在膀胱癌的进程中既有抑癌基因功能又发挥癌基因作用。
膀胱癌中,miR-34a 也通过靶向多个基因起到抑制癌细胞增殖、迁移和侵袭的作用。例如,直接靶向CD44 蛋白,可以有效地防止肿瘤的相关转移;降低肝细胞核因子4γ(hepatocyte nuclear factor 4 gamma,HNF4G)的表达来阻止肿瘤细胞的存活、定植和侵袭;影响缺口受体1(notch receptor 1,Notch 1)信号转导间接下调癌细胞的迁移和侵袭。此外,有研究表明,miR-34a 浓度升高会导致其靶基因高尔基磷蛋白3(golgi phosphoprotein 3,GOLPH3)的过度表达。进一步研究显示,miR-34a/GOLPH3 轴在肿瘤干细胞中起重要作用,可能是治疗耐药尿路上皮性膀胱癌的一种途径。MiR-34a 能够直接调节转录因子T 细胞因子1(tcell factor 1,TCF1)/淋巴增强结合因子1(lymphoid enhancer binding factor 1,LEF1)轴参与调控膀胱癌的转移和化疗耐药,据此本文推测miR-34a和TCF1/LEF1轴的调节可能成为治疗化疗增敏耐药膀胱癌的新策略。值得注意的是,另一项研究揭示miR-34a作为miRNAs的抑制因子影响miR-34a/TCF1/LEF1 轴,并在膀胱癌细胞的存活中发挥重要作用。这些数据揭示miR-34a能够通过特殊靶向以增强药物敏感性对耐药膀胱癌起到治疗效果[22-25]。
2 膀胱癌miRNAs的临床作用
2.1 促进/抑制癌细胞增殖、迁移、侵袭和凋亡
膀胱癌中miRNAs 表达情况存在较大差异,且它们通过调控靶基因的表达进而参与膀胱癌的发展。例如,miR-1、miR-99a、miR-100 和miR-200 家族在膀胱癌中表达下调[26-29];而miR-21 和miR-210 呈现为上调[30-31]。进一步研究显示,这些miRNAs可调控某些细胞的生长、凋亡、死亡程序以及部分癌细胞下游的信号通路。此外,许多miRNAs已经被证实与膀胱癌细胞的进展和转移有关。如miR-133a、miR-30-3p 和miR-199a通过调节角蛋白7(keratin 7,KRTT)活性参与膀胱癌生长的调控[32-33]。膀胱癌中相关miRNAs 对其靶基因的调控,见图1。
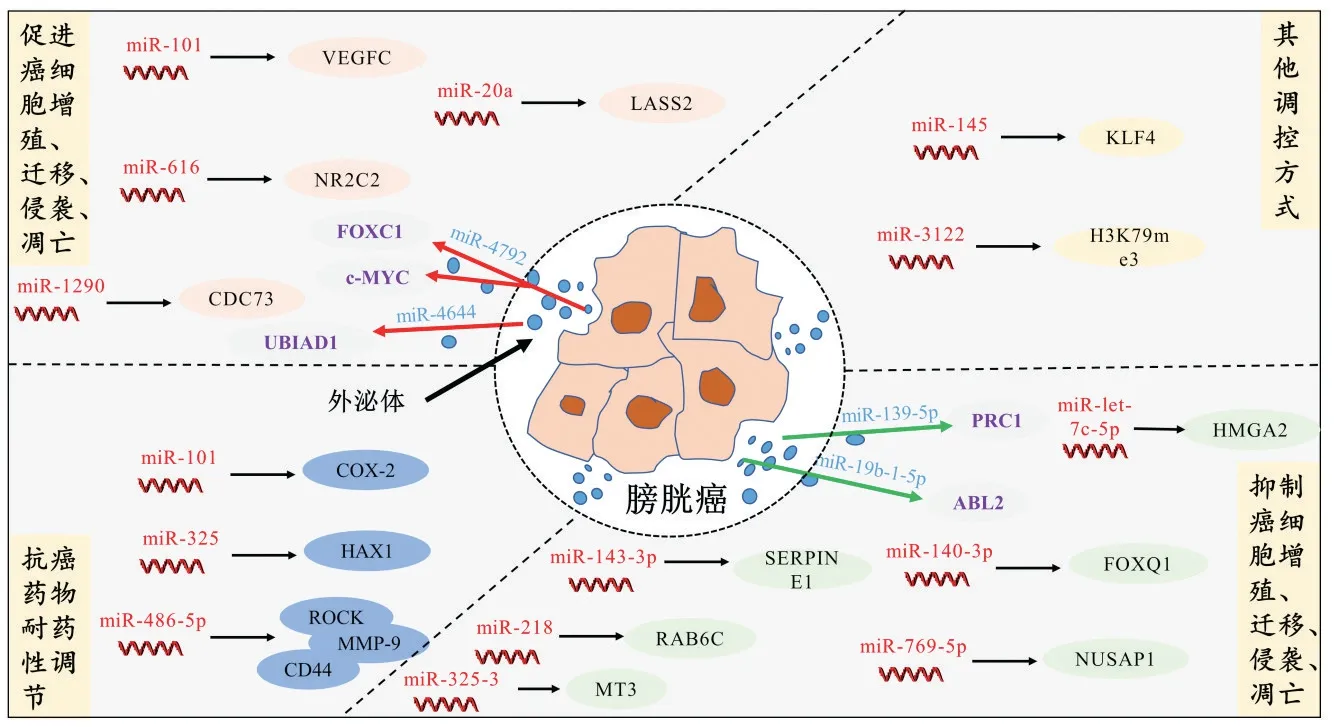
图1 膀胱癌中相关miRNAs对其靶基因的调控Figure 1 Regulation of related miRNAs in bladder cancer and their target genes
作为肿瘤抑制因子,影响细胞生理活性的miRNAs包括miR-143-3p、miR-218、miR-325-3p 和miR-let-7c-5p,它们分别通过调节丝氨酸蛋白酶抑制剂家族E成员1(serpin family emember 1,SERPINE1)、RAS 癌基因家族成员RAB6C、金属硫蛋白3(metallothionein 3,MT3)和高机动性组AT-hook 2(high mobility group AThook 2,HMGA2)基因而发挥作用[34-37]。此外,miR-101、miR-20a 等癌基因分别通过调控血管内皮生长因子C(vascular endothelial growth factor,VEGFC)、人源性长寿保障基因2(homo sapiens longevity assurancehomologue 2 of yeast LAG1,LASS2)在膀胱癌中发挥调控作用[38-39]。另有研究发现,miR-140-3p 通过结合叉头盒Q1(forkhead box Q1,FOXQ1)的3′-UTR 区域抑制其表达,而FOXQ1 可以促进膀胱癌细胞增殖和侵袭;进一步研究显示,miR-140-3p在体外和体内均下调FOXQ1的表达,从而发挥对膀胱癌细胞的抗增殖和抗侵袭作用[40]。CHEN Y等[41]发现miR-769-5p在膀胱癌细胞和组织中表达相对较低,其与核仁和纺锤体相关蛋白1(nucleolar and spindle associated protein 1,NUSAP1)的3′-UTR 结合从而抑制NUSAP1 表达,与预后不良密切相关。NUSAP1的过表达挽救了miR-769-5p介导的细胞凋亡、钙黏蛋白E 和B 淋巴细胞瘤-2(b-cell lymphoma-2,BCL2)相关X 蛋白(BCL2-associated X protein,Bax)表达的促进作用,以及对细胞生长、迁移、侵袭、钙黏蛋白N 和BCL2 表达的抑制,表明miR-769-5p通过靶向NUSAP1 抑制膀胱癌得发生。miR-616 是最近发现的促进癌症发生和发展的miRNAs,包括miR-616-5p 和miR-616-3p。miR-616-5p 在膀胱癌中表达上调,通过与核受体亚家族2C组成员2(nuclear receptor subfamily 2 group c member 2,NR2C2)的3′-UTR 结合以抑制NR2C2表达,达到诱导膀胱癌恶化的作用[42]。此外,miR-1290作为肿瘤促进剂在膀胱癌细胞和组织中显著过表达,进一步研究显示,miR-1290 可以与细胞分裂周期73基因(cell division cycle 73,CDC73)的3ʹ-UTR 结合抑制其表达。值得注意的是,CDC73 起肿瘤抑制因子的作用,可抑制集落形成和细胞增殖,并使细胞周期暂停于G1 期,表明miR-1290 在癌细胞生长和增殖中起到关键作用[43]。总之,miRNAs作为癌基因或抑癌基因参与着膀胱癌的发生、发展。
2.2 外泌体介导的miRNAs调控膀胱癌进展
外泌体是细胞外囊泡的一个子集,直径小于150 nm,可以运输多种生物活性分子,例如非编码RNA、蛋白质、脂质等,被认为是细胞间通讯的重要手段[44]。外泌体包裹的miRNAs 已被确定为致癌过程中的潜在癌症生物标志物和促肿瘤发生介质。迄今为止,许多研究都强调了miRNAs 在膀胱癌诊断和进展中的重要作用[45]。
miR-4644 在膀胱癌患者血浆外泌体样本中表达上调。进一步研究显示,miR-4644通过直接结合UbiA异戊烯基转移酶结构域1(ubiA prenyltransferase domain containing 1,UBIAD1)的3′-UTR 区域对其进行负调控。而UBIAD1的过表达有效地消除了miR-4644对膀胱癌细胞增殖、迁移和侵袭的促进作用[46]。此外,在膀胱癌中,外泌体介导的miR-4792会降低叉头盒C1(forkhead box protein C1,FOXC1)和细胞-髓细胞瘤病病毒性癌基因(cellular-myelocytomatosis viral oncogene,c-Myc)的表达水平,延缓细胞生长,并减少Warburg 效应和乳酸含量。FOXC1下调的膀胱癌细胞在体内明显形成更小的肿瘤。C-Myc 的抑制可逆转FOXC1 过表达的影响。这些数据共同支持外泌体介导的miRNAs 可通过多种途径参与调控膀胱癌的进程,突出了一种新颖的治疗策略[47]。
2.3 对抗癌药物耐药性的调节
膀胱肿瘤的抗癌治疗有很多种,包括放射治疗、化疗和手术,其中化疗是近年来一种广泛用于治疗各种癌症的策略。比较常见的化疗药物包括烷化剂(尼莫司汀)、抗代谢药(去氧氟鸟苷)、抗肿瘤抗生素(放线菌素D)和顺铂等。顺铂是目前治疗膀胱癌常用的化疗药物。然而,膀胱癌细胞通常具有逃避顺铂诱导的细胞凋亡的机制。膀胱癌细胞通常过表达抗凋亡蛋白来对抗顺铂诱导的细胞死亡,这是膀胱癌细胞抗凋亡的重要策略之一。值得注意的是,有研究证实miRNAs的失调与膀胱癌对顺铂的耐药性有关[48]。
LI 等[49]发现顺铂耐药的膀胱癌细胞中过表达miR-325 可增加顺铂对其细胞毒作用,但转染HCLS1相关蛋白X-1(HCLS1 associated protein X-1,HAX-1)质粒可消除miR-325 对顺铂的作用。进一步研究显示,顺铂诱导的细胞凋亡过程中,miR-325 靶向抑制HAX-1,促进线粒体崩溃,继而释放细胞色素C,激活半胱氨酸天冬氨酸酶(cysteinyl aspartate-specific proteinases,caspases)-3/7/9。最后,miR-325 的恢复使耐顺铂的膀胱癌细胞对顺铂诱导的凋亡再敏感。因此,miR-325促进了顺铂诱导的膀胱癌细胞线粒体崩溃和凋亡,降低膀胱癌对铂类化疗药物的耐药性。另一项研究中,SALIMIAN 等[50]发现,miR-486-5p 模拟物与顺铂的结合能够下调基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)、CD44 和Rho 相关激酶(Rho associated coiled-coil containing protein kinase 1,ROCK)基因来抑制膀胱癌细胞的迁移和转移能力。进一步研究显示,miR-486-5p与顺铂联合应用能显著促进膀胱癌细胞的凋亡,其作用机制是阻滞细胞周期的亚G1 期,激活caspase-3/9和p53,下调抗凋亡基因BCL2、沉默信息调节因子1(silent information regulator 1,SIRT1)、嗅觉调节素4(olfactomedin 4,OLFM4)和SMAD 家族成员2(SMAD family member 2,SMAD2)基因的表达。这些结果表明miR-486-5p 在肌肉浸润性膀胱癌细胞中可能具有抗转移作用。此外,miR-101 靶向环氧合酶-2(cyclooxygenase-2,COX-2)间接调节膀胱癌细胞对顺铂的耐药性,进一步改善膀胱癌患者的治疗情况[51]。
2.4 其他调控方式
miRNAs 还参与调控膀胱癌的其他进程。例如,MINAMI 等[52]发现miR-145 的异位表达通过抑制膀胱癌患者中上调的KLF转录因子4(KLF transcription factor 4,KLF4)来调控聚嘧啶束结合蛋白1(polypyrimidine tract binding protein 1,PTBP1)/肌肉型丙酮酸激酶M1 型(pyruvate kinase,muscle,PKM1)1/PKM 2 轴,进而调节War-burg 效应,起到抗肿瘤作用。另外,ZHAO W 等[53]发现,过表达的miR-3122 会阻断膀胱癌T24、BIU-87 和EJ-1 细胞中的组蛋白H3K79me3 全基因组效应,从而调控膀胱癌进展。这些研究结果也表明单个或多个miRNAs 为膀胱癌的临床诊治提供了一个新的方向。
3 miRNAs作为膀胱癌诊断、预后和治疗标记物的研究
药物基因组学研究中,癌症治愈情况的个体差异是由于药物-miRNAs之间特殊作用造成。例如,LI MP等[54]发现的膀胱癌患者对顺铂耐药性的降低跟AP-2α基因中的SNP位点(rs1045385)A替换为C有关,而这是患者体内miR-200 与其靶基因相互作用引起。所以,这种特殊作用可以看作是细胞中与癌症相关的miRNAs 的抑制剂或激动剂,它在癌症发展过程中可导致不同细胞呈现增殖或凋亡趋势。近年来新方法的发展,使生物样品中少量miRNAs 的检测成为可能,也为筛选出miRNAs作为膀胱癌诊断、预后和治疗的生物标志物提供了可能。例如,最近为筛查早期膀胱瘤开发出检测尿液中miRNAs 的技术。体液是miRNAs 的主要来源,提示可通过对尿液和血液等体液中miRNAs水平的变化进行临床诊断和预测膀胱癌[55]。例如,PARIZI 等[56]整理膀胱癌患者肿瘤样本、尿液和血液样本中一般miRNAs 或特定miRNAs 表达变化的研究发现,与癌症相关的miRNAs 表达谱与正常人有显著差异。进一步研究显示,在所有整理的miRNAs中,miR-1、miR-99a、miR-100 和miR-143 在所有组织、血液和尿样中表达降低,相反,只有miR-21 和miR-210 在所有三个样本中都表达增加。此外,最近KUTWIN P等[57]发现,膀胱癌患者尿液和血清样本中miR-106b-3p、miR-199a-5p 和miR-145-3p 的相对表达水平之间存在相关性;并且尿液和血清结果之间存在差异,尿液中所得数据比血清中数据更有说服力。更重要的是,miRNAs 作为癌症诊断的平均灵敏度和特异性分别达到近70%和80%,这些结果表明miRNAs可以作为有用的诊断标记物。
如今,不同的miRNAs对膀胱癌的预后有一定的影响,生物流感病毒中miRNAs的存在更是被认为是一种具有高度敏感性和特异性的重要生物标志物[58]。例如,miR-200、miR-145、miR-214和miR-211-5p都是被当前众多研究认可的判断膀胱癌预后的重要指标[4]。同时,随着miRNAs 表达检测技术的发展,对在膀胱癌中表达异常的miRNAs有了更深的认识。例如,蒋贝尔等[59]研发出一种膀胱癌诊断用尿液miRNAs试剂盒,可通过检测尿液中miR-143-3p、miR-183-5p、miR-21-3p、miR-219a-5p、miR-1-3p 和miR-18a-3p 的一种或多种组合,达到诊断是否患有膀胱癌的目的。这大大提高了膀胱癌的早期发现率,为膀胱癌患者的治愈赢得了宝贵时间。另外,对一些miRNAs参与膀胱癌进程的机制研究更为透彻。例如,miR-101 可以负调控细胞间质上皮转换因子(cellular-mesenchymal epithelial transition factor,c-Met)基因,进而miR-101已经被当作是新的T24细胞侵袭和迁移抑制剂。衰老导致的miR-34a 在膀胱癌中表达的更新部分是源自细胞分裂蛋白激酶6(cyclin dependent kinase 6,CDK6)的靶向作用[60-61]。总之,miRNAs 在膀胱癌进程中扮演重要角色,但对于未来膀胱癌治疗中可能面临的各种挑战,仍然需要更精确、灵敏性更高的技术方法来重点检测miRNAs 作为膀胱癌诊断、预后和治疗的重要生物标志物。
4 小结与展望
本综述归纳了特异性差异表达miRNAs 与其靶基因之间的调控关系,进一步阐明这些miRNAs可作为膀胱癌临床早期筛查、诊断、预后和治疗标记物。本研究还探讨了有望通过对体液中一种或多种微量miRNAs进行检测而达到诊断膀胱癌的可能,揭示近年来火热的外泌体miRNAs 途径对膀胱癌的显著疗效和阐述部分miRNAs对膀胱癌耐药性的调节。
大量关于膀胱癌与miRNAs 关系的研究已基本揭示出miRNAs在膀胱癌发病机制中所起到的重要作用,但仍有部分问题急需进一步解决,如怎样在全基因水平大规模筛选鉴定可能的膀胱癌miRNAs生物标志物;膀胱癌miRNAs 的异常表达及功能发挥具体受哪些因子调控;膀胱癌miRNAs经释放进入循环血液后涉及怎样的基因表达调控机制及作用途径;如何建立适宜的临床应用膀胱癌miRNAs 标准化检测体系等。相信随着对miRNAs 研究不断深入,更好地了解miRNAs 在膀胱癌中的作用机制、信号级联和靶分子将使我们能够开发有效的治疗和预防疾病的药物。此外,及早检测miRNAs 使我们能够为健康个体开发新的筛查和实验室测试。
