HA380血液灌流联合连续性静脉-静脉血液滤过对脓毒症合并急性肾损伤患者肾功能和炎症反应的影响
2023-12-02黄长利黄启伟祝治华
黄长利 黄启伟 祝治华
目前认为,脓毒症主要是因自身感染而引起的全身炎症反应综合征(systemic inflammatory response syndrome,SIRS),其典型表现为寒战、气促、心慌及发热等,随着病情进展可出现严重脓毒症、脓毒性休克等,是引起多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)的关键因素[1-3]。急性肾损伤(acute kidney injury,AKI)是其常见且十分严重的并发症之一,相关研究指出,脓毒症合并AKI 的致死率已达到50%以上,严重威胁患者生命[4-5]。因此,早期确定高效的救治方案至关重要。连续性静脉-静脉血液滤过(continuous venovenous hemofiltration,CVVH)可通过清除患者血液内的中小分子物质,纠正酸碱失衡,促进水、电解质平衡,其在临床中已取得广泛运用[6-9],但其无法有效清除患者血液中分子质量相对较大的炎症物质。近年来,随着血液净化技术及相关膜材工艺的提升,国内推出了新型血液灌流器,并在清除大分子量毒素的临床应用中体现出显著的有效性和生物相容性[10-11]。因此,本研究将HA380 血液灌流(hemoperfusion,HP)联合CVVH 应用于脓毒症合并AKI,旨在验证其临床应用价值。
1 资料与方法
1.1 一般资料
采取回顾性分析法,选取2020 年6 月—2022 年10 月九江市柴桑区人民医院与九江学院附属医院收治的92 例脓毒症合并AKI 患者作为研究对象。(1)纳入标准:①符合脓毒症诊断标准[12];②年龄≥20 岁;③肾脏替代治疗≥5 d;④符合AKI 诊断标准[13]。(2)排除标准:①接受过肾脏手术治疗;②住院时间<1 周;③伴有恶性肿瘤;④伴有免疫功能障碍;⑤近3 个月内接受过糖皮质激素治疗;⑥依从性差;⑦伴有精神性疾病;⑧住院期间死亡。根据治疗方式将患者分为对照组(n=46)与试验组(n=46)。本研究经九江市柴桑区人民医院与九江学院附属医院医学伦理委员会审批。
1.2 方法
所有患者均接受常规对症治疗,具体内容如下:给予患者血管升压、抗感染药物;进行液体复苏、纠正电解质酸碱平衡处理;据情况采取机械通气治疗;选择肠内或经口给予营养支持干预等。
对照组在上述治疗的基础上给予CVVH 治疗,具体内容如下:根据患者身体情况,选择其股静脉或右侧颈内静脉作血管通路;采用连续性血液滤过机[国食药监械(进)字2010 第3463436 号,型号:EQUA smart]、聚砜膜透析滤过器[国食药监械(进)字2013 第3450494 号,型号:Hi 20]进行治疗;置换液选取碳酸氢盐;以低分子肝素(生产厂家:深圳赛保尔生物药业有限公司,批准文号:国药准字H20060191,规格:0.5 mL︰5 000 AXa 单位)进行抗凝,在治疗开始时通过深静脉置管处的动脉端将低分子肝素输入体内,负荷剂量15~50 单位/(kg·h),然后以5~20 单位/(kg·h)持续泵入,期间每2 小时取患者血液检测活化部分凝血活酶时间(activated partial thromboplastin time,APTT),稳定APTT 在正常值上限1.5~2 倍,CVVH 治疗结束前30~60 min 停止抗凝;血流速度控制在200~250 mL/min,治疗剂量为40 mL/(kg·h),每天治疗时间超过12 h;当患者尿量满足容量平衡需求、血肌酐能自行下降时停止治疗。
试验组在对照组的基础上给予HP 治疗,具体内容如下:使用HA380 血液灌流器(健帆生物科技集团股份有限公司,国械注准20163101181,型号:HA380),同时将其调节至CVVH 模式;将灌流器速度调节至150~200 mL/min,每次治疗时间应超过6 h,完成治疗后取下灌流器,并于回血后继续CVVH 治疗;HP 每天治疗1 次,持续治疗5 次。
1.3 观察指标及判定标准
(1)治疗效果:分别于治疗前及治疗1、3、5 d后,采取急性生理学和慢性健康状况评价Ⅱ(acute physiology and chronic health evaluation Ⅱ,APACHEⅡ)评分评估患者治疗情况[14]。APACHEⅡ涉及3 个维度,分别是急性生理学指标、年龄因素及慢性健康状况,总分值范围为0~71 分,分数高低与患者健康情况成反比。(2)肾功能:分别于治疗前及治疗3、5 d 后,抽取患者5 mL 外周静脉血检测其血肌酐(serum creatinine, Scr)、肾损伤分子1(kidney injury molecule 1,KIM-1)及血尿素氮(blood urea nitrogen,BUN)水平。(3)炎症反应:分别于治疗前及治疗3、5 d 后,采取患者静脉血3 mL,随后经3 000 r/min 离心处理8 min,将其血清进行分离,采取酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测白细胞介素-6(interleukin-6,IL-6)、降钙素原(procalcitonin,PCT)及高迁移率族 蛋 白B1(high mobility group protein 1,HMGB1)水平。
1.4 统计学处理
本试验采用SPSS 24.0 软件对相关数据进行统计学分析。计量资料采用t 检验(组间比较采用独立样本t 检验,组内比较采用配对t 检验),用(±s)表示;计数资料采用χ2检验,用率(%)表示。P<0.05 为差异有统计学意义。
2 结果
2.1 两组患者基线资料对比
对照组男25 例,女21 例;年龄38~64 岁,平均(46.97±8.31) 岁;AKI 分 期:Ⅰ期18 例,Ⅱ期22 例,Ⅲ期6 例;脓毒症病程3~101 h,平均(51.36±7.68)h。试验组男28 例,女18 例;年龄40~62 岁,平均(48.07±8.34)岁;AKI 分期:Ⅰ期21 例,Ⅱ期20 例,Ⅲ期5 例;脓毒症病程2~103 h,平均(52.56±8.40)h。两组患者基线资料对比,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组患者治疗效果对比
治疗前、治疗1 d 后,两组APACHEⅡ评分对比,差异均无统计学意义(P>0.05);与治疗前相比,治疗3、5 d 后,两组APACHEⅡ评分均下降,且试验组均显著低于对照组(P<0.05)。见表1。
表1 两组患者治疗效果对比[分,(±s)]

表1 两组患者治疗效果对比[分,(±s)]
*与本组治疗前相比,P<0.05。
组别 治疗前 治疗1 d 后 治疗3 d 后 治疗5 d 后对照组(n=46) 24.42±3.24 23.97±2.98 21.47±2.23* 17.24±1.60*试验组(n=46) 24.55±3.19 23.65±2.96 18.16±2.18* 13.42±1.51*t 值 0.194 0.517 7.199 11.776 P 值 0.847 0.607 <0.001 <0.001
2.3 两组患者肾功能对比
治疗前,两组Scr、KIM-1 及BUN 水平对比,差异均无统计学意义(P>0.05);与治疗前相比,治疗3、5 d 后,两组Scr、KIM-1 及BUN 水平均下降,且试验组上述指标水平均显著低于对照组(P<0.05)。见表2。
表2 两组患者肾功能对比(±s)
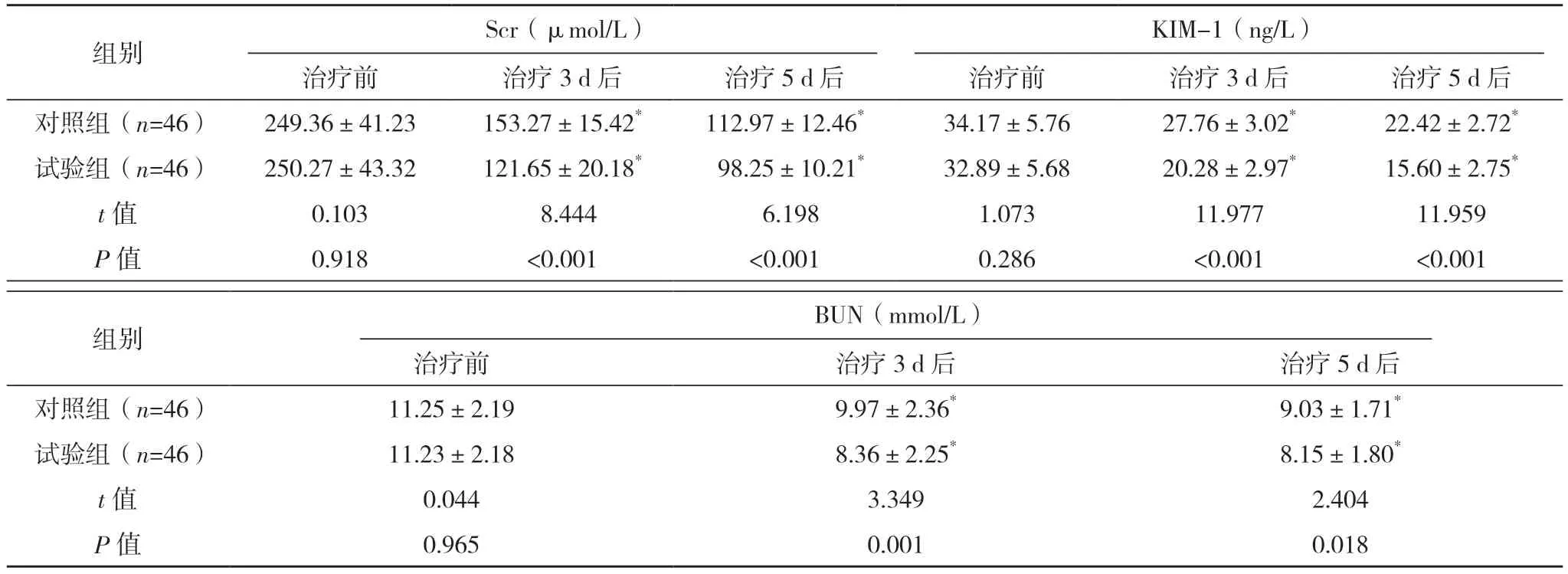
表2 两组患者肾功能对比(±s)
*与本组治疗前相比,P<0.05。
组别 Scr(μmol/L)KIM-1(ng/L)治疗前 治疗3 d 后 治疗5 d 后 治疗前 治疗3 d 后 治疗5 d 后对照组(n=46) 249.36±41.23 153.27±15.42* 112.97±12.46* 34.17±5.76 27.76±3.02* 22.42±2.72*试验组(n=46) 250.27±43.32 121.65±20.18* 98.25±10.21* 32.89±5.68 20.28±2.97* 15.60±2.75*t 值 0.103 8.444 6.198 1.073 11.977 11.959 P 值 0.918 <0.001 <0.001 0.286 <0.001 <0.001组别 BUN(mmol/L)治疗前 治疗3 d 后 治疗5 d 后对照组(n=46) 11.25±2.19 9.97±2.36* 9.03±1.71*试验组(n=46) 11.23±2.18 8.36±2.25* 8.15±1.80*t 值 0.044 3.349 2.404 P 值 0.965 0.001 0.018
2.4 两组患者炎症反应对比
治疗前,两组IL-6、PCT 及HMGB1 水平对比,差异均无统计学意义(P>0.05);与治疗前相比,治疗3、5 d 后,两组IL-6、PCT 及HMGB1 水平均降低,且试验组上述指标水平均显著低于对照组(P<0.05)。见表3。
表3 两组患者炎症反应对比(±s)
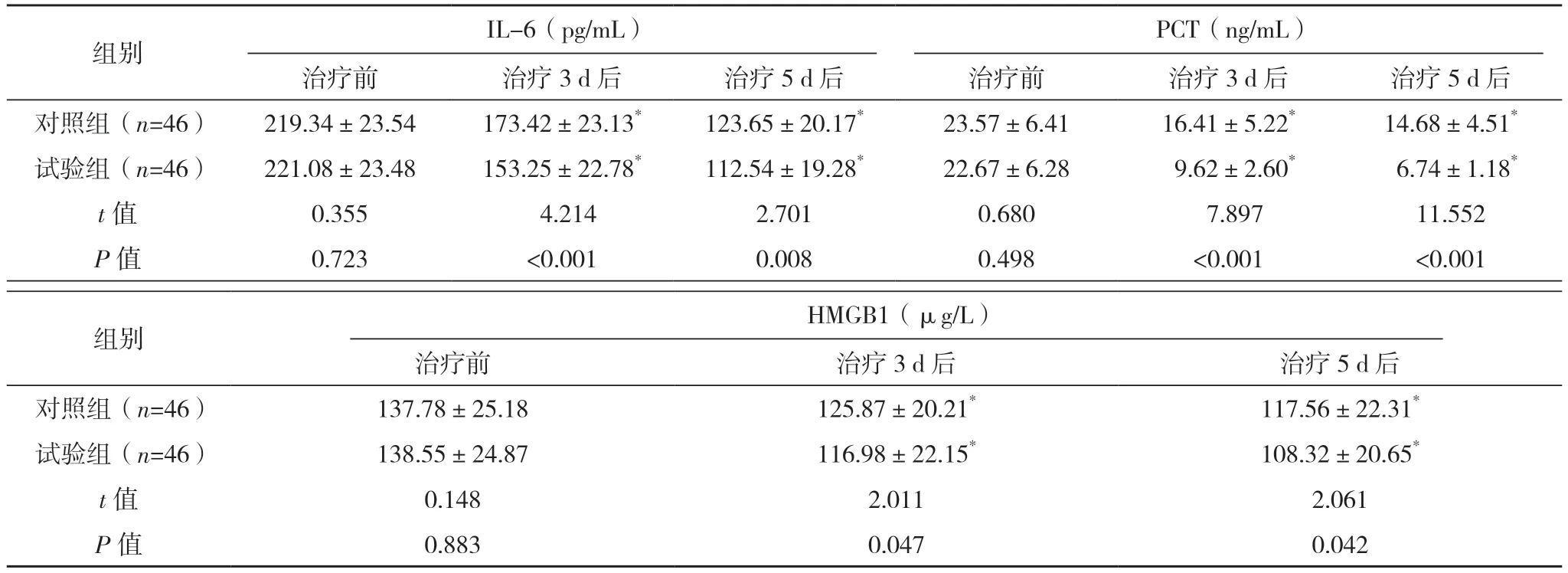
表3 两组患者炎症反应对比(±s)
*与本组治疗前相比,P<0.05。
组别 IL-6(pg/mL)PCT(ng/mL)治疗前 治疗3 d 后 治疗5 d 后 治疗前 治疗3 d 后 治疗5 d 后对照组(n=46) 219.34±23.54 173.42±23.13* 123.65±20.17* 23.57±6.41 16.41±5.22* 14.68±4.51*试验组(n=46) 221.08±23.48 153.25±22.78* 112.54±19.28* 22.67±6.28 9.62±2.60* 6.74±1.18*t 值 0.355 4.214 2.701 0.680 7.897 11.552 P 值 0.723 <0.001 0.008 0.498 <0.001 <0.001组别 HMGB1(μg/L)治疗前 治疗3 d 后 治疗5 d 后对照组(n=46) 137.78±25.18 125.87±20.21* 117.56±22.31*试验组(n=46) 138.55±24.87 116.98±22.15* 108.32±20.65*t 值 0.148 2.011 2.061 P 值 0.883 0.047 0.042
3 讨论
脓毒症常合并MODS,其中超过50%的患者出现AKI,对患者生活质量和身心健康均产生严重影响[15]。目前,临床主要通过CVVH 清除患者血液内的毒素及其他有害物质,可在一定程度上缓解病情。但有研究指出,CVVH 治疗存在组织相容性不足、难以清除分子质量较大的代谢产物等缺点[16]。近年来,由于HP 可清除分子质量较大的炎症介质,获得越来越高的关注。HA380 血液灌流器作为我国2019 年新推出来的灌流器,具有吸附性较强的特点,其可消除10~60 kDa 的循环分子,已逐渐应用于急性胰腺炎、慢性心肾综合征等疾病中[17-18]。但目前关于HA380 应用于AKI 合并脓毒症的报道鲜见,其临床价值尚需进一步验证。
本试验数据显示,治疗3、5 d 后,试验组Scr、KIM-1、BUN 及IL-6、PCT、HMGB1 水平均显著低于对照组(P<0.05),说明HA380 HP 联合CVVH 应用于脓毒症合并AKI 患者,可提高肾功能水平,降低炎症反应。分析原因:其一,通过CVVH 可有效清除患者体内较多的内毒素与炎症介质,在一定程度上降低了患者血液中毒性物质,有助于维持血流动力学处于稳定状态。其二,HA380是近年来国内新开发的血液灌流器,其关键部件血液吸附柱主要是为了提高感染性休克患者治疗效果而开发,主要由多孔聚合物组成且其血液相容性十分好,有助于吸附较大分子量,缓和细胞因子的毒素。
本试验数据显示,治疗3、5 d 后,两组APACHEⅡ评分均下降,且试验组均显著低于对照组(P<0.05),说明HA380 HP 联合CVVH 应用于脓毒症合并AKI 患者,可提高治疗效果。相关研究指出,AKI 患者肾损伤恢复不佳和炎症因子水平偏高与患者病死率增高具有密切联系[19-20]。试验组治疗后患者肾功能相关指标水平与炎症因子相关指标水平均明显低于对照组,体现了其病情缓解更明显,故APACHEⅡ评分下降更明显,死亡风险也随之降低,结果与报道一致。
综上所述,HA380 HP 联合CVVH 应用于脓毒症合并AKI,可改善患者肾功能,降低机体炎症反应,治疗效果较好。但本研究仍存在不足之处:选取的样本量较少,在进行统计学分析时,可能引起试验结果出现偏倚。
