基于FeNO检测的儿童支气管哮喘ICS剂量调整研究*
2023-12-02王娟
王娟
支气管哮喘是一种以慢性气道炎症为主要病理特点的异质性疾病,可导致气道呈高反应性,是儿童常见的慢性呼吸系统疾病。据调查,我国14 岁以下儿童支气管哮喘的总体患病率约为4.9%[1]。而有研究进一步发现,高达16%的严重支气管哮喘患儿病情可发展至成年,严重影响患儿的身心健康,并增加家庭和社会经济负担[2]。现阶段关于支气管哮喘的具体发病尚不完全明确,其发生可能与遗传、环境、免疫和心理等多种因素有关[3]。吸入性糖皮质激素(inhaled corticosteroid,ICS)是目前用于控制哮喘最有效的药物之一。ICS 可通过强大的抑制气道炎性反应和降低气道高反应性作用,而达到减轻哮喘症状,改善肺功能和提高患儿生活质量的目的。然而,近期有研究表明,接受ICS 治疗的支气管哮喘患儿症状得到良好控制的仅为55%,有12.5%的患儿未得到有效控制[4]。有学者分析认为,ICS 对支气管哮喘患儿控制不佳主要与ICS 的临床治疗管理不规范及患者依从性较差有关[5]。此外,目前ICS 的治疗剂量主要根据患儿肺功能评估等情况进行调整,但这不能客观反映气道炎症反应水平。呼出气一氧化氮(fractional exhaled nitric oxide,FeNO)由气道细胞产生,其浓度水平与气道炎性细胞数量具有高度的相关性,被认为是气道炎性反应水平的特征性标志物[6]。本研究以支气管哮喘患儿作为研究对象,分析FeNO检查结果对该类患儿ICS 治疗过程中剂量调整的指导作用,以期为支气管哮喘患儿治疗方案的优化提供参考依据。
1 资料与方法
1.1 一般资料
选取2020 年1 月—2021 年12 月丹阳市妇幼保健院收治的92 例初次诊断为支气管哮喘患儿作为研究对象。纳入标准:(1)支气管哮喘临床诊断符合文献[7]中华医学会制定的《儿童支气管哮喘诊断与防治指南(2016 年版)》中的相关标准;(2)年龄6~12 岁,男女不限。排除标准:(1)近30 d 内接受糖皮质激素或白三烯受体拮抗剂等药物治疗;(2)合并有支气管发育异常或先天性心脏病等慢性基础性疾病;(3)合并有荨麻疹、湿疹或变应性鼻炎等其他过敏性疾病。共计纳入符合上述入排标准患儿92 例,采用随机数字表法分为观察组和对照组,各46 例。本研究经本院医学伦理委员会批准同意。患儿及其监护人了解本研究内容,并签订知情同意书。
1.2 方法
两组患儿均予以吸入用布地奈德混悬液(生产厂家:AstraZeneca Pty Ltd,注册证号:H20140474,规格:2 mL︰0.5 mg)联合硫酸特布他林雾化吸入用溶液(生产厂家:AstraZeneca AB,注册证号:国药准字HJ20140108,规格:2 mL︰5 mg)雾化吸入治疗。其中,硫酸特布他林雾化吸入用溶液给药方法为2.5 mg,2 次/d,雾化吸入。吸入用布地奈德混悬液给药起始剂量为0.5~1 mg,每8 小时1 次,雾化吸入。待患儿病情好转后出院,并定期随访12 个月,每3 个月随访1 次。对照组患儿每3 个月评估哮喘控制状况和肺功能水平,哮喘控制状况良好则予以吸入用布地奈德混悬液降级治疗,直至降到维持剂量,维持半年无复发后停药,若患儿哮喘仅部分控制或进一步加重,则按照文献[7]《儿童支气管哮喘诊断与防治指南(2016 年版)》标准,予以吸入用布地奈德混悬液强化升级治疗。肺功能水平参考呼气峰值流量(PEF),若PEF≥70%,则提示疗效良好,若<70%,则需要强化升级治疗。观察组在对照组基础上联合FeNO 水平对吸入用布地奈德混悬液剂量进行调整,当FeNO>50 ppb 时,提示吸入用布地奈德混悬液疗效不佳,需要对其进行升级治疗。研究过程中,哮喘控制状况、肺功能水平和FeNO 任一指标异常均需要ICS 升级治疗。
1.3 观察指标及评价标准
(1)肺功能。记录患儿随访前和随访第12 个月第1 秒用力呼气容积(FEV1)占预计值百分比(FEV1%pred)、最大呼气流量(PEF)占预计值百分比(PEF%pred)。(2)支气管哮喘控制情况。于患儿随访前和随访第12 个月,采用儿童哮喘控制测试(C-ACT)量表评估患儿支气管哮喘控制情况,该量表由7 个问题组成,其中4 题由患儿独立完成,3 题由患儿家长完成,分值范围0~27 分,分值越高代表哮喘控制情况越好。(3)气道FeNO 水平。采用由瑞士ECO PHYSICS 公司生产的一氧化氮检测分析仪(化学发光法)检测两组患儿随访前及随访第3、6、9 和12 个月气道FeNO 水平。(4)患儿随访期内支气管哮喘复发率、ICS 停药率和不良反应(如咽干、声音嘶哑、口腔念珠菌病等)发生率。其中,哮喘复发定义为哮喘控制并降级治疗或者停药后,出现哮喘急性发作或者需要应用短效β2肾上腺素能受体激动剂和速效β2肾上腺素能受体激动剂作为急救药物每周达2 次以上者。
1.4 统计学处理
采用SPSS 26.0 软件对数据进行分析。符合正态分布的计量资料采用(±s)表示,组间比较采用独立样本t 检验,不同随访时间组内比较采用配对样本t 检验;计数资料采用率(%)表示,组间比较采用χ2检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较
两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性,见表1。

表1 两组一般资料比较
2.2 两组随访前和随访结束时肺功能比较
组内比较,观察组和对照组随访第12 个月时,FEV1%pred、PEF%pred 和C-ACT 评分均明显高于随访前,差异均有统计学意义(P<0.05);组间比较,两组随访前和随访第12 个月时,上述指标水平差异均无统计学意义(P>0.05)。见表2。
表2 两组随访前和随访结束时肺功能和哮喘控制程度比较(±s)

表2 两组随访前和随访结束时肺功能和哮喘控制程度比较(±s)
*与本组随访前相比,P<0.05。
组别 FEV1%pred(%)PEF%pred(%)C-ACT 评分(分)随访前 随访第12 个月 随访前 随访第12 个月 随访前 随访第12 个月观察组(n=46) 56.28±5.03 86.25±6.13* 58.38±4.39 85.37±8.08* 15.52±0.92 21.87±2.08*对照组(n=46) 56.13±4.87 85.21±7.17* 57.67±4.67 86.35±7.69* 15.67±0.81 22.38±2.12*t 值 0.145 0.748 0.751 0.596 0.830 1.165 P 值 0.885 0.457 0.454 0.553 0.409 0.247
2.3 两组不同随访时间气道FeNO 水平变化
组内比较,观察组和对照组在随访第3、6、9和12 个月气道FeNO 水平呈进行性下降趋势,且与随访前相比,差异均有统计学意义(P<0.05);组间比较,观察组和对照组患者在随访前及随访第3、6、9 和12 个月气道FeNO 水平差异均无统计学意义(P>0.05)。见表3。
表3 两组不同随访时间气道FeNO水平变化[ppb,(±s)]
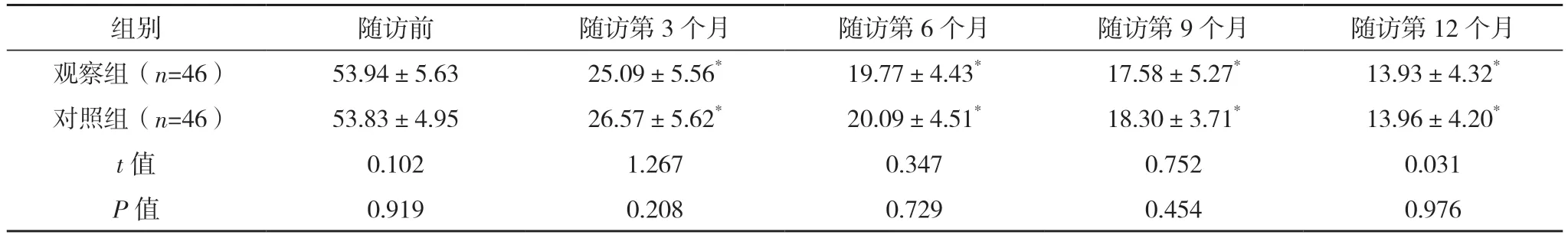
表3 两组不同随访时间气道FeNO水平变化[ppb,(±s)]
*与本组随访前相比,P<0.05。
组别 随访前 随访第3 个月 随访第6 个月 随访第9 个月 随访第12 个月观察组(n=46) 53.94±5.63 25.09±5.56* 19.77±4.43* 17.58±5.27* 13.93±4.32*对照组(n=46) 53.83±4.95 26.57±5.62* 20.09±4.51* 18.30±3.71* 13.96±4.20*t 值 0.102 1.267 0.347 0.752 0.031 P 值 0.919 0.208 0.729 0.454 0.976
2.4 两组不同随访时间ICS 剂量比较
两组随访第3、6、9 和12 个月ICS 平均每日给药剂量均呈下降趋势;观察组随访第9、12 个月ICS 平均每日给药剂量均明显低于对照组,差异均有统计学意义(P<0.05)。见表4。
表4 两组不同随访时间ICS平均每日给药剂量比较[mg,(±s)]

表4 两组不同随访时间ICS平均每日给药剂量比较[mg,(±s)]
组别 随访第3 个月随访第6 个月随访第9 个月随访第12 个月观察组(n=46) 3.99±1.06 2.92±0.86 1.74±0.59 0.90±0.51对照组(n=46) 3.66±1.03 2.86±1.00 2.13±0.74 1.37±0.62 t 值 1.514 0.297 2.793 3.986 P 值 0.134 0.767 0.006 <0.001
2.5 两组患儿随访期内支气管哮喘复发率、ICS 停药率和不良反应发生率比较
随访期内,观察组和对照组患儿支气管哮喘复发率差异无统计学意义(P>0.05)。而观察组患儿ICS 停药率明显高于对照组,不良反应发生率明显低于对照组,差异均有统计学意义(P<0.05)。见表5。

表5 两组随访期内支气管哮喘复发率、ICS停药率和不良反应发生率比较[例(%)]
3 讨论
由支气管痉挛引起的气道通气受限是支气管哮喘的重要特征,并可进一步导致气道高反应性。已有大量研究证实,慢性气道炎症是引起支气管痉挛和气道高反应的主要原因[8-9]。糖皮质激素是一类具有强大抗炎和免疫抑制作用的药物。随着药物制剂水平的不断进步,ICS 已经成为目前用于支气管哮喘急性期和缓解期临床治疗的重要药物,对控制哮喘发作,降低患儿死亡率具有重要意义。虽然与口服糖皮质激素相比,ICS 作用相对温和,但由于肺部毛细血管丰富,部分ICS 仍可有通过肺部吸收进入体循环,进而导致局部和全身性不良反应风险增加。有调查显示,由ICS 口腔残留物导致的口腔念珠菌病、咽痛和咽炎等局部不良反应的发生率高达60%[10]。而长期使用ICS 对儿童骨骼发育影响也一直受到业界关注,特别是需要大剂量ICS 治疗的重度哮喘患儿,不仅可导致骨钙丢失和骨密度下降风险明显增加,还是影响ICS 治疗依从性重要因素[11]。由此可见,寻找一种有效的评估哮喘控制水平的指标,进而优化临床治疗过程中ICS 的治疗剂量,降低不良反应发生风险,增加患者治疗依从性非常必要。
有研究发现,不同的气道炎症表型与哮喘发作密切相关,其中嗜酸性粒细胞型是支气管哮喘患者中最常见的炎症表型,且其水平与气道的炎性反应呈明显正相关,是气道炎性反应状态的重要生物标志物[12]。然而,也有研究表明,气道内嗜酸性粒细胞水平虽然与气道炎性反应密切相关,但其与患者的哮喘控制情况则无统计学相关性,采用气道嗜酸性粒细胞作为评估ICS 治疗中哮喘控制情况的指标具有一定局限性[13]。近几年,不断有学者通过检测FeNO,评估气道炎症和哮喘控制水平,指导支气管哮喘的临床诊治,并取得了良好效果[14]。2011 年,由美国胸科协会推出的《呼出气一氧化氮临床应用指南》进一步肯定了其在支气管哮喘中的应用价值。然而,现阶段关于FeNO 检测在指导ICS 剂量调整方案方面的研究十分有限。
FeNO 主要来源于气道上皮细胞,正常生理状态下NO 可起到舒张支气管平滑肌的作用。然而,在气道炎症过程中,大量细胞炎性因子可诱导ON 的表达增加,导致支气管黏膜充血水肿,从而引起气道通气受限和气道高反应性[15]。目前,关于FeNO 的正常参考值和哮喘控制水平评估的诊断界值尚无统一标准。国内学者黄嘉莉等[16]发现,FeNO 用于预测重度哮喘患儿1 年内复发的最佳诊断界值为35 ppb,此时的敏感度和特异度分别为84%和74%。本研究基于患者基线FeNO 水平,将其变化情况作为ICS 剂量调整的依据之一发现,观察组和对照组在不同随访时间段内肺功能、哮喘控制情况及FeNO 水平差异无统计学意义(P>0.05),但观察组在随访第9 个月ICS 平均每日给药剂量明显低于对照组(P<0.05)。这提示,观察组和对照组两种评估方法均可改善支气管哮喘患儿的肺功能,并有效控制哮喘发作,但联合检测FeNO 水平可降低治疗过程中ICS 给药剂量。吴巧珍等[17]研究同样发现,FeNO 在支气管哮喘糖皮质激素的降级治疗过程中具有明显优势,可显著降低激素的使用剂量。进一步对两组患儿随访期内哮喘复发率比较发现,其差异无统计学意义(P>0.05),这与Zheng等[18]研究结果不同,可能与本研究随访时间较短有关。而与对照组相比,观察组患儿随访期内ICS停药率明显增加,不良反应发生率明显降低。这提示,基于FeNO 检测的哮喘管理有助于患儿早期停用ICS,进而降低用药安全性风险。宋瑜欣等[19]研究也表明,在儿童支气管哮喘中通过监测FeNO 水平,有助于提升激素的用药效果,从而缩短激素的使用疗程。由此可见,基于FeNO 的哮喘管理,有助于降低ICS 的使用剂量,缩短ICS 的治疗时间,并提升用药安全性。然而,也有学者认为,通过检测FeNO 水平指导哮喘治疗用药并不能对患儿的远期用药安全风险和生命质量产生显著影响[20-21]。这说明通过单一FeNO 检测手段对患儿哮喘管理的效果可能有限,需要联合多种评估方法以发挥更大的临床价值。
综上所述,基于FeNO 的哮喘管理,在保证ICS 治疗有效性的前提下,可显著降低ICS 的使用剂量,缩短ICS 的疗程,并降低患儿用药安全性风险,可以为支气管哮喘患儿ICS 的治疗剂量调整提供依据。本研究也存在一定局限性,如纳入病例较少,限制了统计学的应用,且随访时间较短,患儿远期复发风险和用药安全性风险无法观察,该研究结果仍需大样本,多中心和长时间随访进一步验证。
