脲解型微生物的矿化过程及其在水泥基材料早期裂缝修复中的应用
2023-12-01杨春景白宏洁
杨春景,白宏洁,张 彬,赵 峰
(1.黄河水利职业技术学院, 河南 开封 475004; 2.内蒙古交通职业技术学院 道路桥梁工程系,内蒙古 赤峰 024005; 3.华北理工大学 矿业工程学院, 河北 唐山 063210)
1 前 言
混凝土具有原材料来源广泛、制备简单、力学性能好、隔音性强等优点,被广泛应用于桥梁、建筑、港口等现代化土木工程建筑中,在未来相当长的一段时间内仍具有巨大的应用潜力[1-3]。然而,在实际的应用过程中,由于混凝土自身存在一些缺点,如抗拉强度低、脆性大等,在建筑结构服役时,难免会产生裂缝[4-6]。特别是当混凝土表面开裂,水以及一些侵蚀性物质(如CO2、Cl-和SO42-等)渗入混凝土,引起混凝土水化产物降解、钢筋锈蚀,严重影响结构的安全性和使用性[7-9]。因此,及时高效地修复混凝土裂缝,不但可以提高混凝土的使用寿命,还可以节约混凝土结构的维修成本,减少经济损失。
近年来,随着多学科交叉技术的快速发展,利用微生物矿化技术来修复混凝土裂缝已成功吸引了众多国内外学者的研究兴趣,并取得一系列不错的科研成果。Bang等[10]率先论述了微生物矿化可用于混凝土裂缝修复,且修复后的混凝土强度和刚度都得到一定程度的提高。荷兰代尔夫特理工大学的Jonkers等[11]首次提出了微生物自修复混凝土的概念,主要是将耐碱性芽孢杆菌和底物作为微生物自修复剂,在混凝土制备过程中加入其中,当裂缝产生后,混凝土内部的微生物会发生矿化反应生成碳酸钙沉淀,从而达到裂缝修复的目的。
众所周知,在微生物诱导碳酸钙沉积的过程中,微生物的生物化学反应过程起到至关重要的作用[12-15],并且微生物的生化过程在自然界各类介质中均广泛存在[16-18]。到目前为止,大部分的研究均集中在研究微生物对水泥基材料裂缝的自修复效果及其采用载体技术来提高后期裂缝的修复效果。然而,对于温度、pH值和Ca2+浓度对微生物的生长情况、微生物的生物矿化过程及其各离子浓度的变化,大都仅研究其中一种或两种条件的影响,且并未进行详细的讨论分析[19-20]。同时,对于微生物矿化过程中的各离子浓度的动态变化,也缺乏相应的探讨[21]。而这些都是影响微生物矿化效率的重要因素,同时也深深影响着水泥基材料裂缝的自修复效率[22-24]。因此,亟需开展微生物生长条件等方面的研究,这对于水泥基材料裂缝修复效果的提高至关重要。
本研究选用一种耐碱性且能产生脲酶的微生物,研究温度、pH 值和Ca2+浓度对该微生物生长情况的影响。随后,以溶液中的各离子浓度和pH 值变化来研究微生物诱导碳酸钙沉积的动态过程,揭示了MICP的矿化机理。同时,将此微生物和钙源加入到砂浆试件中,以面积修复率和抗水渗透修复率两个指标来表征裂缝的自修复效果,从而为MICP 技术应用于水泥基材料裂缝修复实践提供技术支撑。
2 实验与方法
2.1 微生物与培养基
本研究选用的微生物是一种脲解型巴氏芽孢杆菌,购自中国工业微生物菌种保藏管理中心(CICC),此细菌在新陈代谢过程中可以产生脲酶[25]。细胞呈杆状,直径1.0~1.5 μm,长2.0~4.0 μm,革兰氏阳性。细菌培养基成分如下:5.0 g/L 牛肉膏, 3.0/L g蛋白胨,10 g/L 尿素和1 L 去离子水(pH=7.0)。将上述培养基溶液放入1 000 mL 的锥形瓶中,并在121 ℃的压力蒸汽灭菌锅中灭菌20 min。接着,在无菌超净台上接种10 mL 微生物菌液至培养基中,在30℃和200 r/min的恒温振荡培养箱中培养72 h。在微生物生长过程中,每隔6 h检测微生物的生长情况和培养液中pH 值的变化。随后,取出微生物菌液放入4 ℃的冰箱中备用。
2.2 微生物生长测试
通过测试微生物菌液在波长600 nm 处的光密度(OD600)来表征微生物的生长情况。OD600值越大,说明微生物的生长情况越好。其中,微生物菌液中的OD600采用多功能酶标仪(Varioskan LUX)进行测试。此外,待OD600稳定后,取培养液上清液,用灭菌后的去离子水稀释十倍后,分别采用倒置荧光显微镜和场发射扫描电子显微镜(FE-SEM)来观测细菌的形貌。
2.3 微生物培养液的pH 值测试
在微生物生长和矿化过程中,可采用精度为0.1的工业在线pH 计检测仪(无锡美耀自动化科技有限公司)测试培养基溶液的pH 值。
2.4 培养液中Ca2+浓度测试
采用EDTA 滴定法来测定培养液中的Ca2+浓度[26]。而微生物的矿化效率则采用钙化速率来间接反映。
钙化速率反映的是单位时间内培养基溶液中Ca2+浓度的变化值,如下式(1)所示:
式中:η为钙化速率,C0为初始培养液中的Ca2+浓度,Ct为培养t时间后溶液中的Ca2+浓度。
2.5 温度对微生物生长情况的影响
众所周知,温度会影响微生物的生长情况。因此,在5、10、15、20、25、30和35 ℃分别研究温度对微生物生长的影响。随后,将25 mL的微生物菌液加入到灭菌后pH 值为7.0的250 mL 培养基中,然后,在不同温度、200 r/min的恒温振荡培养箱中培养72 h。通过测试培养基中上清液的OD600来反映微生物的生长情况。
2.6 初始pH 值对微生物生长情况的影响
微生物的生长会受到外界pH 值的影响,过低或过高的pH 值会影响微生物的生长。通过灭菌后的4 mol/L NaOH 溶液来调节培养基的初始pH 值分别为6.0,7.0,8.0,9.0,10.0,11.0,12.0 和13.0。接着,将25 mL 的微生物菌液加入到灭菌后250 mL 不同初始pH 值的培养基中。然后,将其在25 ℃、200 r/min的恒温振荡培养箱中培养72 h。通过测试培养基中上清液的OD600来反映微生物的生长情况。
2.7 Ca2+浓度对微生物生长情况的影响
Ca2+浓度作为微生物诱导碳酸钙沉淀(MICP)过程中的一个重要参数,若Ca2+过少,会影响CaCO3沉淀的生成量,若Ca2+量过多,则会影响微生物的生长情况和矿化效率。采用乳酸钙作为外加钙源,将Ca2+浓度分别调节为0,30,60,90,120,150,180,210 和240 mM。接着,将25 mL的微生物菌液加入到灭菌后250 mL不同Ca2+浓度的培养基中。然后,在25 ℃、200 r/min的恒温振荡培养箱中培养72 h。通过测试培养基中上清液的OD600来反映微生物的生长情况。
2.8 碱性溶液中微生物诱导碳酸钙的沉淀(MICP)过程
将90 mM 乳酸钙溶液加入到500 mL 灭菌后培养基中(pH=9.0),接着,将5 mL 处于对数期生长的微生物菌液加入到培养基中。然后,在相同的培养条件下(25℃和200 r/min)进行振荡培养72 h。在微生物矿化过程中,每隔6 h检测培养液中的pH 值、Ca2+和浓度,其中,pH 值和NH4+ 浓度分别采用pH 计和氨气敏电极(PNH3-3)测试,并且在测试之前均采用标准溶液进行校正,Ca2+浓度则采用EDTA 滴定法测试。
2.9 砂浆试件的制备
采用标准的三联模(40 mm×40 mm×160 mm)制备砂浆试件,将普通硅酸盐水泥P·II 42.5与砂混合在一起制备标准砂浆(w/c=0.5),值得注意的是在砂浆拌和过程中应严格按照标准GB/T 17671-2021的步骤进行,表1是不同类型砂浆试件的配合比。在砂浆搅拌过程中,微生物菌液代替等体积的水一起加入砂浆中。每个配比成型3组试件,24 h脱模,然后将试件放入标养室中(RH=90%, T=(20±3) ℃进行养护,当养护时间达到6 d以后,将试件取出,采用折断法制造裂缝。

表1 不同砂浆试件的配合比Table 1 Mix proportions of different mortar specimens
2.10 裂缝制备方法及其自修复过程
为了获得真实情况下的裂缝,采用折断法来制造裂缝。具体的步骤如下:将养护好的试件各表面清洗干净并晾干,将清洗好的棱柱形试件放在全自动抗折抗压力试验机下(YAW-300C),适当控制压力加载速度,通过三点弯曲试验将试件断裂为两半,然后通过细铁丝插入到裂缝中来控制试件的裂缝宽度,最后将两半试件用细胶带组装在一起,可通过直径不同的铁丝得到不同宽度的裂缝,最终获得的裂缝宽度在0.30~0.45 mm 之间[27]。待裂缝制作完成后,将试件放入25 ℃的水中进行干湿循环修复。在每个干湿循环修复过程中,12 h浸泡在25 ℃的水中,12 h暴露在25℃的大气中.随后测试不同养护时间下裂缝的自修复效果,直至修复时间达到28 d为止。图1是砂浆试件裂缝的制作和修复养护过程示意图。
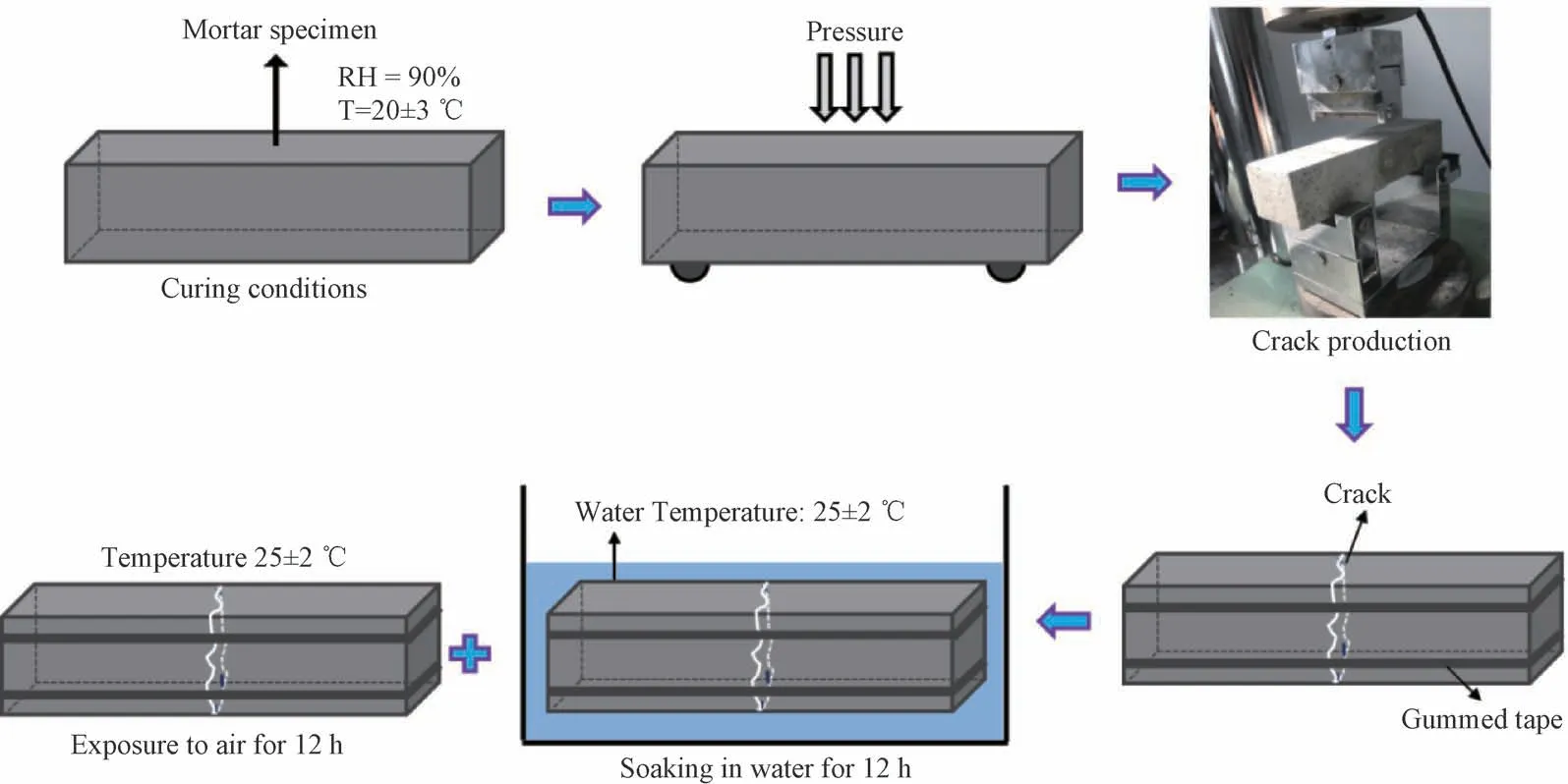
图1 裂缝制作及修复养护过程示意图Fig.1 Schematic diagram of crack production and healing processes
2.11 砂浆试件裂缝的自修复效果
2.11.1 面积修复率 当裂缝在不同养护时间下进行修复时,图像法最能直观表征不同修复时间下裂缝的自修复效果。采用体式显微镜(SZ61-SET)对不同修复时间下的裂缝拍照,然后对初始裂缝图像进行阈值割裂,实现图像二值化处理,通过灰度值的变化来获得不同修复时间下裂缝区的像素值。依据以前的研究[28-30],面积修复率的计算公式如下:
式中:β为裂缝的面积修复率,A0为刚开裂时裂缝区像素值,At为不同修复时间t时的裂缝区像素值。
2.11.2 抗水渗透修复率 当砂浆试件产生裂缝后,试件的抗渗水性就会大幅降低,而当裂缝被修复后,相同时间内通过裂缝的水流量会减少。因此,通过测试恒定时间内不同修复时间砂浆试件通过裂缝的水流量,可计算得到裂缝的抗水渗透修复率。渗水法测试裂缝的水流量示意图如图2所示,在进行本实验时,需分别测定裂缝修复前和不同修复时间下的水渗透速度,并根据下列公式计算不同修复时间裂缝的抗水渗透修复率[30]:
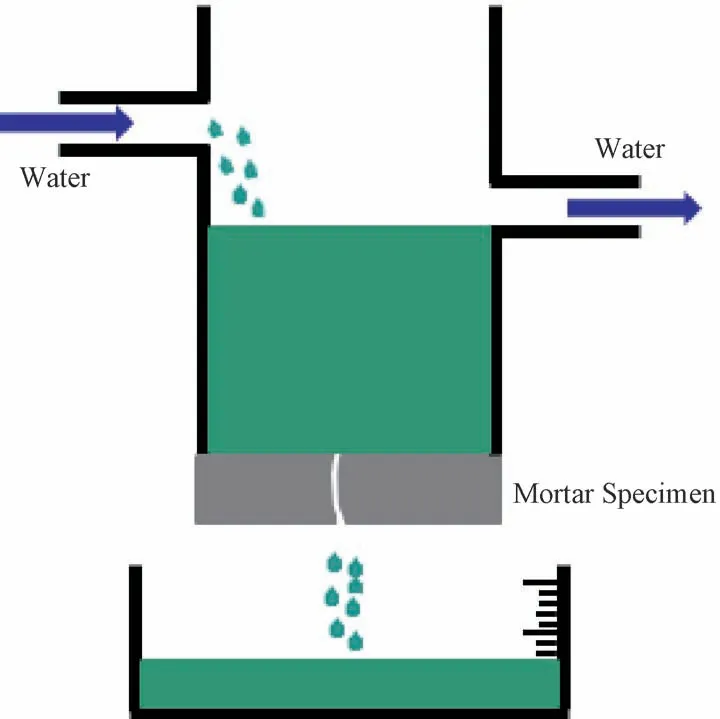
图2 水渗透速度测试示意图Fig.2 Schematic diagram of water penetration rate
式中:λ为裂缝的抗水渗透修复率,V0为未修复时通过砂浆试件的水渗透速度(mL/s),Vt为修复时间t后通过砂浆试件的水渗透速度(mL/s)。
2.12 裂缝区修复产物分析
当砂浆试件裂缝修复时间达到28 d时,将试件裂缝区的修复物质取下,清洗干燥后备用。样品的物相组成采用D/max 2550V 型X 射线衍射仪(XRD)来分析,扫描速度0.02 (°)/s;利用配有能谱仪(EDS)的Nayo Nano SEM 450 场发射扫描电子显微镜(FESEM)分析沉淀物的形貌和元素组成。
3 结果与讨论
3.1 微生物的生长情况与形貌观察
图3是微生物培养过程中细菌的生长曲线和培养基溶液中pH 值的变化。从中可以看出,在0~12 h区间内,细菌生长缓慢,此时细菌处于迟缓期阶段;当培养时间达到12 h后,细菌繁殖增快,细菌体数目呈对数式增长,表明此阶段细菌位于对数增长期。在48~76 h区间内,细菌的繁殖速度趋于稳定,新增细菌数目与死亡细菌数目达到一个动态平衡,表明细菌已处于稳定期阶段。当培养时间达到76 h后,由于培养液中营养物质的减少,以及细菌生长繁殖过程中有害代谢产物的增加,细菌死亡数目大幅度升高,繁殖生长能力大大降低,表明细菌已进入衰亡期。此外,在细菌生长过程中,培养基溶液中的pH 值呈现先降低后升高的趋势,在36 h 时最低pH 值达到5.4。造成pH 值变化的原因是细菌在新陈代谢过程中会产生CO2,同时大气中的CO2气体溶解于培养基中,故而在早期细菌繁殖过程中培养基溶液的pH 值呈现弱酸性,引起pH 值的下降[31]。随后,细菌生长过程中产生的脲酶会促进尿素的分解,在培养基中会形成OH-,从而造成培养基溶液的pH 值上升。
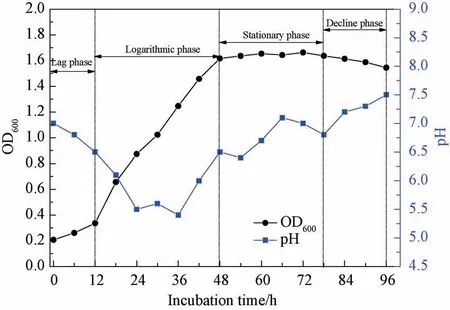
图3 巴氏芽孢杆菌的生长曲线及培养液pH 值的变化Fig.3 Growth curve of Bacillus pasteurii and pH changes in the culture medium
图4是细菌营养体的光学显微镜(OM)和扫描电子显微镜(SEM)图片,观察可知,所得细菌营养体呈现短杆状,圆柱形,长度约为2.0~3.0 μm。

图4 细菌营养体的OM 图像(a)和SEM 图像(b)Fig.4 Bacterial vegetative cells (a) OM micrograph; (b) SEM image
3.2 温度对微生物生长情况的影响
图5是不同温度下微生物的生长情况。从图中可以看出,从低温到高温,随着培养温度的升高,微生物的生长繁殖情况有显著差异。在低温时(5 ℃),微生物几乎不生长,当温度逐渐升高时,细菌生长繁殖逐渐加快。温度升高到25 ℃时,细菌的OD600峰值最高,而后随着温度继续升高,微生物生长情况受到显著影响,OD600峰值下降,温度达35 ℃时,细菌的生长受到一定程度的抑制,上述结果表明微生物的生长明显受到温度影响。当培养温度为25 ℃时,微生物的生长情况最好。而当外界温度过高时,微生物中的蛋白质等会因热作用而变性失活,导致细菌死亡[26,31]。若温度过低,此时细菌的代谢活动降低,处于休眠状态,不再生长繁殖,但可以维持细菌的活性,因此低温环境下有助于保存微生物菌液。总体来说,25 ℃是细菌生长的最佳温度。

图5 不同温度下细菌的生长情况Fig.5 Growth of bacteria at different temperatures
3.3 培养液初始pH 值对微生物生长的影响
不同初始pH 值下测得的微生物菌液的OD600值如图6所示。从图可见,微生物的最佳生长pH 值为7.0~10.0,在此范围内,细菌生长繁殖良好。而后随着pH 值的升高,细菌的生长受到抑制,当pH 值达到13.0时,细菌几乎不再生长。主要原因可能是pH 值会影响细菌细胞膜的通透性,进而影响细菌对营养物质的吸收,最终影响细菌的新陈代谢。此外,当水泥基材料产生裂缝时,水和空气的进入会降低裂缝区溶液的pH 值,致使裂缝区水溶液的pH 值为8.0~11.0[29,32]。因此,该细菌可以在水泥基材料裂缝区溶液中生长繁殖,进行矿化反应来修复裂缝。
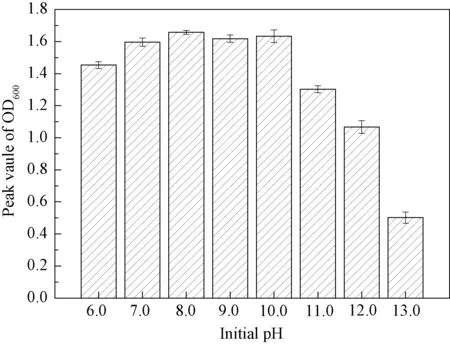
图6 菌液不同初始pH 值下细菌的生长情况Fig.6 Growth of bacteria at different initial pH values
3.4 培养液中Ca2+浓度对微生物生长情况的影响
不同Ca2+浓度对微生物生长情况的影响如图7所示。从图可见,随着Ca2+浓度的增加,细菌的生长情况有所不同。当Ca2+浓度在0~90 mM 时,细菌生长情况良好;而当Ca2+浓度升高到120 mM 时,细菌生长受到一定程度的抑制;继续增加到150 mM,微生物菌液的OD600值急剧下降;当Ca2+浓度达到180 mM 以后,细菌几乎不再生长。该实验结果表明,细菌的生长存在一个合适的菌液Ca2+浓度范围,当Ca2+浓度过高时,细菌的生长会受到严重抑制。其主要原因可能是Ca2+浓度会影响微生物细胞周围的渗透压,当Ca2+浓度过高时,细菌会因细胞脱水而失活,进而影响微生物的存活[31,33-34]。故而菌液最佳的Ca2+浓度范围为0~90 mM。
3.5 微生物诱导碳酸钙沉淀(MICP)的矿化过程
图8是不同培养时间下培养基溶液的pH 值和离子浓度变化。从图中可知,对于未加菌组来说,培养液的pH 值和Ca2+浓度随时间增长而缓慢降低(图8a),这可能是大气中的CO2溶解在培养液中造成的,主要发生的是碳化反应过程。此外,NH4+ 浓度在80~110 mM 上下浮动,主要是培养基中的尿素在灭菌过程中分解造成的。然而,当加入微生物后,从图8(b)可以看出培养基中MICP过程可分为三个阶段。在第一个阶段(0~24 h),pH 值缓慢降低,并且部分游离Ca2+被消耗沉淀。此外,NH4+浓度缓慢升高,与图8(a)相比,pH 值和Ca2+及NH+4浓度的变化趋势一致。图9中的钙化速率也表明,在前24 h内,未加菌组和加菌组培养基中的钙化速率几乎相同。因此,可以认为第一阶段主要发生的是碳化反应,与微生物关系不大,是化学沉淀反应。第二阶段(24~60 h)是微生物矿化的主要阶段。经过60 h 后,溶液中的游离Ca2+基本被消耗完毕,生成了CaCO3沉淀。可能发生的生物矿化反应如下[35-37]:
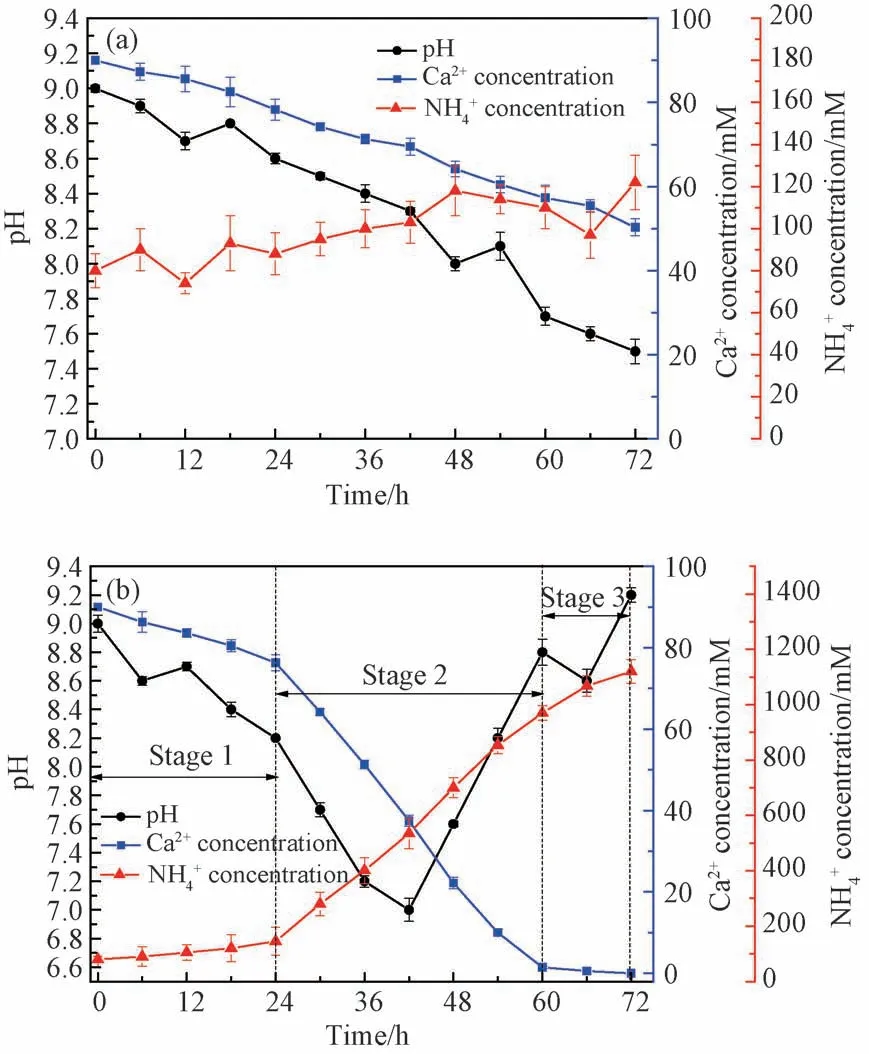
图8 培养液中pH 值和离子浓度的变化 (a) 无细菌;(b) 有细菌Fig.8 Changes of pH value and ion concentration in medium(a) without bacteria; (b) with bacteria

图9 不同培养时间下钙化速率的变化Fig.9 Changes of calcification rate under different culture time
在24~60 h内,细菌大量繁殖,脲酶活性高,在脲酶的催化作用下,培养基中会生成大量的CO2-3,致使溶液中的可溶性Ca2+被大量快速沉淀。此外,由于的持续消耗,以及H+的产生,导致溶液中pH值快速降低。而后当Ca2+消耗完毕后,CO2-3的累积会导致溶液中的pH 值升高呈碱性,同时,在脲酶的催化作用下,NH4+快速增加。总的来说,第二阶段中的酶催化作用是引起CaCO3沉淀的关键因素。在第三阶段,游离Ca2+全部被消耗完毕,细菌继续产生脲酶,分解尿素来生成NH4+,同时生成OH-,从而导致浓度和溶液pH 值的升高[20]。
图9中的钙化速率结果表明,未加菌组的钙化速率基本维持不变,约为0.40 mM·h-1。加入微生物后,前24 h的钙化速率与未加菌组类似,而后随着培养时间的延长,钙化速率快速增加,在54 h达到最大;随后,可溶性Ca2+被消耗完毕,致使钙化速率有所降低。总的来说,该脲解型微生物可以诱导CaCO3沉淀,并加速CaCO3的形成过程,表明其在水泥基材料裂缝修复中的作用具有可靠的理论支撑。
3.6 砂浆裂缝修复效果观察与分析
3.6.1 面积修复率 不同组砂浆试件裂缝修复前后的照片如图10所示。从图可见,基准组砂浆的裂缝经过28 d修复后有所减小,这主要是由于试件内部水泥颗粒的二次水化所致[2]。而裂缝表面仅有少量的白色物质生成,这主要是大气中的CO2溶于裂缝区碱性溶液中产生碳化反应所致[38]。而微生物组砂浆裂缝经过28 d的干湿循环修复,裂缝口处有大量白色物质生成。采用数值二值化处理后的图像如图11所示,依据此图像计算出像素值,面积修复率如图12所示。结果显示,不同修复时间下的裂缝面积修复率是不同的,且呈现逐渐升高的趋势,当裂缝修复时间达到28 d后,基准组砂浆和微生物组砂浆裂缝的面积修复率分别为5.3%和99.2%。相同时间下微生物组砂浆裂缝的面积修复率明显高于基准组砂浆,表明采用微生物矿化技术可以提高裂缝的自修复效果。

图10 不同砂浆试件裂缝修复前和28 d修复后裂缝的图片Fig.10 Crack pictures of different mortar specimens before and healing for 28 d

图11 不同砂浆试件裂缝修复前和28 d修复后裂缝经二值化处理后的图像Fig.11 Binary treatment pictures of cracks of different mortar specimens before and healing for 28 d

图12 不同修复时间下不同砂浆裂缝的面积修复率Fig.12 Area repair ratio of different mortar cracks under different healing time
3.6.2 抗水渗透修复率 图13是根据式(3)计算出的抗水渗透修复率数据。从图可见,两组试件的抗水渗透修复率随着修复时间的增加都呈现逐渐升高的趋势,但基准组砂浆试件的抗水渗透修复率变化很小,这可能是裂缝内部未水化水泥颗粒的二次水化造成裂缝内部的封堵,与面积修复率的变化相一致,裂缝表面未被修复,其抗水渗透修复率较低。对于微生物组砂浆试件来说,经过28 d的干湿循环修复后,微生物组砂浆试件的抗水渗透修复率高达95%,这主要是裂缝表面被白色物质填充,抗渗水性能得到提高之故。与面积修复率相比,由于抗水渗透修复率反映的是裂缝内部被填充物填充的情况及裂缝修复后的充盈程度,而面积修复率则是直观反映裂缝表面的修复情况。裂缝表面修复越好,抗水渗透修复率亦会越高,亦即裂缝的抗渗水性能就越好[39]。

图13 不同修复时间下砂浆试件的抗水渗透修复率Fig.13 Anti-penetration repair ratio of different mortar cracks under different healing time
3.7 裂缝区白色物质的SEM 表征
基准组和微生物组砂浆试件裂缝区白色物质的SEM 照片如图14 所示。从图可见,基准组试件(图14a)表面的白色物质是不规则小颗粒,且四处分散无规律,而微生物组的(图14b)则是由大量立方块和少量圆球颗粒团聚而成的不规则形状的大颗粒,且堆积程度密实。EDS检测结果(图15)表明两组砂浆试件裂缝区的白色物质主要由C、O 和Ca三种元素组成,表明该白色物质为CaCO3,而XRD 分析结果(图16)表明裂缝区的CaCO3主要是方解石。

图14 修复28 d后裂缝区白色物质的SEM 图像 (a) 基准组;(b) 微生物组Fig.14 SEM images of white substances at the crack mouth after healing for 28 d (a) reference group; (b) microbial group

图15 修复28 d后裂缝区白色物质的EDS能谱 (a) 基准组;(b) 微生物组Fig.15 EDS spectrum of white substances at the crack mouth after healing for 28 d (a) reference group; (b) microbial group

图16 修复28 d后裂缝区白色物质的XRD图谱Fig.16 XRD patterns of white substances at the crack mouth after healing for 28 d
3.8 微生物砂浆裂缝自修复机理
微生物自修复混凝土是将微生物自修复剂在拌和过程中加到混凝土中,以达到裂缝自动修复的目的。当砂浆试件产生裂缝后,水和空气的进入会降低砂浆试件裂缝区溶液的pH 值,最终达到8.0~10.0[29,32],从而促进细菌的生长。在细菌代谢过程中,会产生脲酶,此外还可以产生部分CO2,在脲酶的催化作用下,大量生成CO2-3,亦即CaCO3生成必需的。此外,由于砂浆试件裂缝区溶液中含有大量Ca2+,这些Ca2+会通过静电作用吸附到微生物细菌体表面,而微生物作为CaCO3沉积的成核位点,有利于降低结合能,从而促进方解石晶型的CaCO3生成,以此来实现裂缝自修复的效果。具体的裂缝修复过程示意图如图17 所示,裂缝修复过程发生的反应如下所示:
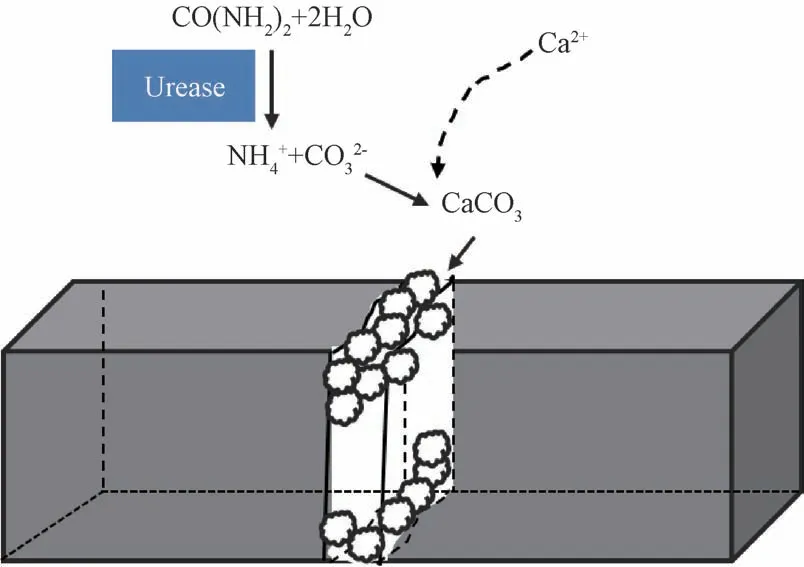
图17 微生物砂浆试件裂缝的自修复机理Fig.17 Self-healing mechanism of cracks in in mortar specimens
① 细菌在新陈代谢过程中会产生脲酶,在脲酶的作用下,生成大量CO2-3:
② 带负电的微生物细菌体通过静电作用吸附Ca2+聚集在细菌体表面:
③ 同时,作为成核位点的微生物菌体会降低结合能,使得CaCO3快速生成:
4 结 论
本研究选用一种在新陈代谢过程中可产生脲酶的脲解型微生物,适合于该微生物生长的最佳温度、初始pH 值和Ca2+浓度分别为25℃,7.0~10.0 和0~90 mM。微生物矿化实验结果表明,加入微生物后,在脲酶的催化作用下,产生的CO2-3会促使溶液中的游离Ca2+浓度快速降低,并提高CaCO3的生成速率。此外,砂浆试件裂缝自修复效果表明,该微生物自修复剂对早期裂缝具有良好的自修复功能,经检测砂浆试件裂缝区的白色产物是方解石CaCO3。最后,揭示了砂浆试件裂缝的的自修复机理。总之,本研究为MICP应用于水泥基材料早期裂缝的修复提供了一定理论依据。
