以钯-铜为核的共价有机框架在化疗和光热协同抗肿瘤中的应用
2023-12-01叶丽莉梁家宁
叶丽莉,王 丽,梁家宁,孙 琳,董 妍
(遵义医科大学珠海校区 生物工程学院,广东 珠海 519041)
当前,癌症仍然是威胁人类健康的第一杀手。针对癌症的治疗方法日益增多,但化学疗法仍然是最为主流的治疗方法[1-4]。这种疗法对癌细胞毒性强、见效快、可以直接杀死癌细胞,它的不足是缺乏对癌细胞的靶向性,会对人体产生较强的毒副作用。光热疗法[5]是利用光能转化为热能对癌细胞造成损伤,即当温度升至42 ℃以上时,使细胞发生不可逆的损伤从而起到治疗效果,具有治疗时间短且无毒无害,对人体副作用小的优点,其缺点在于对癌细胞的消灭不够彻底[6]。近年来兴起的纳米载药技术可以在一定程度上改善药物化疗与光热疗法等单一疗法的缺陷。
纳米载体主要包括有机纳米载体,无机纳米载体与金属纳米载体等[7-8]。共价有机框架(covalent organic frameworks, COFs)[9-10]是由轻元素(C、H、O、N、B等)通过共价键构筑而成的多孔材料,具有较低的密度,较高的热稳定性以及较大的比表面积等优点。这些特点赋予该材料在抗肿瘤方面的应用潜力,可将光热剂[11-13]、光敏剂[14-15]及化疗药物[16-18]等封堵在孔道中,再通过对COFs的修饰达到多重功效治疗的目的[19-22]。
在本研究中,以COF-300作为纳米载体,醛胺缩合得到的COF-300具有高度结晶性及较高的比表面积[23-24]。COF-300的多孔结构,孔径大小足以装载药物分子、光热剂等。通过优化条件对COF-300粒径进行调控。采用具有光热转换效率的Pd-Cu合金纳米粒为核,COF-300为壳,构建复合体系从而达到光热治疗的目的;以盐酸阿霉素(doxorubicin hydrochloride,DOX)作为模型药物,将药物封装至COF-300孔道内,原位合成法引入pH敏感的ZIF-8进行外修饰使得该纳米载药体系具有控释性能。最后修饰叶酸碳点,赋予该材料对叶酸受体[25-27]有强烈表达的癌细胞的治疗作用。在该研究中,对所构建纳米载药平台的结构进行了详尽的表征,对以DOX为模型药物在不同条件下的药物释放性质进行探究,并对其光热性质进行测试,计算光热转换效率。最后通过体外细胞毒性实验评估所构建纳米平台的抗肿瘤作用。
1 材料与方法
1.1 材料
1.1.1 试剂 盐酸阿霉素(C27H29NO11·HCl,98%,阿拉丁);对苯二甲醛(C8H6O2,98%,阿拉丁);2-甲基咪唑(C4H6N2,98%,阿拉丁);六水硝酸锌[Zn(NO3)2·6H2O,阿拉丁];四氯钯酸钠(Na2PdCl4,98%,麦克林);五水硫酸铜(CuSO4·5H2O,99%,麦克林);L-抗坏血酸[C6H8O6,麦克林];聚乙烯吡咯烷酮[(C6H9NO)n,麦克林];四(4-氨基苯基)甲烷(C25H24N4,97%,百灵威);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(C18H16BrN5S,艾斯金);二甲基亚砜(C2H6SO,麦克林);二氧六环(C4H8O2,麦克林);四氢呋喃(C4H8O,麦克林)。
1.1.2 仪器 紫外分光光度计[安捷伦科技(中国)有限公司];倒置显微镜(重庆奥特光学仪器有限公司);酶标仪(美国赛默飞世尔科技公司);红外热像仪(美国菲力尔公司)。
1.1.3 实验细胞 A549细胞(人非小细胞肺癌细胞)、MCF-7细胞(人乳腺癌细胞)购自武汉普诺赛生命科技有限公司。
1.2 方法
1.2.1 Pd-Cu合金纳米颗粒的合成 称取350 mg 聚乙烯吡咯烷酮、200 mg L-抗坏血酸和73 mg CuSO4·5H2O 于50 mL圆底烧瓶中,并加入30 mL超纯水溶解,在恒温磁力搅拌器中使溶液充分混匀。随后加入10 mL含有190 mg的Na2PdCl4的水溶液。将溶液升温至80 ℃后,搅拌3 h形成黑色沉淀。采用超滤离心管通过多次离心(4 000 r/min,10 min,25 ℃)分离固体产物,用超纯水洗涤3次,将样品真空冷冻干燥即获得样品Pd-Cu合金纳米颗[28]。
1.2.2 COF-300制备 取四(4-氨基苯基)甲烷60 mg、对苯二甲醛36 mg于25 mL高压反应釜中,加入3 mL无水二氧六环搅拌溶解。最后加入0.4 mL 3M 乙酸水溶液。100 ℃静置24 h后将产物进行抽滤,并用二氧六环与四氢呋喃多次洗涤浸泡。最后经过真空干燥获得样品COF-300粉末。
1.2.3 叶酸碳点的制备 称取叶酸20.68 mg加入到氨-水悬浮液中(10 mL氨水与30 mL超纯水混匀)。将悬浮液用250 W(40 kHz)下超声3 h。最后用透析袋(截留分子量为8~14 kD)透析48 h,得到叶酸碳点[29],标记为FA。
1.2.4 Pd-Cu@COF-300@DOX@ZIF-8-FA的制备 称取Pd-Cu合金纳米颗粒配置成1 mg/mL水溶液。将30 mg Zn(NO3)2·6H2O和30 mg COF-300用3 mL甲醇分散,振荡24 h,抽滤室温干燥。之后加入0.5 mL 1 mg/mL Pd-Cu合金纳米颗粒水溶液、1.6 mL 10 mmol/L DOX 甲醇溶液与2 mL含有66 mg 的2-甲基咪唑甲醇溶液,再加入1 mL FA水溶液。振荡10 min后静置24 h。最后将所得产品进行抽滤,定量甲醇淋洗,40 ℃真空干燥。所得样品即为Pd-Cu@COF-300@DOX@ZIF-8-FA。利用紫外可见光谱法计算载药量。按以下公式计算:

1.2.5 颗粒光热转换效率考察 将纳米颗粒配成终体积为1 mL的具有一定浓度梯度(1.0、0.8、0.5、0.4 mg/mL)的悬浮液,用808 nm的激光器在不同功率下照射 10 min,用红外热像仪记录温度的变化情况。光热效率(η)计算公式[30]如下:
I是激光功率(2.0 W/cm2);A是水悬浮液在808 nm波长处的吸光度;Tmaterial和Twater分别代表试样和空白试样的温度变化;h是传热系数,s是容器的表面积,它们由下公式确定:
m是溶液的质量;c为溶剂的比热容(水为4.2 J/(g·℃);τs是时间常数,可以在冷却时间内根据以下公式确定:
t=-τsln(θ)
θ是与时间相关的无量纲参数,称为驱动力温度,定义如下:
TMax和TSurr(27 ℃)分别是最大稳态温度和环境温度。
1.2.6 不同pH缓冲液中释放行为考察 DOX的pH响应控制释放研究在37 ℃下按照pH梯度(pH为5.0及7.4)进行。将4 mg Pd-Cu@COF-300@DOX@ZIF-8-FA分别分散于2 mL不同pH缓冲液中。通过紫外可见分光光度法定时测量从颗粒中释放至上清液中游离的DOX 的吸光度。以时间-释放百分比为横纵坐标制作Pd-Cu@COF-300@DOX@ZIF-8-FA在不同 pH值的缓冲液中的释放动力学曲线。
1.2.7 体外细胞毒性考察 采用MTT法考察样品在MCF-7、A549两种细胞中的细胞毒性。黑暗条件下:将细胞按约1×104个/孔接种到96孔板中,在培养箱中孵育48 h,每24 h更换1次新鲜培养基,然后加入不同浓度的纳米颗粒,孵育24 h;每孔加100 μL 1 mg/mL的MTT溶液。继续孵育4 h,弃上清后加入150 μL DMSO,在酶标仪上用490 nm测量吸光度。光学条件下:将细胞按约1×104个/孔接种到96孔板中,在培养箱中孵育48 h,每24 h更换1次新鲜培养基,然后加入不同浓度的纳米颗粒,孵育4 h;808 nm激光以2 W/cm2辐照10 min,孵育24 h;每孔加100 μL 1 mg/mL的MTT溶液。继续孵育4 h,弃上清后加入150 μL DMSO,在酶标仪上用490 nm测量吸光度。
细胞活力由以下公式计算:
为了直观表征Pd-Cu@COF-300@DOX@ZIF-8-FA对MCF-7细胞的生存抑制作用,选择Hoechst 33342和PI染料对上述细胞进行活死细胞染色,其中Hoechst 33342使所有细胞显示蓝色荧光,PI则使死细胞显示红色荧光。具体操作如下:在上述细胞毒性研究中,细胞与复合材料共孵育结束后,加入Hoechst 33342和PI染料,继续孵育15 min,去上清后用PBS洗涤2次以去除多余染色剂,使用荧光显微镜观察并记录。
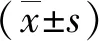
2 结果
2.1 复合材料形貌表征结果 采用SEM与TEM对制备的纳米材料的形貌特征进行研究。如图1A、B所示,TEM图像显示了Pd-Cu合金纳米粒优异的单分散性,且合成的Pd-Cu合金纳米粒的粒径为5~10 nm,图1C高分辨TEM显示该纳米合金颗粒具有明显的晶格结构且能谱分析图证实该纳米合金具有Pd元素与Cu元素。COF-300是一种纺锤形的亚胺类COFs,传统方法制备得到的产品粒径约为1 μm。显然如此大尺寸的颗粒不利于药物递送。因此通过优化实验条件对COF-300纳米颗粒的粒径进行调控。经过条件优化发现当催化剂3 mol/L乙酸用量为0.4 mL,反应时间为24 h,反应温度为100 ℃时,其纳米尺寸减小至约300 nm且纳米颗粒大小均匀,可用于接下来的结构组装(图2A、D)。SEM(如图2B、E)与TEM(图2C、F)图像显示一步法合成的 Pd-Cu@COF-300@DOX@ZIF-8-FA仍具有较好的分散性,且相比较于Pd-Cu合金纳米粒,经过COF-300的包裹与ZIF-8的修饰之后,复合材料仍保持COF-300的纺锤形。此外,复合材料的X-射线衍射图谱(XRD,图2G)观察到COF-300及ZIF-8的特征峰,进一步说明复合结构的成功制备;复合材料水溶液均一稳定(图2G),为了进一步的探究其时间稳定性,复合材料在室温、空气中保存6个月后进行测试,XRD结果显示其特征峰仍明显,表明样品结构没有发生明显变化,具有良好的稳定性。由荧光发射光谱(图2H)可知,在365 nm的激发下,FA的发射峰位于448 nm,而Pd-Cu@COF-300@DOX@ZIF-8-FA在365 nm的激发下其发射峰红移至469 nm处。综上可证实Pd-Cu@COF-300@DOX@ZIF-8-FA被成功合成。
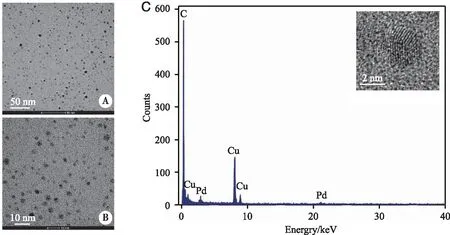
A:TEM图像;B:TEM高倍图;C:能谱分析图,内插图为高分辨TEM。图1 Pd-Cu合金纳米粒的TEM及能谱

A、D:COF-300的SEM,A(EHT=5.00 kV Signal A=SE2 Mag=5.00 KX WD=7.6 mm),D(EHT=5.00 kV Signal A=SE2 Mag=30.00 KX WD=7.6 mm);B、E:Pd-Cu@COF-300@DOX@ZIF-8-FA 的SEM,B(EHT=5.00 kV Signal A=SE2 Mag=5.00 KX WD=9.3 mm),E(EHT=5.00 kV Signal A=SE2 Mag=30.00 KX WD=9.3 mm);C、F:Pd-Cu@COF-300@DOX@ZIF-8-FA的TEM;G:样品的XRD图谱,紫色代表Pd-Cu@COF-300@DOX@ZIF-8-FA-after 6 months,蓝色代表Pd-Cu@COF-300@DOX@ZIF-8-FA,黑色代表COF-300,红色代表ZIF-8 Simulated;H:样品的荧光光谱图,黑色代表FA,红色代表Pd-Cu@COF-300@DOX@ZIF-8-FA;I:不同条件下DOX的释放曲线。图2 样品的SEM、TEM、XRD、荧光光谱及药物释放曲线
2.2 复合材料的载药性能结果 由于COF-300具有丰富的孔道结构,药物分子可以通过吸附进入COF-300孔道内,达到装载药物的目的。本研究采用广谱抗癌药物盐酸阿霉素作为模型药物,实验结果表明载药量为(19.50±0.77)%。对其进行药物释放性质研究,如图2I所示,通过控制近红外光(Near-infrared, NIR)辐照与pH条件,观察到在无NIR辐照且pH为5.0的条件下,156 h后药物的释放量为(83.62±10.14)%,明显高于无NIR辐照且pH为7.4的条件下的释放量(35.34±3.12)%。而在NIR辐照且pH为5.0的条件下,156 h后药物释放量高达(92.94±2.14)%,药物几乎释放完全;在NIR辐照且pH为7.4的条件下释放量为(57.78±9.04)%,均高于无NIR辐照组。究其原因,是由于封堵在COF-300@DOX外的ZIF-8在pH为5.0的条件下发生结构崩塌从而使DOX释放导致的。加入NIR辐照后,体系的温度升高也会导致药物加速释放。
2.3 复合材料的光热性能结果 研究证实Pd-Cu合金纳米粒光热性质良好。如图3A所示,在2.0 W/cm2的808 nm激光辐照10 min后,浓度为1 mg/mL的Pd-Cu合金纳米粒温度稳定上升46.4 ℃,而在相同条件下水的温度基本保持不变。经过自组装后,1 mg/mL的Pd-Cu@COF-300@DOX@ZIF-8-FA在相同的NIR条件下(2.0 W/cm2,808 nm,10 min)照射,该材料温度升高了19.8 ℃(如图3B),Pd-Cu合金纳米颗粒与Pd-Cu@COF-300@DOX@ZIF-8-FA均随着功率的增加温度逐渐升高,表明其光热性能与功率密度呈现正相关性(图3C、D)。消光系数是评价材料光吸收性能的重要指标。经计算,该复合材料的消光系数为6.6 L/g/cm。根据Pd-Cu@COF-300@DOX@ZIF-8-FA水溶液的升温和冷却周期曲线及冷却时间与-Ln (θ)之间的关系图(图3E、F),经计算,其光热转换效率为8.56%。

A、C:Pd-Cu;B、D:Pd-Cu@COF-300@DOX@ZIF-8-FA 在808nm近红外光辐照下的温度变化曲线;E:Pd-Cu@COF-300@DOX@ZIF-8-FA水溶液(1 mg/mL)的辐射加热和冷却周期;F:Pd-Cu@COF-300@DOX@ZIF-8-FA的冷却时间与-Ln (θ)之间的关系。图3 材料的光热性质曲线
2.4 复合材料的细胞毒性实验结果 通过MTT法研究Pd-Cu@COF-300@DOX@ZIF-8-FA的细胞毒性。从图4A表明,在黑暗条件下,当浓度大于62.5 μg/mL时,复合材料开始表现出明显的细胞毒性。随着样品浓度的升高,细胞存活率降低。当样品浓度达到125 μg/mL时,A549细胞的存活率为(48.43±3.88)%,而MCF-7细胞的存活率仅为(27.88±4.23)%,表明在相同的浓度下,Pd-Cu@COF-300@DOX@ZIF-8-FA对MCF-7细胞的细胞毒性更大。在光学条件下,使用同等浓度的材料对细胞进行处理,A549+NIR组的细胞存活率为(37.68±5.37)%,而MCF-7+NIR组细胞活力仅为(22.05±0.4)%(图4B)。以上结果表明Pd-Cu@COF-300@DOX@ZIF-8-FA对在叶酸受体表达量高的MCF-7细胞的毒性大于叶酸受体表达量低的A549细胞。为探究复合材料本身对细胞产生的影响,将不含DOX的复合材料(Pd-Cu@COF-300@ZIF-8-FA)作用于A549与MCF-7细胞,实验结果显示纳米粒浓度越高,对细胞的杀伤作用越大,但对细胞的杀伤作用低于含DOX的复合材料,且在不同FA受体的细胞中,呈现的实验结果与含DOX的复合材料一致(图4C)。进一步通过Hochest 33342与PI双染法(Hochest 33342蓝色与PI红色)验证Pd-Cu@COF-300@DOX@ZIF-8-FA对癌细胞的杀伤作用(图4D)。与阴性组相比较,Pd-Cu@COF-300@DOX@ZIF-8-FA与MCF-7细胞共孵育组中观察到强烈的红色荧光,表明与阴性组相比,药物组处理后死亡细胞增多,实验结果与细胞毒性实验结果呈现一致性。

A:黑暗条件下Pd-Cu@COF-300@DOX@ZIF-8-FA与细胞共培养的细胞活力;B:添加激光照射条件(808 nm,2 W/cm2,10 min)Pd-Cu@COF-300@DOX@ZIF-8-FA与细胞共培养的细胞活力;C:黑暗条件下Pd-Cu@COF-300@ZIF-8-FA与细胞共培养的细胞活力;D:Pd-Cu@COF-300@DOX@ZIF-8-FA与MCF-7细胞共孵育1 h的细胞荧光图像,(比例:200 μm,×200);*、**、***:P< 0.05、P<0.01、P<0.001。图4 样品在不同条件下与细胞共培养的细胞活力及荧光图像
3 讨论
氧化还原法合成的Pd-Cu合金纳米颗粒大约在5~10 nm,超小尺寸纳米颗粒具有较强的扩散能力,有利于往肿瘤内部渗透[31]。Pd-Cu合金纳米颗粒的TEM照片与能谱分析图确定Pd-Cu合金纳米颗粒被成功合成。光热实验结果显示,相较于其他的合金颗粒其光热性质良好,可以作为光热剂使用[32-34]。Pd-Cu@COF-300@DOX@ZIF-8-FA的SEM与TEM显示其粒径约300 nm。通过Pd-Cu@COF-300@DOX@ZIF-8-FA的XRD图谱,观察到COF-300的特征衍射峰、ZIF-8的特征衍射峰,表明复合材料中COF-300和ZIF-8的成功合成;复合材料的荧光光谱分析图谱中观察到FA的最大吸收峰发生红移,是由于在复合材料中DOX影响其最大吸收[35],以及存在的Pd、Cu元素的掺杂[29]。以上实验结果证实Pd-Cu@COF-300@DOX@ZIF-8-FA成功合成。对材料进行光热性质测试表明,将1 mg/mL的复合材料水溶液在功率密度为2 W/cm2条件下照射10 min后温度上升了19.8 ℃,其实际温度高于肿瘤细胞杀伤温度[36],可以用于抗肿瘤研究。
为了观察复合材料在体内药物释放情况,利用不同pH缓冲溶液模拟体内生理环境与肿瘤微环境[37-38],进行体外药物释放实验。实验结果表明,该复合材料在pH为5.0以及NIR条件下,DOX累计释放量最大,其主要原因为酸性条件下ZIF-8不稳定发生分解[39],使得封堵在COF-300孔道内的药物分子释放,达到了药物pH响应控释的目的。细胞毒性实验结果证实,在叶酸表达量高的MCF-7细胞中,其细胞杀伤力更大。加入NIR后,与未加NIR结果呈现一致性,即Pd-Cu@COF-300@DOX@ZIF-8-FA复合材料对叶酸受体表达阳性的MCF-7细胞的细胞生长的抑制作用要强于叶酸受体表达阴性的A549细胞。该复合材料表现出了良好的肿瘤杀伤性。
本研究将合成的超小尺寸的Pd-Cu合金纳米粒光热剂为核,以具有多孔结构的COF-300为壳,负载抗癌药物DOX;利用pH敏感的ZIF-8对药物进行封堵并修饰FA,构建了pH敏感控释的光热联合化疗抗肿瘤治疗系统。综上所述,本文成功制备了基于COFs的多功能纳米载体,在光热联合化学疗法抗肿瘤领域显示出优异的性质。
