五味子甲素通过SIRT1/NF-κB通路减轻脑出血后星形胶质细胞焦亡的机制
2023-12-01车益军于欣宇王丽芳姚声涛
车益军,韩 冲,于欣宇,刘 潜,王丽芳,张 鹏,曹 芳,姚声涛
(1.遵义医科大学附属医院 神经外科二病区,贵州 遵义 563099;2.遵义市播州区人民医院 神经外科,贵州 遵义563100;3.遵义医科大学附属第二医院 神经外科,贵州 遵义 563006)
自发性脑出血(intracranial hemorrhage,ICH)是一种严重致死致残性疾病,目前尚无明确有效治疗脑出血的药物[1],亟需探索治疗药物及治疗靶点。脑出血后细胞死亡机制包括血肿的直接压迫破坏作用和继发性损伤,其中焦亡被认为最具潜力的继发性损伤机制治疗靶点[2]。星形胶质细胞是颅内最多数的神经细胞,具有广泛的生物学意义[3]。脑出血后星形胶质细胞发生细胞焦亡,GSDMD在 ICH 后细胞焦亡中起着最关键的作用[4]。NLRP3/Cappase-1/GSDMD为焦亡最经典通路[5]。ICH后星形细胞中NLRP3炎症通路被激活[6]。脑出血后星形胶质细胞中NF-κB P65信号通路激活,IL-1β炎症激活[7]。本课题组前期研究结果证实抑制NLRP3表达可以减轻小鼠脑出血并减少C-Cas-1表达及小胶质细胞炎症反应[8]。烟酰胺腺嘌呤二核苷酸依赖的去乙酰化酶(silent information regalator 1,SIRT 1)通过对靶蛋白去乙酰化发挥作用,其可通过对p65去乙酰化调控细胞炎症[9]。王毅团队对中药195 种不同化合物进行筛选,发现五味子甲素(schisandrin A,SchA)是SIRT1最强激活剂之一[10],具有减轻细胞焦亡作用[11]。SchA能否通过调控SIRT1蛋白表达在脑出血后发挥神经保护作用尚未见报道,本研究拟通过五味子甲素治疗脑出血,探讨SIRT1、NF-κB在脑出血后发挥神经保护及减轻星形胶质细胞焦亡机制。
1 材料与方法
1.1 主要试剂与仪器 SchA、EX527购自美国MCE公司;TritonX-100、抗荧光衰减封片剂、RIPA高效裂解液、BCA 定量试剂盒、5×上样缓冲液、牛血清白蛋白BSA-Ⅴ、蛋白酶抑制剂均购自北京Solarbio公司;4 %多聚甲醛、购自安徽Biosharp公司;胎牛血清、DMEM/F12培养基购自美国Gibco公司;胶原酶Ⅶ购自美国Sigma公司;Omni-ECL 超灵敏化学发光检测试剂盒购买自上海雅酶公司;山羊抗小鼠二抗、山羊抗兔二抗、Anti-GFAP抗体均购买自杭州华安公司;Anti-NLRP3 抗体、Anti-SIRT1 抗体、Anti-GSDMD抗体均购买自英国Abcam公司;乙酰化(k310)NF-κBp65多克隆抗体、NF-κBp65单克隆抗体购自美国Immunoway公司;Cleaved Caspase-1(asp297)抗体购自美国CST公司;488山羊抗小鼠荧光二抗、488山羊抗兔荧光二抗、594山羊抗小鼠荧光二抗、594山羊抗兔荧光二抗均购自武汉Proteintech公司;胰酶购自美国Hyclone公司;CCK8试剂盒购自美国Abbkine公司;OCT包埋剂购买自美国Sakura公司;二氧化碳培养箱、低速自动离心机、酶标仪、生物安全柜购自美国Thermo公司;高速低温离心机购自中国iCEN-24 R公司;倒置荧光显微镜购自日本Olympus公司;凝胶成像仪、蛋白电泳仪购自美国BIO-RAD公司;恒温水浴箱购自秋佐仪器公司;冰冻切片机购自德国Leica公司;脑立体定位仪购自深圳瑞沃德公司。
1.2 实验动物 SPF级C57BL/6雄性小鼠(10~12周,20~28 g)、C57BL/6雌性小鼠均采购于重庆莱彼特生物科技有限公司。小鼠饲养在遵义医科大学动物中心SPF级动物房,让小鼠自由摄入食物及水,温度(22±1)℃,光暗为12 h交替,所有乳鼠均为SPF级小鼠且在SPF级饲养条件下配种后繁殖获得且均为出生后24 h内乳鼠。本实验操作遵守遵义医科大学附属医院实验动物管理条例,实验方案获得遵义医科大学附属医院动物伦理委员会审批[批号:KLLY(A)-2021-095]。
1.3 脑出血模型建立及分组 C57/BL6小鼠共100只,随机共分5组,每组20只。具体分组:① Sham+ DMSO组;②ICH+DMSO组;③ICH+ SchA(10 mg/kg)组;④ICH+ SchA(20 mg/kg)组;⑤ICH+ SchA(40 mg/kg)5组。Sham组仅进针,不注射胶原酶。参考本课题组成熟建模方法建模[8]。分别于建模后1、3 d对各组小鼠进行相关指标检测及各组间比较。实验过程如造模失败或小鼠死亡,则按步骤重新随机选取实验小鼠补入。
1.4 小鼠转棒疲劳试验 按实验方案将各组小鼠分组并用耳标标记,建模前3 d每天3次,每次10 min在小鼠疲劳转棒仪上预跑以便学习转棒疲劳跑步。随后建模,术后第1、3天在小鼠转棒疲劳仪器上跑步,参数设置为200 s,加速时间设置为200 s,先观察其加速跑步时间,随后设置参数为200 s,加速时间设置为10 s,分别计数跌落时间,跌落时间拷贝后统计分析。
1.5 脑组织切片 建模后24 h的小鼠,0.5 %戊巴比妥深度麻醉后依次剪开上腹部皮肤、肋骨,头皮针插入左心室,剪开右心耳,PBS灌注至右心耳流出清亮液体,随后断头,迅速取出完整脑组织,于小鼠脑切片模具上并放入-20 ℃冰箱20 min,按10 mm每层依次切片,置于蓝色背景纸上拍照。
1.6 冰冻切片染色 (1)制备脑组织冰冻切片:简言之,多脑组织PBS灌注,4 %多聚甲醛灌注,取出的脑组织放入 4 %多聚甲醛溶液中,置于 4 ℃冰箱中固定过夜;20 %蔗糖溶液、30 %蔗糖溶液中继续脱水至沉底;脑组织用冰冻切片包埋剂(OTC)包埋,后置于leica冰冻切片机中切片,切片厚度为 25 μm;切下的脑片置于盛放有PBS的六孔板中,置于4 ℃冰箱待用。(2)HE染色:对切好的脑片,贴片与载玻片上,加入苏木素染色5 min,自来水冲洗后1 %盐水酒精分化数秒,自来水冲洗,0.6 %氨水反蓝,流水冲洗,加入伊红染色2 min,酒精脱水后中性树脂封片,4倍显微镜下观察。(3)免疫荧光染色步骤为:①取出冰冻切片用 PBS泡洗后贴附于粘附载玻片上;②封闭:用含有5 % BSA TBST 液常温下封闭 1 h,封闭之后用TBST 漂洗3次,10 min/次;③孵育一抗:封闭好的脑片放入一抗混合液中,在 4 ℃环境中孵育过夜,孵育完成后漂洗3次,10 min/次[一抗混合液: SIRT1(1∶1 000)+GSDMD(1∶1 000);GFAP(1∶2 000)+GSDMD(1∶1 000)];④孵育二抗:洗涤完成的脑片放入二抗混合液中,在室温下孵育 1 h,孵育完成后TBST漂洗 3 次,10 min /次;⑤孵育 DAPI:洗涤完成的脑片放入 DAPI 稀释液(1∶5 000)中,室温孵育 10 min,孵育完成后漂洗 3 次,10 min/次;⑥室温自然晾干脑片后封片剂封片,待检测;⑦荧光显微镜下观察,并在血肿周围随机选取4个视野进行图像采集。
1.7 Western blot实验 根据参考文献[9]的方法对脑组织进行破碎,裂解并行蛋白印迹检查评估相关蛋白在各组中差异表达情况。
1.8 原代星形胶质细胞提取及实验分组 24 h内出生的C57BL/6乳鼠若干只,实验前未计算具体数目,断头后迅速取出大脑,予以PBS清洗去除血液,于冰上操作,显微镊清除脑膜,维纳斯小梁剪剪碎,0.25 %胰酶消化15 min,中间轻轻摇晃2次,加入DMEM/F-12完全培养基(DMEM/F-12 basic 90 %+FBS10 %)终止消化,添加0.05 %DNA酶裂解破碎细胞DNA减少细胞聚集,800 r/min离心4 min,添加DMEM/F12完全培养基重悬细胞充分后计数,接种于T75细胞培养瓶,每3天传代。传代前充分震荡清除小胶质细胞及少突胶质细胞,至10 d左右对细胞计数后进行下一步实验。将实验分为:① DMSO组:即正常培养的细胞,不采用缺氧及添加Hemin,只添加DMSO;②OGD/H+DMSO组:即予以缺氧1 h,添加Hemin及DMSO处理23 h;③ OGD/H+SchA组;④ OGD/H+SchA+EX527组。
1.9 CCK8测细胞活性 简言之,对96孔板培养的细胞,各组处理完成后,神经元完全培养基与CCk8试剂10∶1混匀,100 μL添加至96孔板中,1 h后酶标仪测CD450吸光度,数据统计并绘图。
1.10 OGD/H建模 体外脑出血模型原代培养的细胞,接种于96孔板中,培养8 h后,按预先实验分组,添加不同浓度的氯高铁血红素,同时按不同缺氧时间组,制作不同的96孔板,按缺氧时间加上添加高铁血红素时间共培养24 h, CCK8测定细胞活性。
2 结果
2.1 脑出血建模及相关蛋白检测 用胶原酶Ⅶ建立小鼠脑出血模型。如图1A为所使用的SchA化学结构式[11]。图1B为建模后脑组织切片显示血肿位于左侧纹状体(厚度10 mm)。图1C冰冻切片HE染色评估脑出血建模成功。对Sham组及ICH组小鼠脑组织冰冻切片后免疫荧光染色,检查焦亡蛋白GSDMD与星形胶质细胞共定位情况,结果如图1D所示脑出血后血肿周围星形胶质细胞胞体增大,细胞数目减少,核缩小;脑出血后血肿周围GSDMD过表达。Merge图片中红色箭头所示黄色荧光为星形胶质细胞与焦亡蛋白共定位,提示星形胶质细胞发生焦亡。脑出血建模后,取Sham组建模侧大脑半球、ICH建模组脑出血侧大脑半球1、3 d行WB评估SIRT1,AcP65、P65、NLRP3、C-Cas-1及GSDMD-N表达情况。结果如图1E所示及统计结果图1F所示SIRT1蛋白相对表达量在脑出血后1、3 d均降低(P<0.05);AcP65蛋白相对表达量增加,AcP65/P65升高(P<0.05);NLRP3、C-Cas-1、GSDMD-N蛋白相对表达量在脑出血后1、3 d均明显增高(P<0.05)。表明脑出血后焦亡通路蛋白相对表达量增加,焦亡被激活。本研究选取脑出血后给药3 d进行下一步实验。

A:实验中所用SchA化合物分子结构;B:脑出血后切片;C:HE染色(×4);D:免疫荧光评估脑出血后血肿周围组织星形胶质细胞发生焦亡,绿色荧光为GFAP染色代表的星形胶质细胞,红色荧光为GSDMD蛋白(×20);E、F:免疫印迹检测评估脑出血SIRT、AcP65、P65、NLRP3、C-Cas-1、GSDMD-N表达情况;*:P<0.05;ns:差异无统计学意义。图1 脑出血建模及目的蛋白检测
2.2 SchA治疗脑出血后行为学检查及相关蛋白检测 为评估SchA治疗脑出血作用,先对Sham组小鼠给药并采用疲劳加速实验评估了药物毒性试验,结果如图2A所示给药各组中疲劳加速实验结果显示跌落时间均为200 s。接着采用疲劳加速实验评估了脑出血后神经运动功能,结果如图2B所示,随着给药剂量增加跌落时间逐渐增加,20、40 mg/kg SchA治疗量其跌落时间相同(P<0.05),提示SchA给药3 d治疗可以改善脑出血后小鼠神经运动功能,40 mg/kg药物治疗可以用于后续实验。我们通过给予10、20、40 mg/kg剂量的SchA治疗脑出血3 d,通过WB评估SIRT1,NF-κB、C-Cas-1、GSDMD-N,GSDMD-C蛋白表达情况,结果如图2C及统计结果2D所示脑出血后给予SchA治疗可以增加SIRT1蛋白相对表达量、减少AcP65/P65、C-Cas-1、GSDMD-N,GSDMD-C相对表达量(P<0.05)。提示SchA能减轻脑出血后焦亡通路蛋白表达水平。
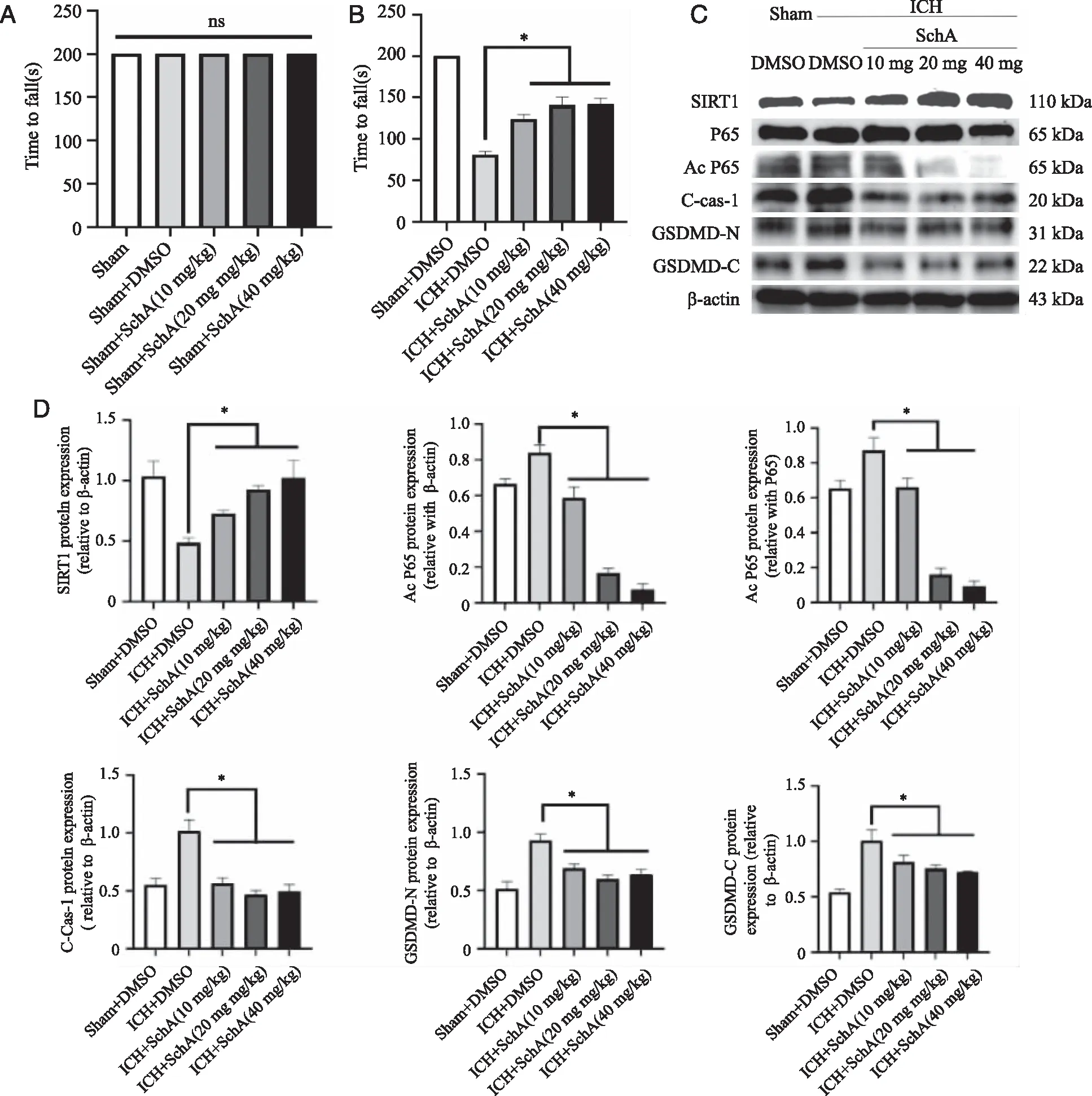
A:药物毒性试验(n=6);B:神经运动功能评分(n=6);C:代表性蛋白条带;D、E:WB检测评估SIRT1、AcP65/P65、C-Cas-1、GSDMD-N、GSDMD-C差异表达情况(n=3);ns:差异无统计学意义;*:P<0.05。图2 SchA治疗脑出血后神经功能评分及目的蛋白检测
2.3 OGD/H模型建立及相关蛋白检测 原代星形胶质细胞提取后鉴定:提取原代星形胶质细胞进行下一步实验。如图3A所示,首先通过红色荧光标记的星形胶质细胞,蓝染荧光标记的细胞核,采用Image J统计分别计算数目,统计其星形胶质细胞纯度大于97 %。采用OGD/H模型模拟体外脑出血模型。给予不同浓度的氯高铁血红素处理原代培养星形胶质细胞,CCK8检查评估细胞活性。结果如图3B所示:30 μm高铁血红素加用后细胞活性较Normal组减少15 %(P<0.01)。图3C所示采用缺氧1 h,复氧后立即用含30 μm Hemin的处理23 h,此时细胞活性较DMSO组减少约30 %(P<0.001),为OGD/H模拟体外脑出血条件。随后采用免疫荧光评估OGD/H建模后的体外脑出血模型中SIRT1、AcP65、GSDMD蛋白共定位情况。结果如图3D所示,经OGD/H处理的原代培养星形胶质细胞较正常细胞胞体变增大,SIRT1可定位于细胞核和胞体,且主要定位于细胞核;OGD/H处理后SIRT1蛋白表达减低;AcP65、GSDMD蛋白则OGD/H处理后则表达增加。接着对OGD/H建模后行WB检测评估SIRT1,AcP65及GSDMD-N蛋白相对表达量。结果如图4A及统计结果图4B所示SIRT1蛋白相对表达量在OGD/H建模后减低,P65蛋白相对表达量在OGD/H建模后表达无统计学差异,AcP65蛋白相对表达量在OGD/H建模后表达增加,GSDMD-N蛋白相对表达量在OGD/H建模后表达增加(P<0.05),提示可以采用的OGD/H模型建模方法模拟体外脑出血模型。

A:原代小鼠星形胶质细胞鉴定(×10);B:评估氯高铁血红素条件(n=6);C:评估OGD/H建模情况(n=6);D:免疫荧光评估SIRT1、AcP65、P65蛋白在建模后改变情况;**、***:与正常组比较, P<0.01、P<0.001。图3 OGD/H建模及模型评估

A:代表性蛋白条;B:蛋白定量统计结果;*:与正常组比较,P<0.05;ns:差异无统计学意义;n=3。图4 SIRT1、AcP65、P65、GSDMD-N蛋白表达情况
2.4 体外脑出血模型SchA给药后评估改善焦亡的机制 对构建的体外脑出血模型,通过给予不同浓度的SchA药物并采用CCK8进行检测细胞活性以评估最适SchA治疗浓度。结果如图5A所示40 μm时的SchA浓度条件下细胞活性最强(P<0.01)。为评估SIRT1通路在药物中的作用,使用SIRT1特异性抑制剂EX527逆转SIRT1作用。CCK8法测定细胞活性结果如图5B结果所示:与40 μm时SchA+OGD/H组相比,20 μm的EX527时细胞活性最强,为其最适抑制浓度(n=6)。通过荧光检测评估SIRT1蛋白表达,结果如图6A所示:DMSO组较OGD/H处理后荧光强度减低(P<0.05),提示SIRT1蛋白表达水平减低;SchA添加后SIRT1荧光强度增加(P<0.05),表明体外脑出血模型中SchA可上调SIRT1蛋白表达水平;进一步添加EX527后SIRT1蛋白荧光强度减低(P<0.05),提示SchA上调SIRT1可以被SIRT1抑制剂逆转。通过WB检测SchA处理OGD/H后进一步添加EX527相关蛋白表达情况,如图6B所示OGD/H处理后SIRT1蛋白相对表达量减低(P<0.05),添加SchA 后SIRT1蛋白相对表达量增加(P<0.05),进一步添加EX527后SIRT1减低(P<0.05);在OGD/H 模型中GSDMD-N相对表达量增加,添加SchA后GSDMD-N蛋白相对表达量减少(P<0.05),继续添加EX527后GSDMD-N蛋白相对表达量部分增加(P<0.05),但未达到OGD/H处理水平,提示SchA治疗作用被EX527部分逆转。

A:CCK8细胞活性检测评估最适SchA药物浓度(n=6);B:评估EX527药物浓度(n=6);*:与40 μm时SchA+OGD/H组相比,P<0.05;**: P<0.01。图5 CCK8法检测细胞活性结果

A:免疫荧光检测评估SIRT1蛋白表达情况及统计各组中差异表达情况;B:WB 估SchA给药及EX527给药后SIRT1、GSDMD-N蛋白表达情况及统计各组中差异表达情况(n=3);*:P<0.05。图6 各组SIRT1、GSDMD-N蛋白表达情况
3 讨论
本研究首先通过胶原酶Ⅶ纹状体建立小鼠脑出血模型,免疫荧光评估脑出血后星形胶质细胞胞体增大,核缩小,同时GSDMD在胞体增大细胞中发生过表达,提示星形胶质细胞发生焦亡。本研究发现通过五味子甲素治疗可以增强小鼠神经运动功能。五味子甲素可以促进SIRT1蛋白表达,减轻NF-κB炎症并减轻细胞焦亡。通过对原代培养的星形胶质细胞,采用OGD/H模型模拟的体外脑出血模型[12],经评估该模型,发现其可以模拟体外脑出血星形胶质细胞焦亡。五味子甲素可以上调OGD/H模型中SIRT1蛋白表达,抑制SIRT1表达可以减轻星形胶质细胞焦亡。
脑出血后继发性炎症是脑损伤的基础,通过一系列病理机制后神经细胞包括胶质细胞和神经元发生焦亡[2]。最近被确定为细胞焦亡的介质,包括GSDMA、GSDMB、GSDMC、GSDMD、GSDME(也称为DFNA5)和DFNB59;GSDM 的蛋白水解裂解释放出一个 N 末端片段,该片段可以在膜中组装形成孔隙[13]。焦亡激活分经典的途径和非经典途径[14]。在焦亡被激活的经典通路中,炎症小体激活caspase-1, C-Cas-1通过对GSDMD进行切割,形成GSDMD-N多聚体并最后在细胞上穿孔,细胞发生焦亡[15]。焦亡是细胞过度炎症反应恶性结局,其特征为是完整的线粒体和“气球状”囊泡形成,孔隙形成是细胞焦亡的关键因素,孔隙形成后一系列炎症因子释放,导致神经元死亡、血脑屏障 (BBB) 破坏以及 ICH 中其他类型的继发性炎症损伤[16]。本课题组前期研究报道了脑出血后的炎症反应参与继发性脑损伤,减轻炎症反应可以改善脑出血预后[8, 17]。焦亡作为程序性死亡方式在脑出血后被激活,这包括小胶质细胞、星形胶质细胞和神经元[18]。星形胶质细胞在颅内具有最多数的细胞,具有重要的生理及病理作用[19],减轻星形胶质细胞焦亡是最具潜力的靶点。故本实验通过SchA给药重点评估了星形胶质细胞焦亡。
SIRT1作为一种去乙酰化蛋白,主要定位于细胞核[20]。SIRT1 通过 NF-κB p65 亚基的脱乙酰化和失活具有抗炎作用[21]。在脑出血中,Ac p65/p65可以反应颅内出血后SIRT1的变化趋势,激活SIRT1通过调节Ac p65/p65比值减少发挥神经保护作用[9]。在本研究中,通过评估Ac P65/p65比值评估了SIRT1去乙酰化NF-κB的相对表达情况。
SchA是从中药五味子提取的最具生物活性的木脂素之一[22],SchA可以抑制P65核转位进而抑制炎症反应[23]。本团队前期研究结果发现脑出血后继发性损伤主要集中在3 d,在LPS小鼠脑出血模型总IL-1β代表的炎症指标在第5天已经开始下降[4],故我们选择SchA给药3 d进行相关指标评价。通过动物实验证实SchA药物治疗可以延长小鼠转棒疲劳实验时间。采用在体研究SchA药物的作用,离体研究其作用机制。细胞实验免疫荧光证实其调控SIRT1表达,通过添加EX527对SIRT1干扰可以看到施用SchA药物治疗后减少的焦亡被部分逆转,提示SchA通过SIRT1减轻了细胞焦亡。本研究发现EX527部分逆转SchA介导的星形胶质细胞焦亡,这可能是由于EX527部分抑制了SIRT1的表达,同时其可能通过除SIRT1之外其他通路减轻脑出血后星形胶质细胞焦亡。
综上所述,脑出血后SIRT1表达明显降低,星形胶质细胞发生焦亡。SchA明显改善脑出血后小鼠神经运动功能。给予SchA治疗明显促进SIRT1表达进而抑制NF-κB表达从而抑制星形胶质细胞焦亡。
