2型糖尿病合并急性脑梗死患者血清miR-223-3p、miR-134-5p水平变化及其意义
2023-12-01唐旭军于晓钧莫伟强陈绚彭翠翠
唐旭军,于晓钧,莫伟强,陈绚,彭翠翠
1 梧州市红十字会医院急诊科,广西梧州543002;2 梧州市红十字会医院神经内科
2型糖尿病(T2DM)若血糖长期得不到有效控制,将造成严重并发症[1]。急性脑梗死(ACI)是常见的脑血管病变,经规范化治疗后仍有部分患者疗效欠佳,预后不良[2]。有研究显示,T2DM合并ACI对患者的认知功能及生存质量造成严重影响,也是T2DM病死率增加的重要因素[3-4]。因此,加强T2DM合并ACI的早期监测是临床研究的重点。ACI神经功能受损机制复杂,有研究表明氧化应激与脑组织缺血缺氧损害关系密切[5]。微小核糖核酸(miR)在神经系统疾病发生和发展中扮演重要角色,可异常表达于糖氧剥夺神经元或缺氧缺血脑组织中[6]。miR-223-3p和miR-134-5p为新发现的miR分子,研究显示,miR-223-3p可抑制单核巨噬细胞炎症反应及动脉粥样硬化(AS)进展,而AS是ACI的重要病理基础[7]。miR-223-3p可作为T2DM发病前脂肪组织功能障碍的潜在生物标志物[8]。miR-134-5p在缺氧缺血性脑损伤新生大鼠中表达上调,抑制miR-134-5p可减轻新生大鼠脑组织损伤[9]。miR-134-5phai还可通过靶向Bcl-2促进高糖诱导的足细胞凋亡[10]。本研究观察了T2DM合并ACI患者血清miR-223-3p、miR-134-5p水平变化,并分析其与氧化应激损伤及预后的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2020年12月—2022年12月梧州市红十字会医院收治的T2DM合并ACI患者123例纳入研究组,选择同期入院的T2DM患者50例纳入T2DM对照组,体检健康者50例纳入健康对照组。纳入标准:①T2DM诊断标准符合《中国2型糖尿病防治指南(2017年版)》[11];②ACI诊断符合《中国急性缺血性脑卒中诊治指南2018》[12];③ACI为首次发病;④年龄40 ~ 80岁;⑤ACI发病12 h内入院;⑥病历资料完整;⑦患者或家属知情并签署知情同意书。排除标准:①心、肝、肾功能不全;②合并血液系统疾病;③合并急慢性感染;④近期有颅内手术史或脑外伤史;⑤脑出血或血管畸形所致的神经功能缺损;⑥妊娠期或哺乳期女性;⑦入组前已进行溶栓或介入治疗。研究组男78例、女45例,年龄40 ~80(63.49 ± 4.92)岁,T2DM病程(5.09 ± 1.12)年。T2DM对照组男30例、女20例,年龄41 ~ 78(62.87 ±4.74)岁,T2DM病程(4.33 ± 0.97)年。健康对照组男32例、女18例,年龄40~79(62.13 ± 5.61)岁。三组性别和年龄资料差异无统计学意义(P均>0.05)。本研究经梧州市红十字会医院医学伦理委员会审批通过。
1.2 血清miR-223-3p、miR-134-5p检测 受试者入院后24 h内采集各组空腹肘静脉血5 mL,以3 000 r/min离心5 min,分离血清。采用qRT-PCR检测血清miR-223-3p、miR-134-5p。采用TRIzol法提取血样本中的总RNA,测定浓度和纯度;反转录试剂盒合成cDNA;将cDNA作为模板,进行PCR反应。PCR反应条件包括预变性95 ℃ 60 s、变性95 ℃ 60 s、退火58 ℃ 30 s、延伸 72 ℃ 30 s,共36次循环。以U6为内参,以2-ΔΔCt表示miR-223-3p、miR-134-5p表达水平。U6上下游引物序列分别为5′-TGGAAGCTCGGCAATACCAG-3′,5′-CCTTTGCGTTCATGGGCATT-3′;miR-223-3p上下游引物序列分别为5′-CACACTTGGAAGCTGATTCAG-3′,5′-CTTCATCCAAATTGCGAGATGC-3′;miR-134-5p上下游引物序列分别为5′-CAAGTATGCTTGCTGAAGGAG-3′,5′-ACCTCGTAAGCGCATGAACAG-3′。
1.3 血清氧化应激指标检测 采用硫代巴比妥酸法检测血清丙二醛(MDA),黄嘌呤氧化法检测血清超氧化物歧化酶(SOD),采用分光光度法检测血清谷胱甘肽过氧化物酶(GSH-Px)。
1.4 预后资料收集 研究组患者治疗3个月后根据改良Rankin量表(mRS)评分判定预后情况。mRS评分0 ~ 1分为预后良好亚组,共91例;mRS评分2 ~ 6分为预后不良亚组,共32例[13]。收集两亚组年龄、性别、吸烟史、入院时美国国立卫生院神经功能缺损评分(NIHSS)、高脂血症史、高血压史、血尿酸、糖化血红蛋白(HbA1c)检查资料。
1.5 统计学方法 采用SPSS22.0软件。符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。计数资料以例(%)表示,采用χ2检验。相关性分析采用Pearson相关分析法。采用Logistic回归模型分析T2DM合并ACI患者预后不良的影响因素。采用受试者工作特征(ROC)曲线分析各指标对T2DM合并ACI患者预后不良的预测效能。P<0.05为差异有统计学意义。
2 结果
2.1 三组血清miR-223-3p、miR-134-5p及氧化应激指标水平比较 见表1。
表1 三组血清miR-223-3p、miR-134-5p及氧化应激指标水平比较()

表1 三组血清miR-223-3p、miR-134-5p及氧化应激指标水平比较()
注:与健康对照组相比,*P<0.05;与T2DM对照组相比,#P<0.05。
组别研究组T2DM对照组健康对照组GSH-Px(U/L)44.68 ± 6.81*#58.72 ± 10.37*127.78 ± 12.29 n 123 50 50 miR-223-3p 0.57 ± 0.09*#0.97 ± 0.20*1.56 ± 0.37 miR-134-5p 2.14 ± 0.67*#1.61 ± 0.36*0.75 ± 0.15 MDA(mmol/L)16.50 ± 3.09*#12.60 ± 2.34*4.03 ± 0.51 SOD(U/L)95.00 ± 11.40*#126.53 ± 19.15*346.69 ± 81.13
2.2 T2DM合并ACI患者血清miR-223-3p、miR-134-5p与氧化应激指标水平的相关性 T2DM合并ACI患者血清miR-223-3p与SOD、GSH-Px呈正相关,与MDA呈负相关(r分别为0.454、0.513、-0.463,P均<0.05);血清miR-134-5p与MDA呈正相关,与SOD、GSH-Px呈负相关(r分别为0.562、-0.475、-0.507,P均<0.05)。
2.3 T2DM合并ACI患者预后不良的影响因素 预后良好亚组与预后不良亚组性别、吸烟史、高脂血症史占比、血尿酸、HbA1c水平差异无统计学意义(P均>0.05);与预后良好组比较,预后不良组年龄更高,入院时NIHSS评分、高血压史占比、血清miR-134-5p及MDA水平升高,血清miR-223-3p、SOD、GSH-Px水平降低(P均<0.05)。见表2 ~ 4。以T2DM合并ACI患者预后情况为因变量,以单因素分析差异有统计学意义的指标为自变量,建立非条件Logistic回归模型。回归过程采用逐步后退法,进行自变量的选择和剔除,设定α剔除=0.10,α入选=0.05。回归分析结果显示,入院时NIHSS评分偏高、miR-134-5p偏高、MDA偏高是T2DM合并ACI患者预后不良的危险因素,miR-223-3p偏高、SOD偏高、GSH-Px偏高为保护因素(P均<0.05)。见表5。
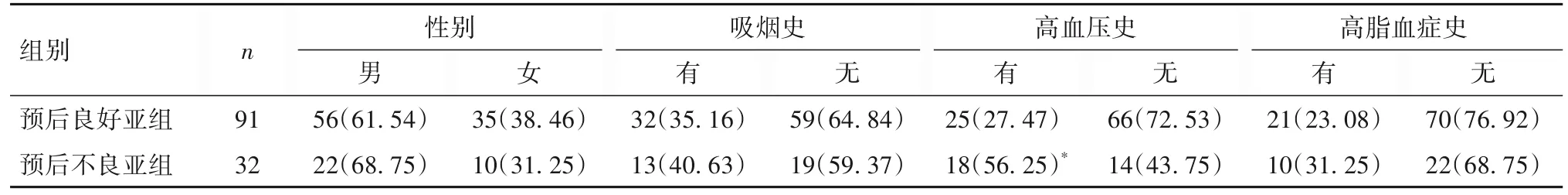
表2 预后良好亚组与预后不良亚组性别、吸烟史、高血压史、高脂血症史比较[例(%)]
表3 预后良好亚组与预后不良亚组年龄、NIHSS评分、血尿酸、HbA1c水平比较()
注:与预后良好亚组相比,*P<0.05。
组别预后良好亚组预后不良亚组HbA1c(%)7.52 ± 1.34 8.01 ± 1.73 n 91 32年龄(岁)63.34 ± 4.61 66.76 ± 5.74*入院时NIHSS评分(分)2.78 ± 0.57 10.44 ± 2.12*血尿酸(μmol/L)395.23 ± 26.53 405.12 ± 27.94
表4 预后良好亚组与预后不良亚组血清miR-223-3p、miR-134-5p及氧化应激指标水平比较()

表4 预后良好亚组与预后不良亚组血清miR-223-3p、miR-134-5p及氧化应激指标水平比较()
注:与预后良好亚组相比,*P<0.05。
组别预后良好亚组预后不良亚组GSH-Px(U/L)46.37 ± 8.11 39.87 ± 6.03*n 91 32 miR-223-3p 0.66 ± 0.14 0.31 ± 0.06*miR-134-5p 1.87 ± 0.45 2.91 ± 0.69*MDA(mmol/L)15.40 ± 2.17 19.63 ± 3.46*SOD(U/L)98.16 ± 13.39 86.01 ± 10.20*
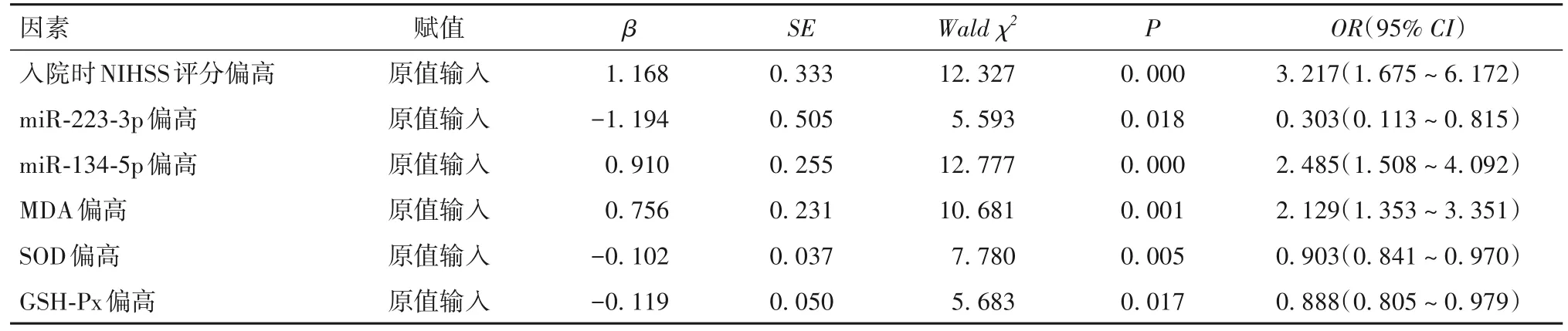
表5 T2DM合并ACI患者预后不良的影响因素分析结果
2.4 血清miR-223-3p、miR-134-5p对T2DM合并ACI患者预后不良的预测效能 血清miR-223-3p、miR-134-5p两指标单独及联合应用时,ROC曲线下面积(AUC)分别为0.728、0.739、0.862,其中联合应用诊断效能最高。见表6、OSID码图1。

表6 血清miR-223-3p、miR-134-5p对T2DM合并ACI患者预后不良的预测价值
3 讨论
研究表明,T2DM和ACI之间存在着密切联系,糖尿病为ACI危险因素之一。血糖波动可使T2DM患者体内氧化应激过度激活,导致其血管内膜增厚,进一步诱发ACI[14]。因此,早期识别和筛查有助于早期制定个性化综合干预措施,降低并发ACI的风险。
研究表明,在ACI发生发展过程中,缺血缺氧可引起多种miR水平变化[15]。miR-223-3p和miR-134-5p是近些年颇受关注的miR分子。有研究显示,miR-223-3p在AS患者外周血及主动脉斑块中表达降低,上调miR-223-3p可减弱促炎巨噬细胞活性以及机体炎症反应[7]。糖尿病肾病患者血浆miR-223-3p水平降低[16],上调miR-223-3p表达可减轻高糖所致的小鼠足细胞损伤,并可减少足细胞过氧化产物MDA水平[17]。有学者发现,miR-134-5p在血管痴呆大鼠皮层中表达明显增加,miR-134-5p可通过损伤皮质神经元及降低突触蛋白表达量,加重大鼠认知功能障碍[18]。还有研究显示,miR-134-5p高表达与脑卒中复发、心肌梗死的发病存在明显联系;与稳定斑块相比,颈动脉不稳定斑块中miR-134-5p水平更高[19-20]。本研究结果显示,T2DM并发ACI患者血清miR-223-3p水平降低、miR-134-5p水平增高,与相关研究结果基本一致[19-20],提示miR-223-3p、miR-134-5p可能参与T2DM并发ACI的发病。
氧化应激是导致T2DM患者并发ACI及患者预后不良的关键环节。有研究认为,糖耐量异常或合并T2DM的脑梗死患者体内氧化应激更为严重[21]。ACI发生时,脑组织处于缺血缺氧状态,此时氧自由基生成增多、清除减少,氧化与抗氧化系统失衡,造成组织损伤[22]。本研究中,T2DM并发ACI患者血清MDA水平升高,SOD、GSH-Px降低,提示患者体内存在明显的氧化应激损伤。Pearson检验结果显示,T2DM合并ACI患者血清miR-223-3p与SOD、GSH-Px呈正相关,与MDA呈负相关,而血清miR-134-5p与MDA呈正相关,与SOD、GSH-Px呈负相关,这提示T2DM并发ACI过程中miR-223-3p表达减少及miR-134-5p增加可能与氧化应激的过度激活有关。
T2DM合并ACI患者遗留神经功能损害将对其日常生活产生不利影响。本研究分析了miR-223-3p、miR-134-5p与患者预后不良的关系,发现miR-134-5p、MDA偏高是T2DM合并ACI患者预后不良的危险因素,miR-223-3p、SOD、GSH-Px偏高为其保护性因素。究其原因:①miR-223-3p在T2DM并发ACI患者中呈低表达,上调miR-223-3p可抑制氧化应激,发挥保护神经功能的作用,故miR-223-3p水平越低者,预后不良风险越大;②miR-134-5p水平升高可增强氧化应激反应,促使神经细胞凋亡,造成细胞损伤,引起神经功能障碍,致其预后不良[23]。此外,入院时NIHSS评分也是T2DM合并ACI患者预后不良的影响因子。本研究ROC曲线分析结果显示,血清miR-223-3p联合miR-134-5p预测预后不良的AUC值达0.862,提示预测效能较好。T2DM患者并发ACI后及时检测miR-223-3p、miR-134-5p水平有助于早期筛查预后不良风险患者。
综上所述,T2DM合并ACI患者血清miR-223-3p水平降低、miR-134-5p水平增高,其表达水平与患者氧化应激损伤及预后关系密切,miR-223-3p联合miR-134-5p对于患者短期预后的预测价值较高。
