弯曲菌中氟苯尼考耐药基因fexA功能鉴定及其携带质粒分析
2023-12-01赵文博
陈 宇, 焦 典, 赵文博, 张 程, 姚 红
(河南农业大学动物医学院, 河南 郑州 450046)
弯曲菌属中的空肠弯曲菌和结肠弯曲菌是食源性人兽共患病原菌,可以通过食物链传播给人类,导致人类的消化道疾病(如腹泻)甚至神经性疾病(如格林-巴利综合征)[1]。抗生素在医学临床和兽医临床的广泛应用导致了耐药弯曲菌的出现和传播,耐药弯曲菌一旦沿食物链传播给人类,将会严重限制临床治疗用药选择,给公共卫生安全带来巨大挑战。
通过结构修饰的氟苯尼考在安全性和有效性方面显著优于氯霉素和甲砜霉素,于20世纪90年代被投入市场使用[2]。该药主要用于治疗牛、猪、禽和水产养殖中的细菌性疾病,是治疗动物性疾病最常用的抗生素之一。但随着氟苯尼考在兽医临床中的大量使用,对氟苯尼考耐药的弯曲菌日益增多[3]。目前,细菌对氟苯尼考的耐药机制主要分为以下三类:(1)外排蛋白导致的主动外排,主要由fexA、fexB、floR和optrA基因介导[4-6];(2)RNA甲基转移酶的修饰,主要由cfr基因介导[7];(3)核糖体保护,主要由poxtA基因介导[8]。自上述氟苯尼考耐药基因在革兰阳性菌中被发现以来,主要在革兰阳性菌(葡萄球菌和肠球菌等)中被报道。然而,近年来,在弯曲菌中也报道了fexA、optrA和cfr(C)基因的存在[9-11]。
外排蛋白编码基因fexA于2004年在1株缓慢葡萄球菌的质粒pSCFS2中被发现,该基因编码475个氨基酸,包含14个跨膜区[4]。fexA基因编码外排蛋白,属E-4族成员,与其他氯霉素类药物外排基因同源性较低。此外,在fexA基因上游存在类似衰减子的结构,可对fexA基因的诱导表达进行调节。基因功能研究证实,fexA基因可介导氯霉素和氟苯尼考耐药[4]。对fexA基因环境研究发现,该基因定位于质粒的新型转座子Tn558中,易通过转座子和质粒在不同种属细菌中进行传播[12]。近年来,fexA基因在弯曲菌中也被相继报道[9,13]。研究发现,fexA基因位于弯曲菌染色体,与四环素类耐药基因tet(L)等形成耐药基因岛,插入至弯曲菌保守基因moeA2与cj1528之间[9]。
本课题组前期发现了1株携带fexA基因的猪源结肠弯曲菌,本试验将针对该基因介导氟苯尼考耐药表型的功能以及遗传环境进行确证和分析,阐明fexA基因在弯曲菌中作用和遗传特征,以期为合理用药和氟苯尼考耐药性防控提供科学依据。
1 材料与方法
1.1 主要试剂 MH琼脂(Mueller hinton agar,MHA)培养基,购自美国Sigma-Aldrich公司;SOC肉汤(SOC broth)培养基,购自青岛捷世康生物科技有限公司;无菌脱纤维羊血,购自北京陆桥技术有限公司;PremixExTaq(Loading dye mix),购自宝生物工程(大连)有限公司;NEBuilder®HiFi DNA Assembly Master Mix,购自美国NEB公司;大肠杆菌感受态细胞DH5α和pUC-19载体,均购自北京庄盟国际生物基因有限公司;Wizard Genomic DNA Purification Kit,购自美国Promega公司;QIAGEN Plasmid Midi Kit,购自德国QIAGEN公司。
1.2 主要仪器 二氧化碳培养箱,日本三洋公司产品;PCR仪和电泳成套设备,美国 BIO-Rad公司产品;超净工作台,苏州净化设备有限公司产品;单道移液枪,德国 Eppendorf公司产品;电转化仪,美国BTX公司产品。
1.3 菌株 结肠弯曲菌C19来源于养殖场生猪;空肠弯曲菌(Campylobacterjejuni)ATCC 33560和空肠弯曲菌NCTC 11168均为本实验室保存菌株。
1.4 试验方法
1.4.1 药物敏感性试验和氟苯尼考耐药基因检测 根据美国临床实验室标准委员会(Clinical and Laboratory Standards Institute,CLSI) 推荐的琼脂稀释法测定弯曲菌对氟苯尼考的敏感性。药敏试验质控菌株为ATCC 33560,结果判定依据参照CLSI判定标准(https://www.clsi.org/standards/products/microbiology/companion/using-m100/)。根据参考文献[9]中引物(Primer-L,5′-CCATTCCGACACCAACCT-3′;Primer-R,5′-CCATTCCGACACCAACCT-3′)和扩增条件,通过PCR方法对fexA基因进行检测。此外,参照参考文献[9]对氟苯尼考耐药基因fexB、floR、optrA、cfr(C)和poxtA进行检测。
1.4.2fexA单基因克隆构建 为了确证C19 对氟苯尼考的高水平耐药表型是由fexA基因介导,通过构建cj0299-fexA-erm(B)-panB片段对fexA基因介导的氟苯尼考耐药功能进行验证,通过自然转化方法将该片段导入至受体菌株NCTC 11168,测定最小抑菌浓度(Minimum inhibitory concentration,MIC)。具体试验方法:将cj0299、fexA、erm(B)和panB基因序列添加至软件NEBuilder中,设计引物P1~P8,引物序列见表1。分别用P1、P2扩增cj0299基因;P3、P4扩增erm(B) 基因;P5、P6扩增fexA基因;P7、P8扩增panB基因。PCR 反应体系(50 μL):PremixExTaq25 μL,上游引物1 μL,下游引物1 μL,DNA模板2 μL,ddH2O 21 μL。PCR反应程序:95 ℃预变性10 min;95 ℃变性30 s,退火温度分别为55 ℃(cj0029)、56 ℃[erm(B)]、55 ℃(fexA)和57 ℃(panB),退火30 s,72 ℃延伸1 min,30个循环;72 ℃后延伸10 min。将PCR产物用NEBuilder HiFi DNA Assembly Master Mix进行连接,然后与pUC-19载体相连,转化至感受态细胞DH5α,具体步骤参照说明书。以连接产物为供体,NCTC 11168为受体进行自然转化,用浓度为4 μg/mL的红霉素筛选转化子,随后用fexA基因检测引物(引物序列见1.4.1)进行PCR扩增以对转化子进行确证。对确证的转化子进行药物敏感性试验,测定氟苯尼考对转化子和受体菌株的MIC值。

表1 用于构建fexA单基因克隆的PCR扩增引物
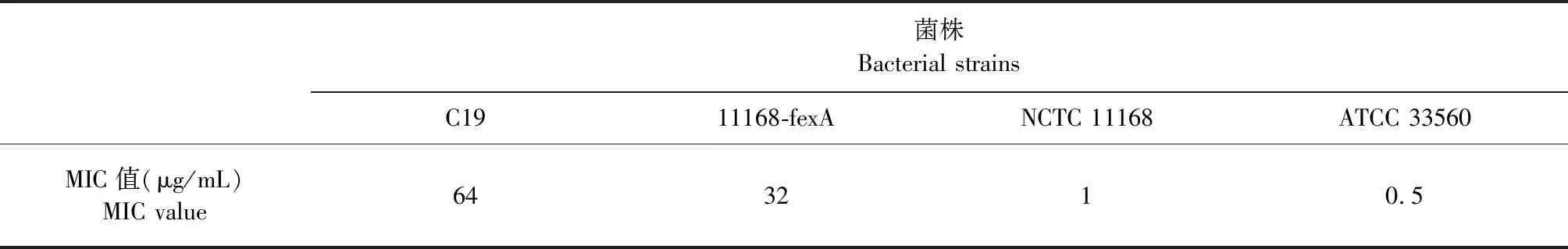
表2 氟苯尼考对菌株的MIC值
1.4.3 全基因组测序和携带fexA基因环境分析 为分析fexA基因的遗传环境,对菌株C19进行全基因组测序和分析。运用细菌基因组提取试剂盒Wizard Genomic DNA Purification Kit提取携带fexA基因菌株的全基因组,之后将提取的基因组送至上海派森诺生物科技股份有限公司进行全基因组测序分析(Illumina HiSeq 2500 platform)。运用BioNumerics v. 8.0(Applied Maths)对测序获得的基因组进行组装,通过RAST(https://rast.nmpdr.org/rast.cgi)对开放阅读框(Open reading frame,ORF)进行预测和分析,用Artmis软件对fexA基因遗传环境图谱进行分析和绘制,运用BRIG软件进行质粒比对分析。
1.4.4 电转化试验 按照QIAGEN Plasmid Midi Kit说明书操作提取质粒。将含有fexA基因的质粒电转化至空肠弯曲菌NCTC 11168中。具体方法:将1 μg质粒DNA置于透析膜上30 min,然后添加至解冻的感受态细胞,混合均匀;将混合物加入电转杯,在200 Ω、25 μFd和1.8 kV条件下进行电转化;添加SOC肉汤300 μL,将菌液转移至EP管,42 ℃微需氧条件培养1 h;将菌液涂布于含有8 μg/mL氟苯尼考的MH琼脂平板,42 ℃微需氧条件培养48 h,筛选电转子。
1.4.5 反向PCR 对环状中间体进行检测和验证,用参考文献[9]中报道的引物进行反向PCR(primer-L,5′-CCATTCCGACACCAACCT-3′;primer-R,5′-CCATTCCGACACCAACCT-3′)。PCR反应体系(50 μL):PremixExTaq25 μL,上游引物1 μL,下游引物1 μL,DNA模板2 μL,ddH2O 21 μL,进行PCR扩增。PCR反应程序:95 ℃预变性10 min;95 ℃变性30 s,54 ℃退火30 s,72 ℃延伸1 min,30个循环;72 ℃后延伸10 min。
2 结果
2.1 药物敏感性试验和氟苯尼考耐药基因检测 在对弯曲菌(主要为空肠弯曲菌和结肠弯曲菌)耐药监测过程中发现1株猪源结肠弯曲菌(命名为C19)对氟苯尼考呈现较高水平耐药表型(MIC=64 μg/mL)。运用PCR方法对C19耐药基因进行检测,结果显示,该菌株含有外排泵编码基因fexA,而其他氟苯尼考耐药基因,如fexB、floR、optrA、cfr(C)和poxtA在该菌株中未检出。因此,推测菌株C19对氟苯尼考的高水平耐药表型由fexA基因介导。
2.2fexA单基因克隆构建 构建的cj0299-fexA-erm(B)-panB片段含有NCTC 11168菌株保守基因panB和cj0299的同源序列,通过同源重组,fexA-erm(B)成功整合至panB和cj0299基因之间,得到转化子11168-fexA。运用琼脂稀释法测定氟苯尼考对C19、NCTC 11168、11168-fexA和ATCC 33560菌株的MIC,结果显示,转化子11168-fexA对氟苯尼考呈现高水平耐药表型,MIC值为32 μg/mL,比受体菌株NCTC 11168对氟苯尼考的MIC值提高了32倍。结果证实,fexA基因可介导弯曲菌对氟苯尼考的高水平耐药。
2.3 全基因组测序和fexA基因环境分析 基因注释分析结果显示,fexA基因位于1个长度为13 793 bp的质粒上,将其命名为pC19-fexA,该质粒包含13个ORF,其中有7个假蛋白(Hypothesis protein,hp),不包含编码接合转移功能蛋白的相关基因。fexA上游为hp,下游是整合酶编码基因(图1)。值得注意的是,质粒pC19-fexA有2个与其复制相关的rep基因(图1),而进一步分析表明,质粒复制子未有具体分型。
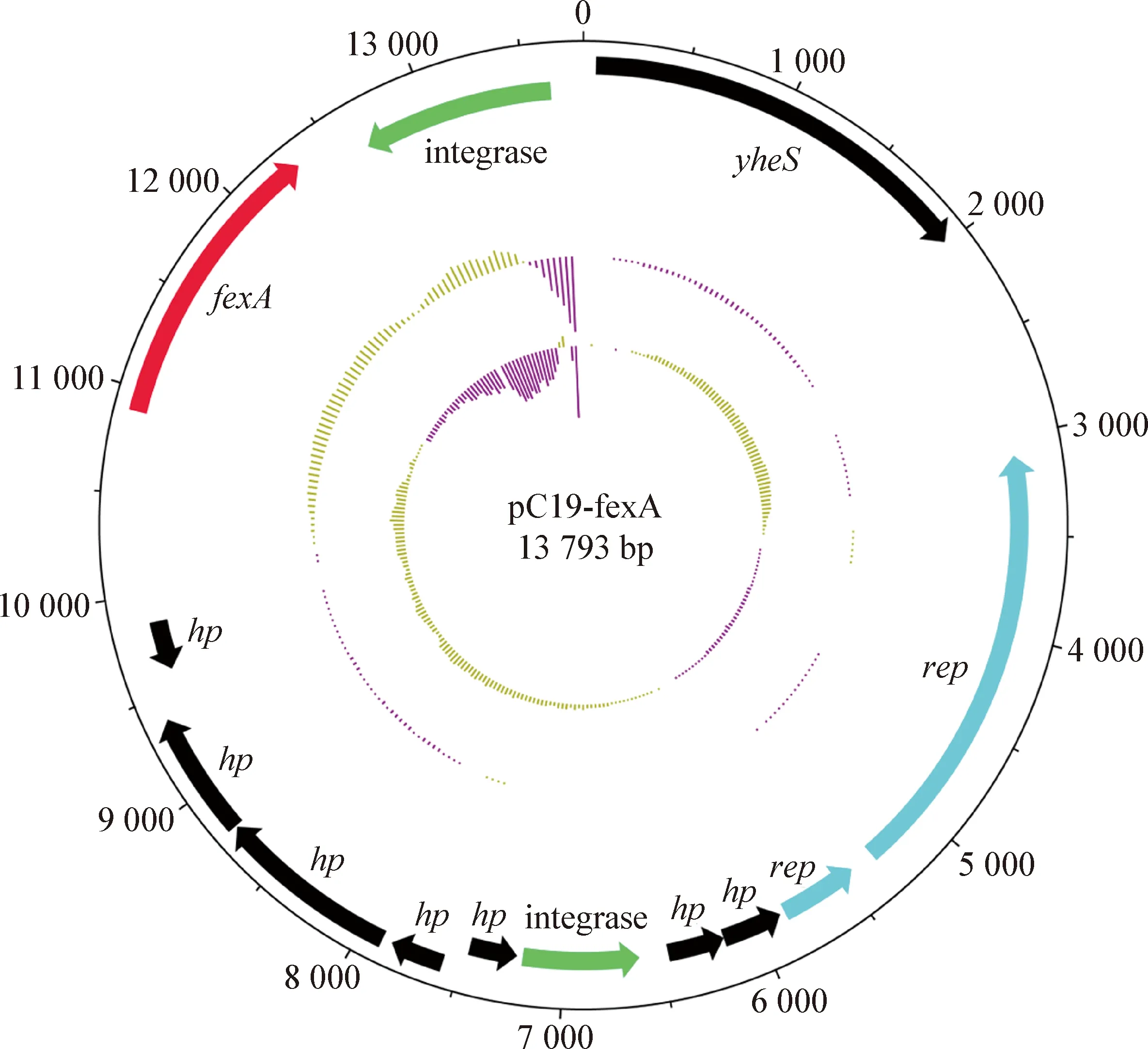
图1 携带fexA质粒pC19-fexA图谱和开放阅读框标注
将质粒pC19-fexA序列进行基因组比对分析,结果显示,质粒pC19-fexA与数据库中质粒序列相比同源性介于96.15%~99.72%,而覆盖度最高仅为74%。将质粒pC19-fexA与数据库中质粒进行比对分析,发现与该质粒同源性最高(98.85%)且覆盖度最高(74%)的质粒是来源于罗氏柠檬乳杆菌的质粒pAN417B(CP054659),值得注意的是,pAN417B也携带fexA基因(图2)。此外,质粒pC19-fexA与其他质粒相比,虽然同源性较高(>99.00%),但是覆盖度均较低,如序列号为CP065854和CP030091的质粒(图2)。

图2 pC19-fexA与数据库参考质粒基因组比对
2.4 电转化试验和反向PCR 为检测质粒pC19-fexA是否能够发生转移,进行了电转化试验。尽管多次尝试,但并未获得相应电转子,表明携带fexA基因的质粒pC19-fexA不能通过电转化发生水平传播。通过反向PCR检测是否能够形成包含fexA基因的环状中间体,结果显示,未得到相应的扩增片段。此外,本试验未能获得相应的接合转移子,与该质粒不包含接合转移蛋白编码基因的基因型一致。
综上所述,本试验结果表明,pC19-fexA质粒携带可介导氟苯尼考高水平耐药的fexA基因;fexA和hp基因和整合酶编码基因相邻,不能形成环状中间体;pC19-fexA质粒与其他质粒结构不同,且该质粒不能通过电转化和接合转移发生水平传播。
3 讨论
外排泵编码基因fexA可介导葡萄球菌对酰胺醇类药物的高水平耐药[4]。本试验构建fexA单基因克隆,通过自然转化成功获得了含有fexA基因的背景清晰的工程菌株转化子11168-fexA,证实了该基因在弯曲菌种属中介导氟苯尼考耐药的功能。相较于以原代菌全基因组为供体基因组进行自然转化的方法,单基因克隆更能明确地说明fexA基因介导氟苯尼考耐药的功能。此外,本试验以大环内酯类耐药基因erm(B)作为筛选标记,防止其他酰胺醇类突变影响fexA基因功能的确证。因此,该基因功能确证方法易操作、结果可靠,可广泛应用于其他基因的功能研究。
弯曲菌易吸收和整合外源基因至自身基因组,极大程度上丰富了弯曲菌基因组的多样性。近年来,越来越多最初发现并流行于革兰阳性菌中的耐药基因在弯曲菌中被发现并报道,如大环内酯类耐药基因erm(B)[14]、酰胺醇类耐药基因optrA[10]、cfr(C)[11]和fexA[9],以及四环素类耐药基因tet(L)[15]。上述耐药基因整合至弯曲菌染色体基因组,可与其他耐药基因形成多重耐药基因岛,通过同源重组在弯曲菌中发生水平传播[15,16]。自fexA基因被发现以来,其在革兰阳性菌中被报道较多,如葡萄球菌和肠球菌[12,17]。而近年来,fexA基因在弯曲菌中被发现并报道[9]。基因序列分析显示,fexA基因多位于弯曲菌染色体上的多重耐药基因岛,仅有1株弯曲菌中fexA基因位于质粒,该质粒pCJFEX为48 003 bp,编码58个ORF[18]。而本试验结果显示,fexA基因位于1个长度约为13 kb的具有新型结构的小质粒,与先前报道的质粒结构不同。实验室条件下,该质粒虽然不能发生水平传播,但是作为fexA基因载体的作用却不容忽视。质粒pC19-fexA中包含的大部分ORF经比对注释后均为假蛋白编码基因hp,但是这些假蛋白在该质粒的生存、稳定性或者适应性中是否发挥作用,需要进一步进行功能研究。
已报道的fexA基因环境并不完全一致,但fexA基因周围均存在插入序列。有研究表明,fexA基因位于结肠弯曲菌染色体,上下游被同向的IS1216E包围(SAMN11316573)[9]。另有研究发现,位于质粒pCJFEX的fexA基因被插入序列IS1216包围(CP048762),位于染色体的fexA基因环境与质粒pCJFEX上的类似,均为可移动遗传元件[18]。fexA基因周围的IS1216在整合携带fexA基因的片段中发挥了关键作用。而本试验发现,fexA基因位于1个长度为13 793 bp的质粒pC19-fexA上,fexA上游为hp,下游为整合酶编码基因,与之前报道的fexA基因环境不同。虽然反向PCR、电转化和接合转移试验均证实fexA基因不能发生传播,但本试验发现的fexA基因新型携带载体说明fexA基因环境多样。
本试验针对fexA基因阳性菌株进行研究,确证了fexA基因在弯曲菌中介导氟苯尼考耐药的功能。基于全基因组测序数据分析了fexA基因的新型遗传环境,揭示了fexA基因载体的新形式,为控制fexA基因在弯曲菌中的传播提供理论依据。
