枯草芽孢杆菌细胞壁通过TLR-2-MyD88-NF-κB/MAPK信号通路调控绵羊瘤胃上皮细胞β-防御素-1的表达
2023-12-01辛雅明白绥明高景鹏樊翀宇韩彩霞张文彦杨银凤
辛雅明, 白绥明, 白 刚, 高景鹏, 樊翀宇, 韩彩霞, 周 伟, 张文彦, 永 荣, 齐 盟, 肖 红, 杨银凤
(1.内蒙古农业大学兽医学院, 内蒙古 呼和浩特 010018 ; 2.鄂尔多斯市动物疫病预防控制中心, 内蒙古 鄂尔多斯 017000 ; 3. 清涧县动物疫病预防控制中心, 陕西 榆林 718399 ; 4. 鄂尔多斯市农牧技术推广中心水产技术站, 内蒙古 鄂尔多斯 017000)
抗微生物肽(Antimicrobial peptides,AMPs)是一种几乎存在于所有生物中的阳离子多肽[1]。防御素(Defensins)是AMPs中的一个大家族,除了具有抗细菌、真菌和病毒等活性外,防御素还具有趋化免疫细胞和免疫调节的作用[2],因此,近年来备受关注。β-防御素作为防御素家族中的一员,广泛分布于人、鼠、犬、家畜(牛、羊、猪、骆驼)、野生动物(驯鹿、梅花鹿)以及家禽(鸡、火鸡)的多种器官上皮细胞内。绵羊β-防御素-1(Sheep-β-defesin-1,SBD-1)是绵羊体内重要的内源性抗菌肽,在绵羊气管和整个消化道都有表达[3-5]。
益生菌是一类可以定殖在人或动物体内,并改变宿主某一部位菌群组成,对宿主有益的非致病性微生物[6]。益生菌通过多种机制发挥有益作用,包括降低肠道pH值、调节黏膜免疫反应、减少病原生物的定植和入侵、调节肠道内菌群平衡、改变宿主的免疫应答等[7]。研究表明,细菌类益生菌可以作用于上皮细胞诱导防御素的表达,从而提高家畜的抗病能力,维持胃肠道健康[8]。枯草芽孢杆菌就是一种典型的广泛应用于畜牧业的益生菌。2014年,王佩等[9]研究发现,使用益生性枯草芽孢杆菌刺激绵羊瘤胃上皮细胞(Ovine rumen epithelial cells,ORECs)后,SBD-1 mRNA和蛋白的表达量显著上升,从而提高绵羊抗病能力。然而,对于枯草芽孢杆菌诱导防御素的有效成分和机制尚不清楚,有效成分及机制研究的不足必将影响益生菌的全面开发和利用,枯草芽孢杆菌细胞壁作为枯草芽孢杆菌的主要成分,其是否为诱导SBD-1产生的有效成分成为了研究者探究的问题。
枯草芽孢杆菌细胞壁的主要成分是肽聚糖 (Peptidoglycan,PG),它对细菌生存至关重要,部分抗菌药主要通过抑制肽聚糖的合成来发挥抗菌作用[10]。枯草杆菌的细胞壁还含有少量的磷壁酸(Teichoic acid,TA),分为壁磷壁酸(Wall teichoic acid,LTA)和脂磷壁酸(Membrane teichoic acid,MTA)[11]。2021年,梁栋等[12]采用反复冻融法与超声波破碎法相结合的方法破碎枯草芽孢杆菌并收集其细胞壁。2022年,辛雅明等[13]研究发现,枯草芽孢杆菌细胞壁可以显著诱导SBD-1的产生,并筛选出枯草芽孢杆菌细胞壁刺激ORECs的最佳条件,由此说明枯草芽孢杆菌细胞壁是枯草芽孢杆菌诱导SBD-1表达的有效成分之一。本试验在已经证明枯草芽孢杆菌细胞壁可以诱导ORECs SBD-1基础上,进一步探究其诱导机制。
不同的益生菌诱导防御素表达的主要有效成分和机制不完全相同。有研究表明,瑞士乳杆菌SBT2171诱导人结直肠腺癌细胞-2(Colorectal adenocarcinoma cell-2,Caco-2)中人β-防御素-2(Human β-defensin-2,hBD-2)表达的有效成分是其表面蛋白,它是通过激活MAPKs信号传导途径中的C-Juk 氨基末端激酶(C-Jun kinase enzyme,JNK)来刺激hBD-2的表达[14]。酿酒酵母菌诱导绵羊瘤胃上皮细胞内SBD-1表达的主要有效成分是细胞壁组分β-葡聚糖和甘露聚糖,其中甘露聚糖诱导机制由核因子κB(Nuclear factor-κB,NF-κB)和丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路共同介导[15],而β-葡聚糖诱导机制以NF-κB信号通路为主[16]。那么,枯草芽孢杆菌细胞壁作为一种菌体有效成分,其激活的信号通路途径是NF-κB还是MAPK,有待进一步研究。
本试验首先制备枯草芽孢杆菌细胞壁,检测枯草芽孢杆菌细胞壁刺激ORECs后信号通路因子mRNA和蛋白表达的变化,然后使用信号通路抑制剂阻断各信号通路,检测其对SBD-1 mRNA表达的影响,从而对枯草芽孢杆菌细胞壁诱导SBD-1表达机制进行探究,有助于在分子水平上揭示反刍动物胃肠道内微生态黏膜免疫机制,为饲料企业全面研发枯草芽孢杆菌相关饲料添加剂提供理论依据。
1 材料与方法
1.1 菌种和瘤胃组织 枯草芽孢杆菌(菌号:CMCC63501),购自中国微生物菌种网。6月龄左右绵羊瘤胃组织,取自内蒙古自治区呼和浩特市北亚屠宰场。
1.2 主要试剂 肽聚糖检测试剂盒(SND-Q070)和磷壁酸检测试剂盒(SND-Q090),均购自诺仕达生物科技公司;DMEM/F12培养基,购自Gibco公司;RNA提取试剂盒,购自Axygen公司;PrimeScript RT Master Mix 和TB Green Fast qPCR Mix 试剂,均购自TaKaRa公司;动物全蛋白提取试剂盒,购自生工生物工程(上海)股份有限公司;NF-κB抑制剂PDTC、JNK抑制剂SP600125、p38丝裂原活性蛋白激酶(p38-mitogen-activated protein kinase,p38-MAPK)抑制剂SB202190和细胞外信号调节激酶(Extracellular signal-regulated kinase 1/2,ERK1/2)抑制剂PD98059,均购自Sigma公司;Anti-NF-κB-antibody、Anti-p38-antibody、Anti-JNK-antibody和Anti-β-actin-antibody,均购自北京博奥森公司;Anti-ERK1/2-antibody,购自Affinity公司;Anti-TLR-2-antibody,购自Bosterbio公司;Anti-MyD88-antibody,购自SANTA CRUZ公司;电泳液、转膜液和CCK-8(Cell counting kit-8)试剂盒,均购自北京索莱宝科技有限公司。
1.3 主要仪器 实时荧光定量PCR仪,赛默飞世尔科技公司产品;多功能酶标仪,美国伯腾仪器有限公司(BioTek)产品;电泳仪和转膜仪,伯乐生命医学产品(上海)有限公司产品;OlymPus显微镜,奥林巴斯(中国)有限公司产品;超声波破碎仪(BILON),上海比朗仪器制造有限公司产品。
1.4 ORECs培养和生长曲线绘制 选取绵羊瘤胃背囊部分组织,将瘤胃组织修剪为直径8 cm的圆形,钝性分离肌层和浆膜层,保留黏膜层,用含有600 μg/mL青链霉素和20 μg/mL两性霉素的生理盐水多次冲洗。冲洗干净的组织用0.25% Trypsin-0.02% EDTA消化液于37 ℃消化,共消化7次,消化时间依次为40、30、20、10、6、5和3 min。显微镜下观察消化液,消化初期脱落的细胞大部分为角质细胞,仅有少量上皮细胞,均需要弃掉,消化后期在观察到有大量圆而亮的细胞(即上皮细胞)出现时,立即收集细胞并用等体积培养基终止消化,1 500 r/min离心5 min,取细胞沉淀置于完全培养基(DMEM/F12液体培养基中添加20%胎牛血清、100 μg/mL链霉素、50 μg/mL庆大霉素和100 μg/mL青霉素),培养3 d后观察细胞贴壁和生长情况,当细胞铺满培养瓶面积90%后传代,将F3代ORECs按照CCK-8试剂盒说明书绘制细胞生长曲线。将F3代细胞与50 μg/mL枯草芽孢杆菌细胞壁共培养24 h,观察细胞活性状态[13]。
1.5 枯草芽孢杆菌细胞壁制备和成分分析 按照梁栋等[12]的方法制备枯草芽孢杆菌细胞壁,并称重计算细胞壁得率(细胞壁质量÷菌体质量×100%),使用酶联免疫吸附测定(Enzyme linked immunosorbent assay,ELISA)方法分析枯草芽孢杆菌细胞壁成分,分别将细胞壁溶于稀释液中,配置为200 μg/mL肽聚糖含量待测液和500 μg/mL磷壁酸含量待测液。分别按照肽聚糖检测试剂盒(SND-Q070)和磷壁酸检测试剂盒(SND-Q090)说明书检测样品中肽聚糖和磷壁酸含量,试验重复3次。
1.6 RNA提取和实时荧光定量PCR(Real time fluorescence quantitative PCR,RT-qPCR) 枯草芽孢杆菌细胞壁与ORECs共培养,按照RNA提取试剂盒说明书提取细胞总RNA,将RNA浓度统一调至200 ng/μL,按照PrimeScript RT Master Mix说明书反转录为cDNA,将获得的cDNA分装保存于-80 ℃待用于RT-qPCR。特异性引物的设计和合成均由生工生物工程(上海)股份有限公司完成,引物信息如表1,RT-qPCR反应体系和反应程序均参照TB Green Fast qPCR Mix 试剂盒说明书。

表1 RT-qPCR引物信息
1.7 RT-qPCR检测信号通路因子mRNA表达水平变化 为了探究枯草芽孢杆菌细胞壁诱导ORECs SBD-1表达的信号通路,利用RT-qPCR技术检测刺激前后通路因子mRNA相对表达水平变化。将细胞瓶内状态良好的ORECs传代到6孔板中,待生长2 d细胞铺满整个6孔板后进行12 h的饥饿处理,将3个孔作为空白对照组,3个孔作为刺激组,空白对照组添加2 mL F12培养基(Ham's F12 nutrient medium)孵育12 h,刺激组添加2 mL浓度为50 μg/mL的枯草芽孢杆菌细胞壁作用12 h。提取各组ORECs总RNA,使用RT-qPCR技术检测刺激前后通路因子(TLR-2、MyD88、p38、JNK、NF-κB、ERK1/2)mRNA相对表达水平的变化。
1.8 蛋白免疫印迹(Western blot,WB)检测信号通路因子蛋白表达水平变化 利用WB技术检测枯草芽孢杆菌细胞壁刺激ORECs前后通路因子(TLR-2、MyD88、NF-κB、p38、JNK、ERK1/2)蛋白表达水平的变化。同1.7将细胞传到6孔板,3个孔作为空白对照组,3个孔作为刺激组,作用12 h后使用动物全蛋白提取试剂盒提取ORECs总蛋白,利用BCA法测定蛋白浓度,并将蛋白浓度调整为1 μg/mL,加热到100 ℃作用10 min使蛋白变性。电泳条件为先80 V 1 h,再120 V 1 h,转膜条件为200 mA 90 min,转膜后用5% 脱脂乳封闭3 h,用抗体TLR-2(1∶1 000)、MyD88(1∶1 000)、NF-κB(1∶2 000)、p38(1∶2 000)、JNK(1∶750)和ERK1/2(1∶750)4 ℃过夜孵育,洗膜后用相应的二抗孵育1.5 h,ECL显影并使用Image J进行灰度值分析。
1.9 阻断各信号通路对SBD-1 mRNA表达水平的影响 将ORECs传代至12孔板,待长满后饥饿处理12 h,按表2进行试验分组,空白对照组不进行抑制剂前处理,不添加枯草芽孢杆菌细胞壁;阴性对照组只进行抑制剂前处理,不添加枯草芽孢杆菌细胞壁;阳性对照组只添加枯草芽孢杆菌细胞壁;试验组进行抑制剂前处理并添加枯草芽孢杆菌细胞壁。根据试验需要对试验组和阴性对照组提前进行抑制剂前处理,即对细胞进行抑制剂温育2 h;阳性对照组和试验组添加枯草芽孢杆菌细胞壁作用12 h。利用RT-qPCR检测各组SBD-1 mRNA相对表达水平。
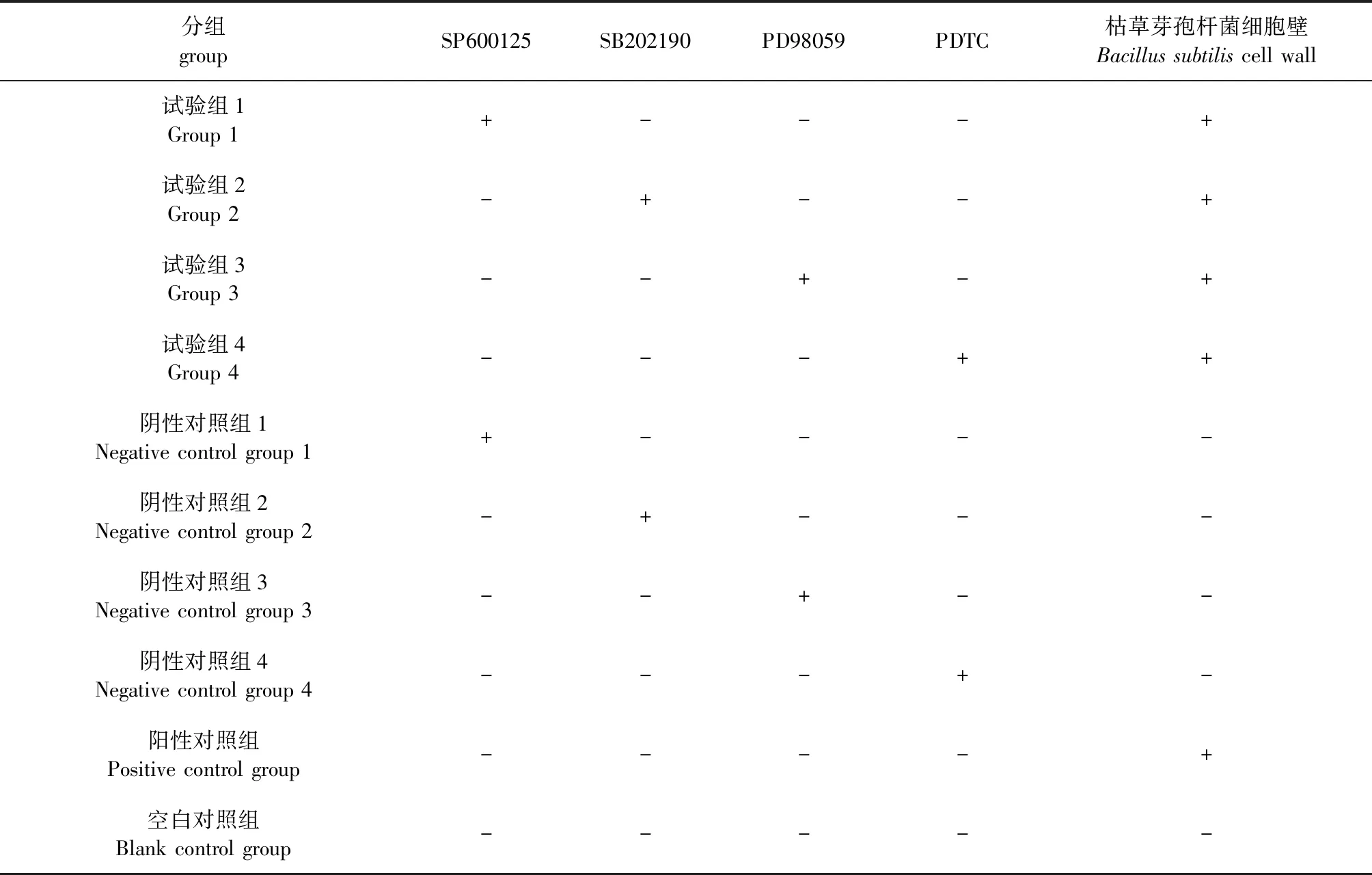
表2 不同抑制剂分组
1.10 统计分析 使用GraphPad Prism 7对试验结果进行作图和统计学分析,试验结果用“平均值±标准差”表示,P<0.05表示显著差异,P<0.01表示极显著差异。
2 结果
2.1 枯草芽孢杆菌细胞壁成分分析 枯草芽孢杆菌细胞壁冷冻干燥后经称重计算,细胞壁得率为27.5%。肽聚糖和磷壁酸标准曲线如图1A和图1B所示,3份200 μg/mL肽聚糖含量待测液样品OD值分别为0.209、0.208和0.212,根据试剂盒标准品曲线计算出含量分别为181.12、180.25和183.73 μg/mL,含量百分比分别为90.56%、90.12%和91.87%,取平均值为(90.85±0.91)%;3份500 μg/mL磷壁酸含量待测液样品OD值分别为0.344、0.345和0.337,根据试剂盒标准品曲线计算出含量分别为44.52、44.65和43.58 μg/mL,含量百分比分别为8.90%、8.93%和8.72%,取平均值为(8.85±0.11)%(图1C),因此,本试验提取出的枯草芽孢杆菌细胞壁主要成分为肽聚糖和磷壁酸,含量分别为(90.85±0.91)%和(8.85±0.11)%,细胞壁各组分占比如图1D所示。

图1 枯草芽孢杆菌细胞壁成分检测
2.2 ORECs培养和生长曲线绘制 原代ORECs生长2 d后贴壁(图2A);将原代细胞传代2次(F3)后,培养2 d后细胞生长迅速,细胞胞质清亮,边缘清晰,状态良好(图2B)。F3代细胞培养8 d,每天进行细胞计数,绘制生长曲线,呈典型的“S”型(图2C)。将F3代ORECs与50 μg/mL枯草芽孢杆菌细胞壁共培养24 h后,细胞形态大小无明显变化,无细胞脱落现象(图2D),与未处理正常F3代细胞(图2B)相比,细胞状态无明显变化。
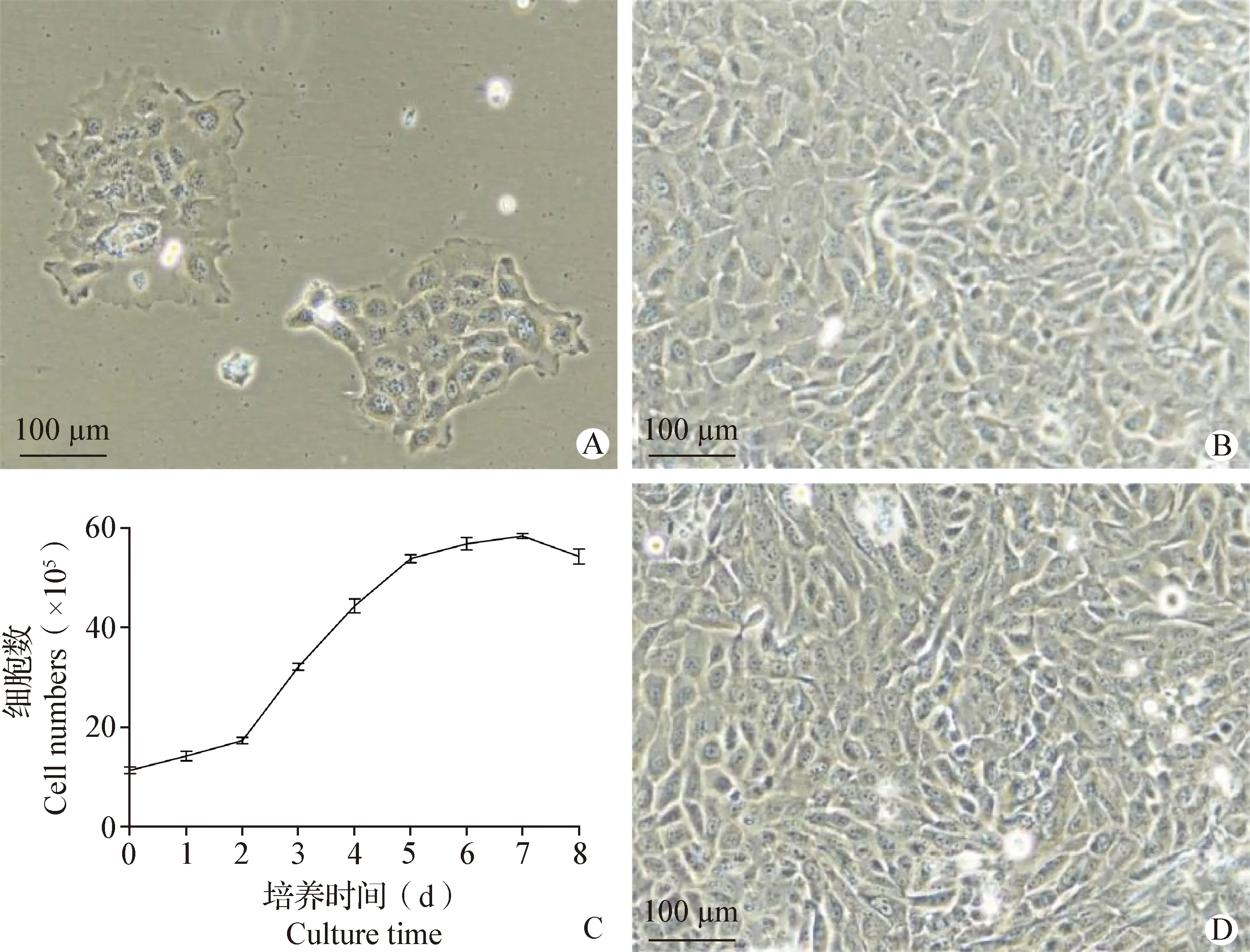
图2 ORECs培养状态观察(40×)和生长曲线
2.3 RT-qPCR检测各信号通路因子mRNA表达水平变化 结果如图3所示,刺激组信号通路因子TLR-2、MyD88、NF-κB、p38、JNK和ERK1/2 mRNA相对表达水平均极显著高于空白对照组(P<0.01),表明枯草芽孢杆菌细胞壁诱导ORECs SBD-1表达过程中信号通路因子TLR-2、MyD88、NF-κB、p38、JNK和ERK1/2的mRNA表达水平升高。

图3 枯草芽孢杆菌细胞壁对ORECs内信号通路因子mRNA相对表达水平的影响
2.4 WB检测各信号通路因子蛋白表达水平变化 结果如图4所示,刺激组信号通路因子TLR-2、MyD88、NF-κB、p38、JNK和ERK1/2蛋白表达水平均显著高于空白对照组(P<0.05或P<0.01),与RT-qPCR结果相符合,表明枯草芽孢杆菌细胞壁诱导ORECs SBD-1表达过程中会激活信号通路因子TLR-2、MyD88、NF-κB、p38、JNK和ERK1/2。

图4 枯草芽孢杆菌细胞壁对ORECs内信号通路因子蛋白相对表达水平的影响
2.5 阻断各信号通路对SBD-1 mRNA表达水平的影响 结果如图5所示,试验组的SBD-1 mRNA相对表达水平均极显著低于阳性对照组(P<0.01),下降幅度最显著的是经PDTC(NF-κB特异性抑制剂)和SP600125(JNK特异性抑制剂)预处理的试验组,同时阴性对照组与空白对照组之间的SBD-1 mRNA相对表达水平无显著性差异(P>0.05)。
3 讨论
抗菌药引起的耐药菌出现和药物残留等问题日益严重,对人、动物和环境造成的危害也日益突出[17]。因此,我国从2020年开始全面“禁抗”,以维护动物源食品安全和公共卫生安全[18]。这迫使饲料企业研发能够提高动物饲料利用率和抗病能力的饲料添加剂,而益生菌正是符合这一要求的饲料添加剂,并且可能成为反刍动物饲用抗菌药的理想替代品[19]。但是,要想安全高效的使用益生菌制剂,首先应该充分了解益生菌的主要有效成分和其发挥作用的机理。
随着生物科学的发展,防御素作为一种具有重要抗微生物活性的内源肽已经被用于预防和治疗疾病[20]。研究表明,各种益生菌刺激物能够通过MAPK和NF-κB信号通路介导上皮细胞中防御素的表达,这是由于MAPK和NF-κB家族成员控制着细胞因子、抗微生物效应因子的表达[21,22]。细菌细胞壁作为益生菌重要的菌体成分,在诱导防御素表达过程中发挥重要作用,且主要是通过MAPK和NF-κB信号通路诱导防御素表达。刘佳明等[23]研究表明,乳杆菌细胞壁可以通过NF-κB和MAPK中的p38通路诱导人阴道上皮细胞β-防御素的表达。
酿酒酵母细胞壁通过NF-κB和MAPK通路共同介导β-防御素的表达[24]。鼠李糖乳杆菌细胞壁主要通过NF-κB通路介导防御素的表达[25]。
辛雅明等[13]的研究已经证明,枯草芽孢杆菌细胞壁可以诱导SBD-1 mRNA和蛋白表达水平显著升高。本试验先从mRNA和蛋白水平检测使用枯草芽孢杆菌细胞壁刺激ORECs后TLR-2、MyD88、NF-κB、p38、JNK、ERK1/2表达水平的变化,以探索枯草芽孢杆菌细胞壁诱导SBD-1表达过程中激活的通路因子,结果显示,刺激后这些通路因子mRNA和蛋白表达水平均显著升高,表明枯草芽孢杆菌细胞壁诱导ORECs SBD-1表达与MAPK和NF-κB信号通路有关。为了进一步判定参与SBD-1表达的主要信号通路,本试验使用了添加抑制剂处理的方法,结果显示,经抑制剂处理后再用枯草芽孢杆菌细胞壁刺激ORECs,细胞中SBD-1 mRNA表达水平极显著下降,而下降幅度最显著的是经PDTC(NF-κB特异性抑制剂)和SP600125(JNK特异性抑制剂)预处理的试验组,此结果进一步表明了枯草芽孢杆菌细胞壁刺激ORECs诱导SBD-1表达的主要信号通路可能为TLR-2-MyD88-NF-κB和TLR-2-MyD88-JNK。
王佩等[9]研究证明,枯草芽孢杆菌活菌诱导ORECsSBD-1 mRNA的表达主要通过MAPK信号通路中的p38信号通路。赵霏霏等[26]研究表明,枯草芽孢杆菌灭活菌诱导ORECsSBD-1 mRNA的表达通过TLR-2-MyD88-MAPKs(p38、JNK、和 ERK1/2)信号通路介导,并且ERK1/2 信号通路是主要转导途径。本试验证明,枯草芽孢杆菌细胞壁作为枯草芽孢杆菌的菌体成分,其诱导SBD-1表达与NF-κB信号通路相关,且枯草芽孢杆菌细胞壁诱导SBD-1 mRNA的表达主要通过TLR-2-MyD88-NF-κB和TLR-2-MyD88-JNK信号通路。
韩超等[27]研究指出,枯草芽孢杆菌细胞壁主要成分是肽聚糖,还有少量的磷壁酸。本试验提取出的枯草芽孢杆菌细胞壁成分中肽聚糖含量为(90.85±0.91)%,磷壁酸含量为(8.85±0.11)%,此结果与上述报道基本一致。有研究指出,肽聚糖作为细胞壁的重要组成成分,具有诱导防御素表达的作用,如鼠李糖乳杆菌肽聚糖可以显著诱导禽β-防御素-9的产生[28]。磷壁酸虽然在细胞壁中占比较少,但其在免疫调节中发挥重要作用,例如,植物乳杆菌磷壁酸可以激活细胞膜受体TLR-2,从而激活ERK信号通路,调节机体炎症反应[29]。本试验发现,枯草芽孢杆菌细胞壁可以激活NF-κB和MAPK(JNK、ERK1/2、p38)信号通路,是肽聚糖或磷壁酸发挥作用还是二者协同发挥作用尚需进一步研究探索。
本试验有利于枯草芽孢杆菌的进一步开发利用,将枯草芽孢杆菌菌体组分作为一种饲料添加剂添加到饲料中可以提高家畜抗病能力,推动养殖业发展。本试验结果不仅为解释枯草芽孢杆菌细胞壁促免疫功能提供了新线索,而且对理解益生菌与防御素之间,以及益生菌与胃肠道上皮细胞之间的关系提供了参考。然而,体外单一的直接刺激ORECs很难模拟绵羊体内复杂的调控机制,下一步试验将会检测枯草芽孢杆菌细胞壁是否在绵羊体内经过一系列机体调控,进而显著诱导SBD-1基因的表达,增强动物的抗感染能力。
