指纹图谱结合一测多评法评价山楂叶质量Δ
2023-12-01李艳荣段丽颖杜义龙赵胜男潘海峰承德医学院中药研究所河北省中药研究与开发重点实验室河北承德067000北京工业大学医院药剂科北京004神威药业集团有限公司石家庄0540
李艳荣 ,段丽颖 ,魏 红 ,杜义龙 ,赵胜男 ,高 晗 ,潘海峰 #(.承德医学院中药研究所/河北省中药研究与开发重点实验室,河北 承德 067000;.北京工业大学医院药剂科,北京 004;.神威药业集团有限公司,石家庄 0540)
山楂叶是蔷薇科植物山里红CrataeguspinnatifidaBge.var.majorN.E.Br.或山楂CrataeguspinnatifidaBge.的干燥叶,具有活血化瘀、理气通脉、化浊降脂之功效[1]。现代研究表明,山楂叶主要含有黄酮类、萜类和有机酸类等化合物[2―3],具有抗动脉粥样硬化、降压降脂、增加冠状动脉血流量等药理活性[4―5],在心脑血管疾病治疗领域效果突出[6]。2020年版《中国药典》(一部)以金丝桃苷含量作为山楂叶药材的定量指标[1]。由于中药大多具有化学成分多、作用机制复杂、治疗效果多样等特点,因此单一成分难以全面反映药材质量,需要对药材质量进行整体控制[7]。指纹图谱是符合中药特点的质量控制模式之一,能够较全面地反映中药所含化学成分的种类和数量,从而体现中药的整体性和复杂性[8]。但指纹图谱无法表征已知成分的含量[9],故在其基础上进行多组分含量测定可以弥补上述不足。多组分含量测定多用外标法,但由于对照品价格昂贵、难以获得,使得检测成本较高。一测多评(quantitative analysis of multicomponents by single-marker,QAMS)法只需定量分析1个成分(内参物)即可实现多成分含量的同时测定[10],可有效解决对照品紧缺和检测成本高的问题。基于此,本研究对河北省承德市、辽宁省葫芦岛市、山西省运城市、山东省临沂市4 个主产地的78 批山楂叶药材进行指纹图谱研究和灰色关联分析(grey correlation analysis,GCA)、聚类分析(cluster analysis,CA)、主成分分析(principal component analysis,PCA)、正交偏最小二乘判别分析(orthogonal partial least squares-discriminant analysis,OPLS-DA),采用QAMS 法检测药材中5 种主要有效成分(绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷和异槲皮素[4―5])的含量,评价不同产地山楂叶的质量并筛选影响其质量的差异标志物,以期为全面评价山楂叶药材质量提供依据。
1 材料
1.1 主要仪器
本研究所用主要仪器有Agilent 1200型高效液相色谱(HPLC)仪(美国Agilent公司)、KQ-700型超声波清洗器(昆山市超声仪器有限公司)、AG-254 型十万分之一电子分析天平(瑞士Mettler Toledo公司)、HC-2062型高速离心机(科大创新股份有限公司中佳分公司)等。
1.2 主要药品与试剂
绿原酸对照品(批号18071907)、牡荆素葡萄糖苷对照品(批号20042305)、牡荆素鼠李糖苷对照品(批号20042304)、金丝桃苷对照品(批号19103001)、异槲皮素对照品(批号18062702)均购自成都普菲德生物技术有限公司,纯度均不低于98.0%;乙腈、四氢呋喃、甲酸均为色谱纯,其余试剂均为分析纯,水为纯净水。
78 批山楂叶药材(编号S1~S78)分别来自河北省承德市、山东省临沂市、辽宁省葫芦岛市、山西省运城市4 个主产地,经全国老中医药专家(传统鉴定)学术经验继承人孙宝惠主任药师鉴定,均为山里红C.pinnatifidaBge.var.majorN.E.Br.的干燥叶。78 批药材采自2020年10-11月和2021年10-11月,分别产自河北省承德市隆化县(编号S1、S4、S8、S10、S19、S22、S26、S28、S37、S39、S42、S44、S63~S67、S76~S78)、河北省承德市承德县(编号S2、S3、S6、S7、S20、S21、S24、S25、S38、S41、S60~S62)、河北省承德市滦平县(编号S9、S27、S43)、河北省承德市兴隆县(S5、S23、S40)、河北省承德市鹰手营子镇(编号S45)、辽宁省葫芦岛市建昌县(编号S12~S14、S29~S31、S50~S54、S68~S70)、山东省临沂市费县(编号S11、S46~S49)、山西省运城市夏县(编号S15~S18、S32~S36、S55~S59、S71~S75)。
2 方法与结果
2.1 色谱条件
以Agilent ZORBAX SB-C18(250 mm×4.6 mm,5 μm)为色谱柱,以乙腈-四氢呋喃混合溶液(体积比12∶1)为流动相A、0.3%甲酸溶液为流动相B进行梯度洗脱(0~15 min,8%A→12%A;15~25 min,12%A→16%A;25~38 min,16%A→15%A;38~45 min,15%A→20%A;45~50 min,20%A→34%A;50~55 min,34%A→100%A);流速为1.0 mL/min;柱温为30 ℃;检测波长为363 nm;进样量为10 μL。
2.2 溶液的制备
2.2.1 混合对照品溶液
取绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷、异槲皮素对照品各适量,精密称定,用甲醇溶解并定容,制成质量浓度分别为1.02、1.02、1.07、1.04、0.41 mg/mL 的单一对照品储备液。分别取上述单一对照品储备液适量,置于10 mL容量瓶中,以50%甲醇稀释,制成每1 mL 含绿原酸75.33 μg、牡荆素葡萄糖苷80.18 μg、牡荆素鼠李糖苷115.77 μg、金丝桃苷35.26 μg、异槲皮素12.40 μg的混合对照品溶液,摇匀,即得。
2.2.2 供试品溶液
取山楂叶药材,粉碎,取粉末(过80 目筛)约1.0 g,精密称定,置于具塞三角瓶中,精密加入60%甲醇50 mL,称重,超声(频率40 kHz,功率700 W,下同)提取30 min,放至室温后再次称重,用60%甲醇补足失重,静置,以12 000 r/min 离心10 min,取上清液,经0.45 μm 微孔滤膜滤过,取续滤液,即得。
2.3 指纹图谱分析
2.3.1 方法学考察
(1)精密度试验:取山楂叶供试品溶液(编号S43),按“2.1”项下色谱条件连续进样6次,记录色谱图。以峰4(保留时间适中且峰面积较大,下同)为参照峰,计算得各共有峰相对峰面积的RSD 均小于1.9%,各共有峰相对保留时间的RSD 均小于0.2%(n=6),表明方法精密度良好。
(2)重复性试验:取山楂叶药材(编号S43),粉碎,取粉末6 份,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样分析,记录色谱图。以峰4为参照峰,计算得各共有峰相对峰面积的RSD均小于1.6%,各共有峰相对保留时间的RSD 均小于0.2%(n=6),表明方法重复性良好。
(3)稳定性试验:取山楂叶供试品溶液(编号S43),分别于室温下放置0、2、4、8、12、24 h时按“2.1”项下色谱条件进样分析,记录色谱图。以峰4为参照峰,计算得各共有峰相对峰面积的RSD 均小于1.9%,各共有峰相对保留时间的RSD 均小于0.2%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
2.3.2 指纹图谱建立、共有峰指认和相似度评价
取78批山楂叶药材样品,粉碎,取粉末,按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样分析,记录色谱图。将图谱结果以“AIA”格式导出,利用《中药色谱指纹图谱相似度评价系统(2012 版)》,以S1样品图谱为参照,设定时间窗宽度为0.2 min,以中位数法结合多点校正,生成叠加指纹图谱和对照指纹图谱(R),具体见图1。共标定共有峰8 个,经对比混合对照品溶液色谱图(同法进样所得,具体见图2),指认了其中5个,分别为绿原酸(峰1)、牡荆素葡萄糖苷(峰3)、牡荆素鼠李糖苷(峰4)、金丝桃苷(峰7)、异槲皮素(峰8)。利用《中药色谱指纹图谱相似度评价系统(2012 版)》进行相似度评价,结果(表1)显示,78批样品指纹图谱与对照指纹图谱的相似度为0.871~0.998。

表1 78批山楂叶样品相似度评价及GCA分析结果
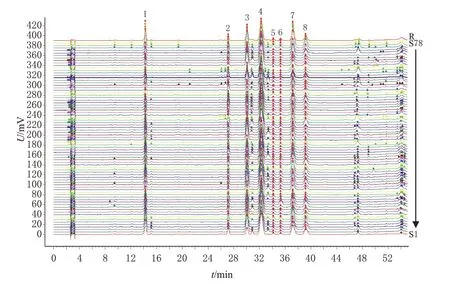
图1 78批山楂叶药材的HPLC叠加指纹图谱和对照指纹图谱(R)
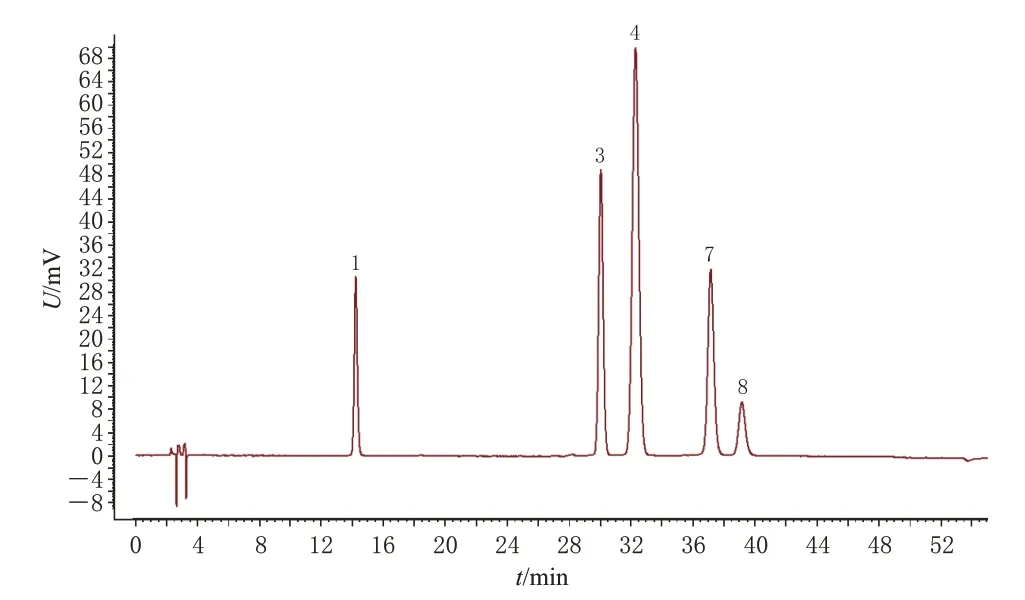
图2 混合对照品溶液的HPLC图
2.3.3 指纹图谱的化学模式识别分析
(1)GCA:以78 批山楂叶药材的8 个共有峰峰面积(采用均值法进行归一化处理)为评价指标并构建单元序列,选择最优参考序列和最差参考序列(其中最优、最差参考序列分别是所有样品的最大、最小值),计算各评价单元相对于最优、最差参考序列的相对最优、最差关联度及相对关联度,并对相对关联度进行排序,其中相对关联度大的样品质量较优[11]。结果(表1)显示,不同产地山楂叶药材的相对关联度为0.382~0.645,排前3位的S3、S7、S77 样品均产自河北省承德市。78 批样品中,河北省承德市、辽宁省葫芦岛市、山西省运城市、山东省临沂市样品的平均相对关联度分别为0.538、0.528、0.462、0.435。由此可知,河北省承德市样品的质量整体较优,其次为辽宁省葫芦岛市、山西省运城市、山东省临沂市样品。
(2)CA:CA 热图可对数据进行筛选、提取和降维,通过横向聚类来反映各样品之间的关系,纵向聚类来反映各化学成分之间的关系,该图通过渐变的蓝红色条来直观呈现数据结果,成分含量越高则条带颜色越红,反之越蓝[12]。本研究将4个主产地(河北省承德市、辽宁省葫芦岛市、山东省临沂市、山西省运城市)的78批山楂叶药材的8 个共有峰峰面积导入MetaboAnalyst 5.0 工具,相关数据经筛选、归一化处理后,得到CA热图(图3A)。由图3A可见,78批样品可分为2类,河北省承德市和辽宁省葫芦岛市样品大致分为一类,山东省临沂市和山西省运城市样品大致分为一类;结合热图的条带颜色可知,河北省承德市和辽宁省葫芦岛市样品中峰1、3、5、6、7、8 代表成分含量较高,山东省临沂市和山西省运城市样品中这6个成分含量则较低。
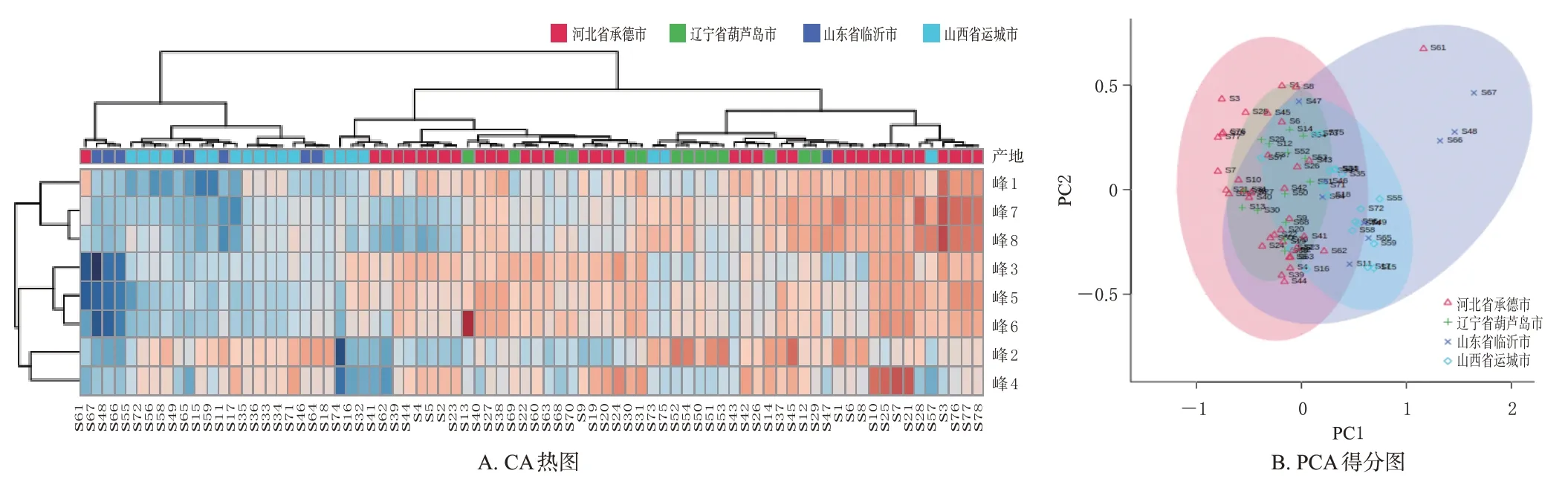
图3 78批山楂叶药材的CA热图和PCA得分图
(3)PCA:采用SPSS 19.0 软件,以78 批山楂叶药材的8 个共有峰峰面积为变量进行PCA,并进行KMO 检验及Bartlett 球形检验。结果显示,KMO 度量值为0.616,Bartlett 球形检验的P<0.001,可进行PCA[13]。将8 个共有峰峰面积导入MetaboAnalyst 5.0 工具,相关数据经筛选、归一化处理后,得到PCA得分图(图3B)。由图3B 可见,河北省承德市和辽宁省葫芦岛市样品大致可分为一类,山东省临沂市和山西省运城市样品大致可分为一类,与CA热图结果基本一致。
(4)OPLS-DA:为进一步明确差异标志物,本研究将78 批山楂叶药材的8 个共有峰峰面积导入SIMCA 14.1软件,建立OPLS-DA模型。由模型验证参数可知,模型的稳定性较好(R2X=0.843,R2Y=0.725)且交叉验证预测能力较强(Q2=0.532)[14]。置换检验的R2拟合直线在Y坐标轴上的截距为0.049 6(<0.3),说明所建模型可靠;Q2拟合直线在Y坐标轴上的截距为-0.188 0(<0.05),说明所建模型不存在过度拟合,可用于分析样品的组间差异[15]。提取OPLS-DA 模型中8 个共有峰的变量重要性投影(variable importance in the projection,VIP)值,以VIP 值>1 且误差线不超过原点为标准[16]进行差异标志物筛选,结果(图4)显示,峰1(绿原酸)、峰2、峰3(牡荆素葡萄糖苷)、峰5的VIP值均大于1,其对应成分为差异标志物,可能是影响山楂叶药材质量的主要化学成分。

图4 78批山楂叶药材8个共有峰的VIP值
2.4 5种有效成分含量的测定
2.4.1 方法学考察
(1)专属性试验:取山楂叶供试品溶液(编号S43)、混合对照品溶液和空白溶液(60%甲醇),按“2.1”项下色谱条件进样分析,记录色谱图(图略)。结果显示,空白溶液对各待测成分的测定无干扰,表明方法专属性良好。
(2)线性关系考察:精密吸取“2.2.1”项下5种单一对照品储备液各适量,置于同一10 mL 容量瓶中,以50%甲醇溶解并稀释,制成每1 mL含绿原酸192.00 μg、牡荆素葡萄糖苷204.00 μg、牡荆素鼠李糖苷300.00 μg、金丝桃苷131.82 μg、异槲皮素64.36 μg 的混合对照品溶液,记为1号混合对照品溶液;取1号混合对照品溶液适量,用50%甲醇分别稀释2、4、8、16、32、64、128 倍,分别记为2~8号混合对照品溶液。分别取上述1~8号混合对照品溶液,按“2.1”项下色谱条件进样分析,记录峰面积。以待测成分质量浓度为横坐标(X)、峰面积为纵坐标(Y)进行线性回归,结果见表2。

表2 5种待测成分的回归方程与线性范围
(3)精密度试验:取山楂叶供试品溶液(编号S43),按“2.1”项下色谱条件连续进样6次,记录峰面积。结果显示,绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷、异槲皮素峰面积的RSD 分别为0.41%、0.29%、0.36%、0.39%、0.53%(n=6),表明方法精密度良好。
(4)重复性试验:精密称取山楂叶药材样品(编号S43),共6份,分别按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样分析,记录峰面积并按外标法计算各成分含量。结果显示,绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷、异槲皮素含量的RSD分别为1.57%、2.48%、2.34%、2.44%、1.93%(n=6),表明方法重复性良好。
(5)稳定性试验:取山楂叶供试品溶液(编号S43),分别于室温下放置0、2、4、8、12、24 h时按“2.1”项下色谱条件进样分析,记录峰面积。结果显示,绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷、异槲皮素峰面积的RSD 分别为0.63%、0.56%、0.84%、0.66%、1.29%(n=6),表明供试品溶液在室温下放置24 h内稳定性良好。
(6)加样回收率试验:取已知含量的山楂叶药材样品(编号S43)约0.5 g,共6 份,精密称定,分别加入单一对照品储备液适量(加入量与已知量相等),按“2.2.2”项下方法制备供试品溶液,再按“2.1”项下色谱条件进样分析,记录峰面积并计算加样回收率。结果显示,绿原酸、牡荆素葡萄糖苷、牡荆素鼠李糖苷、金丝桃苷和异槲皮素的平均加样回收率分别为97.37%、101.44%、102.18%、96.79%、102.00%,RSD 分别为0.51%、0.67%、0.46%、0.72%、2.67%(n=6),表明方法准确度良好。
2.4.2 相对校正因子的计算
以牡荆素鼠李糖苷为内参物(含量较高),取“2.4.1(2)”项下1~8 号混合对照品溶液,按“2.1”项下色谱条件进样分析,记录峰面积并按下式计算相对校正因子(fK/S):fK/S=(CK×AS)/(CS×AK)(CS为内参物的质量浓度,AS为内参物的峰面积,Ck为待测成分的质量浓度,Ak为待测成分的峰面积)。结果显示,绿原酸、牡荆素葡萄糖苷、金丝桃苷、异槲皮素的平均相对校正因子分别为0.401、0.993、1.670、1.615,RSD 分别为1.58%、0.64%、0.38%、0.39%(n=8)。
2.4.3 不同试验条件对相对校正因子的影响
取“2.4.1(2)”项下1~8号混合对照品溶液,按“2.1”项下色谱条件进样分析,考察不同仪器(Agilent 1200、1100、1220 型HPLC 仪)、不同色谱柱[Agilent ZORBAX SB-C18、Agilent 5 HC-C18(2)、Shiseido CAPCELL PAKC18,规格一致]、不同流速(0.8、1.0、1.2 mL/min)、不同柱温(25、30、35 ℃)对相对校正因子的影响。结果显示,在上述条件下,绿原酸、牡荆素葡萄糖苷、金丝桃苷、异槲皮素的相对校正因子分别为0.374~0.404、0.979~1.003、1.626~1.725、1.579~1.647,RSD 分别为2.32%、0.67%、1.56%、1.24%(n=12),表明方法耐用性良好。
2.4.4 色谱峰定位
采用相对保留时间法进行色谱峰定位。取“2.4.1(2)”项下1~8 号混合对照品溶液,按“2.1”项下色谱条件进样分析,记录峰面积。以牡荆素鼠李糖苷为内参物,计算其余4个成分的相对保留时间。结果显示,绿原酸、牡荆素葡萄糖苷、金丝桃苷、异槲皮素的相对保留时间分别为0.422、0.930、1.540、1.218,RSD 分别为0.04%、0.02%、0.04%、0.15%(n=8)。
2.4.5 样品含量测定及比较
取78 批山楂叶药材的供试品溶液,按“2.1”项下色谱条件进样分析,记录峰面积,分别采用外标法和QAMS 法计算5 种成分的含量(内参物含量仅以外标法计算),并计算2 种方法结果的相对偏差(relative deviation,RD)。各样品平行测定2 次,结果以平均值展示。结果(图5)显示,78 批样品中,4 种成分的2 种方法含量测定结果较接近,除2批样品(S39和S41)中异槲皮素含量的RD值超过5%外,其余成分含量的RD值均不高于5%,提示2种检测方法结果无明显差异。

图5 78批山楂叶药材中5种有效成分含量的QAMS法与外标法测定结果比较(n=2)
3 讨论
3.1 指纹图谱结果分析
我国山楂栽培产地大致可分为京津冀、吉辽、中原等五大产区,主要产地有河北、辽宁、吉林、山东、山西等地[17]。本研究收集了2020年10-11月、2021年10-11月河北省承德市、山东省临沂市、辽宁省葫芦岛市、山西省运城市4个山楂叶主产地的78批样品,样品跨越2个年份且样品量充足,具有一定的代表性。中药指纹图谱具有整体性、全面性和系统性特点,能够全面反映中药材和中成药的质量[18]。本研究通过考察提取溶剂、提取方法、提取时间和色谱柱、流速、柱温、流动相比例等条件,对供试品溶液制备和色谱条件进行了优化,并建立了78 批山楂叶药材的指纹图谱,确定了8 个共有峰,指认了其中5个成分;各批样品的相似度为0.871~0.998,提示4个产地的山楂叶药材存在一定差异。本研究所建指纹图谱简单、易行,且HPLC法普适性强,可用于山楂叶药材的质量评价。
3.2 化学模式识别结果分析
指纹图谱结合化学模式识别能真实、形象地反映中药的质量差异,揭示其复杂成分之间的潜在规律,已被广泛用于中药质量控制及差异标志物的筛选[12]。GCA结果显示,78 批样品中,相对关联度为0.382~0.645,排前3位的S3、S7、S77样品均产自河北省承德市。各产地的平均相对关联度分别为河北省承德市0.538、辽宁省葫芦岛市0.528、山西省运城市0.462、山东省临沂市0.435,即药材质量优劣排序为河北省承德市、辽宁省葫芦岛市、山西省运城市、山东省临沂市样品。CA热图显示,78 批样品可分为2 类,河北省承德市和辽宁省葫芦岛市样品大致分为一类,山西省运城市和山东省临沂市样品大致分为一类;PCA 分类结果与聚类分析结果一致。笔者分析认为,分类结果可能与海拔、经纬度、光照、气候等药材生长环境因素有关。OPLS-DA 结果显示,峰1(绿原酸)、峰2、峰3(牡荆素葡萄糖苷)、峰5 的VIP 值均大于1,表明其对应成分可能是影响山楂叶药材质量的差异标志物,后续可对上述2个未知成分进行鉴定,有助于对药材进行全面质量控制和溯源。同时,本研究结果提示,在控制山楂叶药材质量时,可考虑增加含量较高的共有性成分(如牡荆素鼠李糖苷)和差异性成分(如牡荆素葡萄糖苷)作为检测指标,从而更科学、全面地评价不同产地山楂叶药材的品质。
3.3 含量测定结果分析
中药成分复杂,具有多成分、多靶点作用的特点,仅用单一成分无法全面表征其质量的优劣,而多成分检测因对照品不易获得、价格昂贵、溶液配制耗时等不足导致检测成本较高。山楂叶的主要有效成分为黄酮类化合物,牡荆素鼠李糖苷为山楂叶中含量较高的共有性成分[4―5],故本研究以该成分为内参物,同时测定了绿原酸、牡荆素葡萄糖苷、金丝桃苷和异槲皮素的含量。本研究结果显示,不同仪器、色谱柱、流速、柱温条件下,各成分相对校正因子的RSD 均小于2.5%;外标法与QAMS 法比较,除2 批样品(S39、S41)中异槲皮素含量的RD 值超过5%外,其余成分的测定结果均无明显差异,说明QAMS法可用于山楂叶药材中多种有效成分的含量测定。
综上,所建HPLC 指纹图谱结合QAMS 法操作简单,可用于山楂叶药材的质量评价;河北省承德市样品质量较优;绿原酸(峰1)、牡荆素葡萄糖苷(峰3)和峰2、5对应成分可能是影响山楂叶药材质量的差异标志物。
