水虻HiACC和HiFAS的克隆与表达模式分析
2023-11-30朱丽景严婷婷董梦瑶周煜琛蔡珉敏张吉斌喻子牛郑龙玉
朱丽景,严婷婷,董梦瑶,周煜琛,蔡珉敏,黄 凤,张吉斌,喻子牛,郑龙玉
(华中农业大学,湖北 武汉 430070)
亮斑扁角水虻(HermetiaillucensL.,black soldier fly),属于双翅目(Diptera)、水虻科(Stratiomyidae)、扁角水虻属昆虫,在全球亚热带及热带地区均有分布[1-2]。水虻是一种重要的资源昆虫,蛋白和脂肪含量高是其重要特征之一。其幼虫具有生长周期短、易获得、油脂含量高等特点,利用水虻幼虫生产昆虫油脂及其下游产物生物柴油[3],为构筑新型的绿色、循环、可持续产业体系提供了新思路,具有重要的现实意义[4]。昆虫机体需精细表达调控来合成重要供能物质油脂,进而辅助完成生长、发育、繁殖、信息交流等生命过程[5]。揭示水虻油脂合成代谢通路关键基因表达模式及分子调控机理有助于优化水虻的生产性能,为水虻油脂大量定向积累、提升畜禽粪便等有机废弃物的资源化利用效率、实现废弃物向绿色能源的高效转换提供理论支撑,进而助力我国未来能源保障[6]。
昆虫脂肪体是维持体内能量平衡的动力来源,也是在变态过程中长时间不进食时脂肪的必要储藏库[7-8]。大部分营养物质被昆虫吸收后,以甘油三酯形式储存在体内[9]。而用于合成甘油三酯的脂肪酸是膜组分和信号分子的重要前体,其合成通路在维持昆虫体内平衡起重要作用[10-11]。脂肪酸合成是一个复杂的多步反应过程,主要由乙酰辅酶 A 羧化酶( acetyl-coenzyme A carboxylase,ACC) 、脂肪酸合成酶( fatty acid synthase,FAS) 、去饱和酶( fatty acid desaturase,FAD) 等参与完成[12-13]。在脂肪酸从头合成通路中,关键限速酶主要是ACC、FAS[14]。作者所在课题组前期获得了完整的水虻基因组[15],并通过转录组数据与基因组数据结合分析确定了参与水虻油脂合成的重要酶,包括乙酰辅酶 A 羧化酶 ACC(HiOGS00269)、脂肪酸合成酶 FAS(HiOGS16234,HiOGS10629,HiOGS07375)、甘油-3-磷酸-酰基转移酶 GPAT3_4(HiOGS13303,HiOGS14391)和二酰基甘油酰基转移酶 DGAT1(HiOGS02525)[16]。研究发现,RNA干扰黑腹果蝇脂肪体中的ACC,会导致储存的甘油三酯急剧减少[17];敲除埃及伊蚊体内ACC和脂肪酸合成酶1(FAS1)基因后,脂肪体脂质生物合成和中肠消化速率减慢[12];猿叶虫FAS2酶参与滞育期的脂质积累,积累的脂质在滞育期有调节抗胁迫基因表达和含水量的作用[18];沉默斜纹夜蛾3龄幼虫的SlFAS1基因可以抑制脂肪酸和甘油三酯的合成,进而影响其发育[19]。上述研究表明,ACC和FAS在昆虫中的功能主要包括影响脂质积累、表皮脂质合成、胁迫耐受力等。因此,研究ACC和FAS的基因对于理解水虻脂肪酸合成途径以及提高水虻油脂大量定向积累具有重要意义[20]。
目前,关于水虻脂质代谢的研究主要集中在饲料基质、营养添加剂等营养因子对水虻粗脂肪、粗蛋白及脂肪酸组成的影响,缺乏系统性的基因功能与表达调控研究[21]。鉴于此,作者通过实时荧光定量 PCR(RT-qPCR)克隆获得ACC和FAS的基因开放阅读框(open reading frame,ORF)全长,对其进行序列分析和系统进化树构建,并利用RT-qPCR 检测分析其在水虻不同发育阶段、组织、营养条件下的表达模式,为深入研究水虻ACC和FAS基因在水虻油脂合成中的表达调控机制,实现水虻油脂的高效积累提供理论支撑。
1 实验
1.1 材料
水虻为武汉品系,由华中农业大学国家微生物农药工程研究中心提供。饲养条件:由麸皮和小麦次粉按质量比1∶1配制成人工饲料,湿度保持在70%~80%,饲养温度约(28±2) ℃,光周期为14 L∶10 D。
1.2 样品前处理
分别收集水虻卵、1龄、2龄、3龄、4龄、5龄、预蛹、蛹、成虫等9个不同发育阶段的样品和4龄、5龄幼虫的头部、表皮、前中肠、后肠、脂肪体等 5个不同组织样品,样品均按5头为1个生物学重复,共设3个生物学重复。
挑选发育基本一致、健康的5龄幼虫100头于不含食物的塑料白桶中(塑料白桶底部均匀铺满湿润的棉花)饲养,作为饥饿组;挑选发育基本一致、健康的5龄幼虫100头于含高脂人工饲料(10%大豆油+基础饲料)的塑料白桶中饲养,作为高脂饲喂组;挑选发育基本一致、健康的5龄幼虫100头于含基础饲料的塑料白桶中正常饲养,作为基础饲喂对照组。4 d后,分别收集处理组和对照组水虻幼虫,置于含有约200 μL Trizol 的 1.5 mL 离心管中,用液氮迅速冷冻,置于-80 ℃冰箱中保存,各组做3个重复。
1.3 总RNA提取和cDNA合成
使用Trizol Reagent试剂提取各样品中的总RNA,利用Nano Drop One超微量分光光度计和琼脂糖凝胶电泳检测总RNA浓度和质量。使用HiScipt®Ⅲ 1st Strand cDNA Synthesis Kit试剂盒合成cDNA第1链,用于后续基因克隆和RT-qPCR实验。
1.4 引物设计
从实验室水虻基因组及转录组数据库中筛选获得ACC基因和FAS基因的cDNA全长序列。利用NCBI Primer Blast软件设计基因克隆引物及RT-qPCR引物。在RT-qPCR实验中,选择已公布的水虻Tublin、PR49基因作为内参基因,引物均由武汉擎科生物科技有限公司合成。引物序列如下:ACC-F:5′-CGTGCTGTTCGTTTCGTTGT-3′;ACC-R:5′-GGCAAC- GTTGGAATATCGGC-3′;FAS1-F:5′-GGTGTTG-AAATGCGTGGCT-3′;FAS1-R:5′-GACCTTCTTCCTGTTGCGGA-3′;FAS2-F:5′-GGTGTTGAAATGC-GTGGCTT-3′;FAS2-R:5′-ACCTTCTTCCTGTTGCGGA-3′;FAS3-F:5′-CAAGGACCGTAAGACCCC-AC-3′;FAS3-R:5′-AAATTGGCCGCTTTGTGTCC-3′;qPCR-ACC-F:5′-ACAACCGAAGATTACAGCCG-3′;qPCR-ACC-R:5′-GACAACATAGGAACCAATACCAA-3′;qPCR-FAS1-F:5′-TTGTGCCTATGCCGATG-GTT-3′;qPCR-FAS1-R:5′-TTGTGGCAAGCAGCA-ATCAC-3′;qPCR-FAS2-F:5′-ATCAATCGGGCGA-AACCCTT-3′;qPCR-FAS2-R:5′-ACACTACGGGG-GTTTGTGAC-3′;qPCR-FAS3-F:5′-AAGCGTGGTA-CAATGTCGGT-3′;qPCR-FAS3-R:5′-ACGTACCGAA-GGAGTAGCCT-3′;qPCR-Tublin-F:5′-GCTCTCTA-CGACATCTGCTTTA-3′;qPCR-Tublin-R:5′-CAGGT-GGTAACTCCAGACATT-3′;qPCR-RP49-F:5′-CCCA-CTGGCTTCAAGAAGTT-3′;qPCR-RP49-R:5′-CG-AAACTCCATGTGCGATCT-3′。
1.5 基因克隆
根据引物序列,利用 RT-qPCR技术扩增HiACC、HiFAS1、HiFAS2、HiFAS3 的ORF 全长序列。PCR 反应体系(20 μL):cDNA 模板 2 μL,10 μmol·L-1正、反向引物各 1 μL,ddH2O 6 μL,2×Taq Mix 10 μL。PCR 反应条件:94 ℃预变性10 min;94 ℃变性30 s,52~62 ℃(根据引物的退火温度调整)退火30 s,72 ℃延伸90 s,30 个循环;72 ℃彻底延伸8 min。利用琼脂糖凝胶电泳对 PCR 产物进行检测,目的片段通过胶回收试剂盒回收,回收产物连接至pMD18-T克隆载体并转化到大肠杆菌DH5α感受态细胞中,将菌液转移至氨苄青霉素抗性的LB固体培养基平板上,37 ℃过夜培养,挑取白色单克隆菌斑进行菌液 PCR鉴定后,将阳性菌液送武汉擎科生物科技有限公司进行测序。
1.6 生物信息学分析
用如下在线工具或软件对目的基因序列进行生物信息学分析:亚细胞定位预测:Euk-m PLoc 2.0(http://www.csbio.sjtu.edu.cn/bioinf/euk-multi-2/);氨基酸序列预测:ExPASy(http://web.expasy.org/translate/);可磷酸化位点预测:Net Phos3.1 Server(http://www.cbs.dtu.dk/services/Net Phos/);保守结构域分析:SMART(http://smart.embl-heidelberg.de/smart/set/);跨膜结构域预测:TMHMM Services 2.0(http://www.ebs.dtu.dk/services/TMHMM/);理化性质分析:Protparam(http://web.expasyorg/cgi-bin/protparam);系统进化树构建:MEGA7.0;信号肽预测:SignalP4.0 Server(http://www.ebs.dtu.dk/services/SignalP/)。
1.7 表达模式检测
使用 ChamQ Universal SYBR®qPCR Master Mix进行RT-qPCR,检测HiACC、HiFAS1、HiFAS2、HiFAS3等4个基因在水虻9个发育阶段、4龄和5龄幼虫的5个不同组织、3种营养条件下处理4 d后水虻幼虫的表达模式。反应体系(10 μL):2 × ChamQ Universal SYBR Master Mix 5 μL,cDNA 模板 1 μL,正、反向引物各0.5 μL,ddH2O 3 μL。PCR反应条件:95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火+延伸30 s,40 个循环;溶解曲线采集程序:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,60 ℃ 1 min。每个样品做3 个生物学重复和 4个技术性重复。采用2-ΔΔCT法分析基因相对表达量。
1.8 数据分析
采用 SPSS 19.0 软件中的 ANOVA 法对实验数据进行单因素方差分析,采用GraphPad Prism8软件进行分析和作图,数据表示为平均值±标准偏差(sd)。
2 结果与讨论
2.1 水虻脂肪酸合成关键基因的克隆与序列分析
利用RT-qPCR克隆获得HiACC、HiFAS1、HiFAS2、HiFAS3的ORF全长序列,基于果蝇的ACC和FAS基因序列,在水虻基因组数据库中通过同源搜索鉴定到1个ACC和3个FAS基因,分别命名为HiACC、HiFAS1、HiFAS2、HiFAS3。利用生物信息学软件对目的序列进行分析,目的基因的序列特征和理化性质如表1所示,预测的蛋白功能结构域示意图如图1所示。

图1 水虻脂肪酸合成关键基因蛋白的预测功能结构域示意图Fig.1 Schematic diagram of predicted functional domains of key gene proteins for fatty acid synthesis in black soldier fly
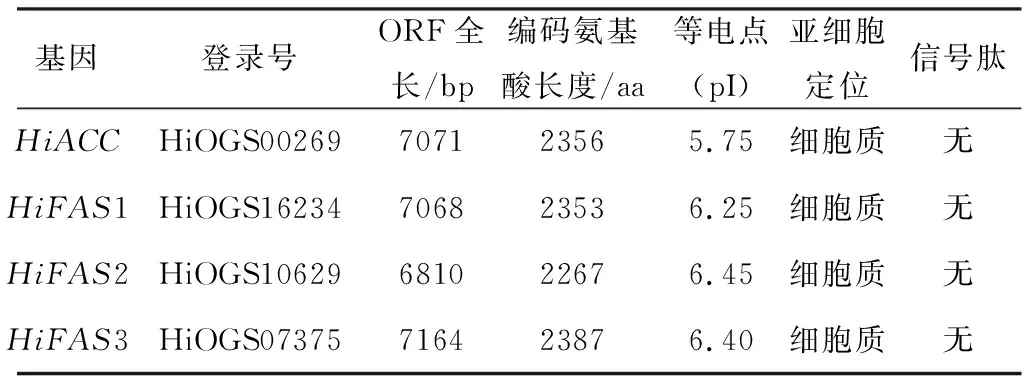
表1 水虻脂肪酸合成关键基因的序列特征和理化性质
由表1可知,HiACC、HiFAS1、HiFAS2、HiFAS3等4个基因的ORF全长分别为7 071 bp、7 068 bp、6 810 bp、7 164 bp,编码氨基酸长度分别为2 356 aa、2 353 aa、2 267 aa、2 387 aa,等电点分别为5.75、6.25、6.45、6.40,4个蛋白亚细胞均定位于细胞质,不含信号肽蛋白,没有跨膜结构,含有多个丝氨酸、苏氨酸、酪氨酸可磷酸化位点。
由图1可知,HiACC蛋白结构域包括乙酰辅酶A羧化酶核心域(ACC-central)、羧基转移酶结构域(Carboxyl-trans)以及保守的生物素载体蛋白(Biotin-carb-N,BcN;Biotin-carb-C,BcC;Biotin-lipoyl,Bl;CP-Sase-L-D2,CLD2)结构域。HiFAS1、HiFAS2、HiFAS3蛋白均含有8个相同的功能结构域:7个FAS蛋白保守催化功能结构域β-羟酰脱水酶(PS-DH)、烯酰还原酶(PKS-ER)、β-酮乙基还原酶(PKS-KR)、酰基载体蛋白(PP-binding,Pb)、丙二酰基转移酶(Acyl-transf-1,At1)、硫酯酶(Thioesterase,Th)、酮脂酰合成酶(Ks)和1个Kasynt-C-assoc(KCa)功能结构域。表明HiACC、HiFAS1、HiFAS2、HiFAS3均含有典型的催化功能结构域。
2.2 水虻脂肪酸合成关键基因的系统发育树
将水虻脂肪酸合成关键基因的蛋白氨基酸序列上传至NCBI数据库中进行Blast比对,根据氨基酸序列的同源性比对结果,下载同源性较高物种的ACC、FAS蛋白氨基酸序列。选取2种哺乳动物和5个目中的12种昆虫的ACC氨基酸序列与水虻的HiACC氨基酸序列进行ClustarW多序列比对,包括智人、家鼠、家蝇、黑腹果蝇、铜绿蝇、厩螫蝇、致倦库蚊、埃及伊蚊、豌豆蚜、家蚕、小菜蛾、烟草天蛾、赤拟谷盗、意大利蜜蜂、德国小蠊。选取1种哺乳动物和7个目中的11种昆虫的FAS1、FAS2、FAS3氨基酸序列与水虻的HiFAS1、HiFAS2、HiFAS3氨基酸序列进行ClustarW多序列比对,包括家鼠、家蝇、黑腹果蝇、豌豆蚜、家蚕、烟草天蛾、赤拟谷盗、意大利蜜蜂、茧蜂、蝇蛹金小蜂、德国小蠊、飞蝗。使用MEGA7.0软件的N-J邻接法构建系统发育树,结果如图2所示。

注:哺乳动物:智人(Homo sapiens,Hs)、家鼠(Mus musculus,Mm);双翅目昆虫:家蝇(Musca domestica,Md)、黑腹果蝇(Drosophila melanogaster,Dm)、铜绿蝇(Lucilia cuprina,Lc)、厩螫蝇(Stomoxys calcitrans,Sc)、致倦库蚊(Culex quinquefasciatus,Cq)、埃及伊蚊(Aedes aegypti,Aa);半翅目昆虫:豌豆蚜(Acyrthosiphon pisum,Ap);鳞翅目昆虫:家蚕(Bombyx mori,Bm)、小菜蛾(Plutella xylostella,Px)、烟草天蛾(Manduca sexta,Ms);鞘翅目昆虫:赤拟谷盗(Tribolium castaneum,Tc);膜翅目昆虫:意大利蜜蜂(Apis mellifera,Am)、茧蜂(Chelonus insularis,Ci)、蝇蛹金小蜂(Nasonia vitripennis,Nv);蜚蠊目昆虫:德国小蠊(Blattella germanica,Bg);直翅目昆虫:飞蝗(Locusta migratoria,Lm)。
由图2a可知,水虻HiACC氨基酸序列与黑腹果蝇DmACC的亲缘关系较近。由图2b可知,水虻HiFAS1、HiFAS2、HiFAS3分别与黑腹果蝇DmFAS1、DmFAS2、DmFAS3的亲缘关系较近。HiFAS3蛋白和HiFAS1、HiFAS2蛋白聚在不同的分支上,推测HiFAS3与HiFAS1、HiFAS2的功能有较大差异,HiFAS1与HiFAS2的生物功能相似。系统发育树分析显示,水虻的HiACC、HiFAS1、HiFAS2、HiFAS3氨基酸序列与黑腹果蝇的DmACC、DmFAS1、DmFAS2、DmFAS3氨基酸序列亲缘关系较近,表明这4个基因蛋白质在双翅目昆虫中高度保守。
2.3 水虻脂肪酸合成关键基因在不同发育阶段的表达模式
选取水虻卵、1~5龄幼虫、预蛹、蛹、成虫等9个发育阶段的样品,利用RT-qPCR检测水虻脂肪酸合成关键基因在不同发育阶段的相对表达量,结果如图3所示。

注:各柱上不同小写字母代表显著性差异(P<0.05,ANOVA,LSD),误差棒代表3次校准差的平均值,下图同。
由图3可知,基因HiACC、HiFAS1、HiFAS2、HiFAS3在水虻整个生长发育阶段均有表达,在卵期、4~5龄幼虫期表达量较高,在蛹期表达量较低。水虻卵期脂肪酸合成关键基因的高表达,说明这4个基因在卵发育积累营养物质期间发挥重要作用;在水虻幼虫经历蜕皮发育到下一个幼虫龄期的过程中,脂肪酸合成关键基因的表达量也逐步升高,说明这4个基因在幼虫的生长发育过程中具有重要的作用;在蛹期,水虻将预蛹期积累的大量营养物质分解代谢供能于变态发育进行下一步羽化,此时脂肪酸合成关键基因几乎不表达,该现象与此阶段的生命活动功能相对应。发育阶段表达模式分析表明,HiACC、HiFAS1、HiFAS2、HiFAS3是影响水虻卵孵化、蜕皮变态发育、脂质积累过程中的重要基因。水虻脂肪酸的合成与发育阶段有一定的相关性,在卵孵化和中龄幼虫期脂代谢速率快,从而导致脂肪酸合成关键基因的高水平表达。
2.4 水虻脂肪酸合成关键基因在不同组织中的表达模式
解剖水虻4龄、5龄幼虫的5个不同组织(头、表皮、前中肠、后肠和脂肪体),利用RT-qPCR检测水虻脂肪酸合成关键基因在4龄、5龄幼虫不同组织中的相对表达量,结果如图4所示。
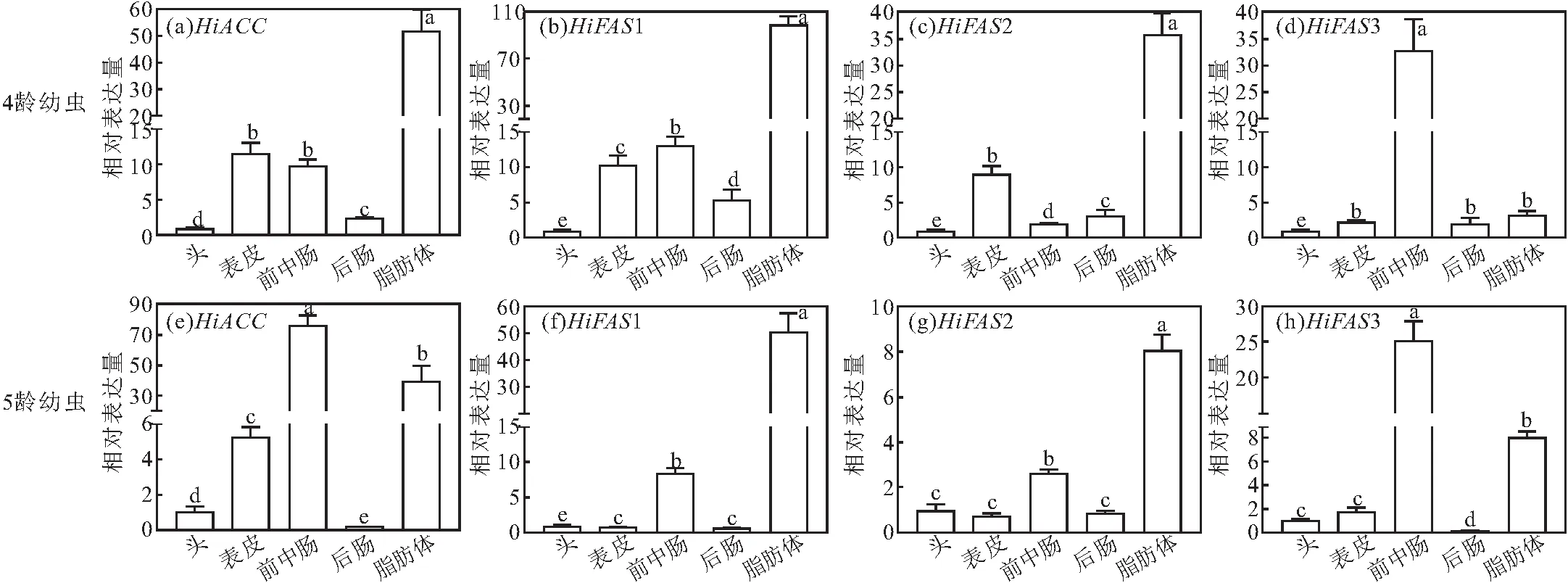
图4 水虻脂肪酸合成关键基因在4龄、5龄幼虫不同组织中的相对表达量Fig.4 Relative expression levels of key genes for fatty acid synthesis in different tissues of 4th to 5th instar larvae of black soldier fly
由图4可知,基因HiACC、HiFAS1、HiFAS2、HiFAS3在4龄、5龄幼虫的不同组织中均有表达,其中在脂肪体、前中肠和表皮中的表达量较高,在头和后肠中的表达量较低。表明上述4个基因在水虻的脂质储存和脂质吸收过程中发挥重要作用。HiACC、HiFAS1、HiFAS2、HiFAS3在中龄(4龄、5龄)幼虫的表皮中表达量较高,这可能与幼虫的蜕皮发育过程相关,推测水虻脂肪酸合成关键基因与其表皮脂质的合成相关。
与水虻4龄幼虫相比,5龄幼虫4个基因在各个组织的表达模式有所不同。但从总体变化趋势上看,HiFAS1、HiFAS2这2个基因在4龄、5龄幼虫的脂肪体组织中均有最高的相对表达量;HiFAS3在4龄、5龄幼虫的前中肠中均有最高的相对表达量;特别是,与4龄幼虫相比,5龄幼虫HiACC在各组织中的最高相对表达量由脂肪体转变为前中肠。表明HiACC、HiFAS1、HiFAS2、HiFAS3可能密切参与水虻脂质积累或脂肪酸代谢活动,同时在不同组织间的表达量差异也与其功能多样性相关。
2.5 水虻脂肪酸合成关键基因在不同营养条件下的表达模式
水虻5龄幼虫分别经饥饿、基础饲料添加大豆油喂食、基础饲料喂食处理4 d后,通过RT-qPCR技术检测水虻脂肪酸合成关键基因在不同营养条件下的相对表达量,结果如图5所示。

图5 水虻脂肪酸合成关键基因在不同营养条件下的相对表达量Fig.5 Relative expression levels of key genes for fatty acid synthesis in black soldier fly under different nutritional conditions
由图5可知,基因HiACC、HiFAS1、HiFAS2、HiFAS3在不同营养条件下的表达水平顺序为:基础饲喂对照组>高脂饲喂组>饥饿组。与基础饲喂对照组相比,饥饿组、高脂饲喂组的4个基因的相对表达量均显著下调。推测在饥饿胁迫下,水虻体内储存的三酰甘油用于氧化分解供能维持基础生命活动,机体脂质分解代谢速率快于脂质合成速率,导致水虻脂肪酸合成关键基因表达量显著低于基础饲喂对照组;推测在高脂胁迫后,水虻通过脂质代谢各通路间的协调,减少饲料的进食,导致水虻幼虫发育期的延长和个体大小的改变,从而使脂肪酸合成速率减慢,脂肪酸合成关键基因表达显著下调。上述分析表明,水虻幼虫在受到营养胁迫后,可能通过下调脂肪酸合成关键基因的表达,加强氧化分解体内储存的甘油三酯来供能以应对不适生存条件的威胁。
3 结论
通过RT-qPCR技术克隆获得了水虻脂肪酸合成关键基因HiACC、HiFAS1、HiFAS2、HiFAS3,4个基因编码的蛋白质均具有保守的催化功能域;均在水虻卵期、4~5龄幼虫期高度表达,高丰度表达于水虻4龄、5龄幼虫的脂肪体和前中肠,在饥饿、高脂胁迫下表达量均显著下调,表明ACC和 FAS与水虻油脂高效积累密切相关。为进一步研究ACC和 FAS在水虻脂质积累过程中的表达调控机制,实现水虻油脂高效积累提供了理论依据。
