化学反应速率和化学平衡部分考查分析及备考建议
——以2018~2022全国卷为例*
2023-11-29赵海雨李艳妮杨艳华李曼弯张曼妲
赵海雨,李艳妮,杨艳华**,李曼弯,张曼妲
(1.昆明学院 化学化工学院,云南 昆明 650214;2.蒙自市第一高级中学,云南 红河 661100)
“化学反应速率和化学平衡”模块是全国高考卷的必考知识点,在近几年的考查中均出现新的考查情境,题目新颖、灵活。该模块通常考查化学反应速率及计算、影响化学反应速率的因素、化学平衡的建立及移动、化学平衡常数计算、化学反应进行的方向等知识相融合的综合考题。试卷题材来源广泛,新颖,常与工业生产相结合,不仅考查学生的理解能力,而且还考查学生有效地从文字、表达式、关系图中提取关键信息进行分析和相关计算的能力。因此,该模块对基础理论知识要求高,备考过程中学生不仅要深入理解基础知识,还需要进一步了解知识点考查方式,方能灵活运用知识点,提高解题的正确率及效率。
“化学反应速率和化学平衡”为人教版(2019版)选择性必修1《化学反应原理》第二单元内容,是高中知识中较复杂的部分,也是较关键部分[1]。该模块理论知识具有微观、抽象、专业化和理论化的特点,在教学中,缺乏直观的教学手段和载体,对学生的抽象思维能力与逻辑能力要求颇高,而高中学生在课业压力和学习内容繁重的条件下,这两方面能力锻炼程度不够,学习该模块较为吃力;部分学生认为该模块脱离生活实际,导致学生对该模块知识在解决生产、生活问题的价值认识不普遍[2]。
在前期研究基础上[3-5],结合自身实际情况,本文统计分析了2018~2022全国卷的化学反应速率和化学平衡考题,总结核心考点,寻找系统的解题思路与方法,提出备考建议,进而帮助学生有效备考,提高复习效率。
1 2018~2022全国卷考点分析
对2018~2022高考全国卷中的“化学反应速率和化学平衡”模块的知识点考查进行统计,从以下三个方面进行分析:
1.1 题型与题量
如表1所示,2018~2022年高考全国卷对“化学反应速率和化学平衡”的考查题量相对稳定,为一个大题,集中于非选择题的必考题部分,题号为27题或28题,整题总分15分左右,而与化学反应速率和化学平衡相关考点占10分左右,分值占比较高。其中,题量约4~7个空,题型为填空题包括填空型填空(个别文字解答)、计算型填空(需进行计算解答)、简答型填空(需大量文字解答)。掌握题型、题量、分值,便于学生把控做题优先顺序和做题速度。
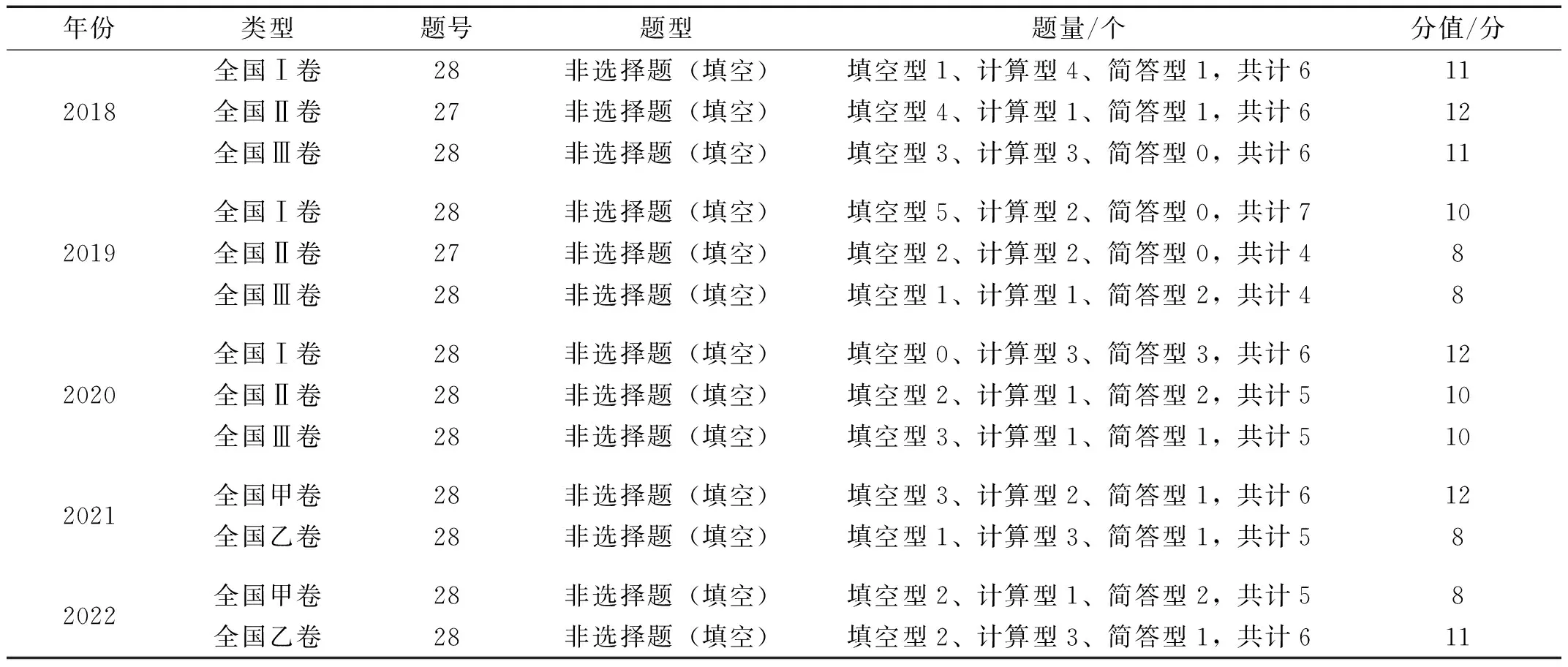
表1 2018~2022全国卷“化学反应速率和化学平衡”题型与分值情况分析
1.2 知识点考查频率与考点分析
如表2所示,对2018~2022年全国高考卷中的“化学反应速率和化学平衡”部分考查各知识点的频率进行统计分析,发现平衡常数的表达式及计算、转化率的影响因素及提高转化率的措施、平衡移动的影响因素及平衡移动的方向、三段式的应用及图像分析考查次频率较高,产率及转化率的计算也会经常出现。
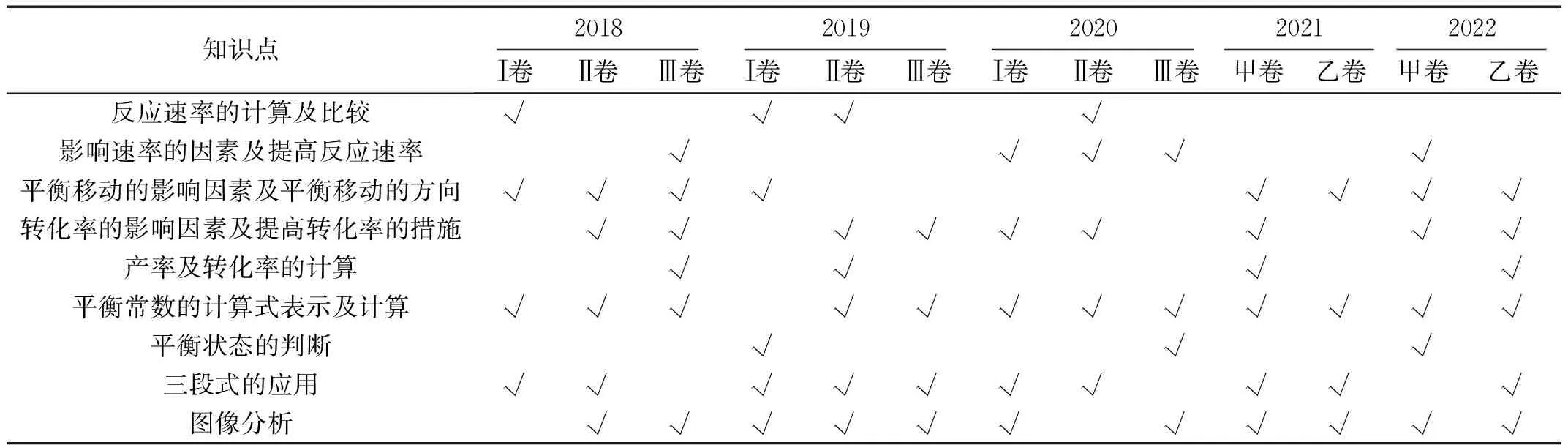
表2 2018~2022全国卷“化学反应速率和化学平衡”知识点考查频率分析
1.3 考查特点与考查情境
如表3所示,对2018~2022年高考全国卷的考查特点进行统计分析,发现:①该模块的考查试题设计新颖,题目难度、试题知识点、综合性、计算量、图像信息量、灵活度均有所增加。②图像有“积碳量-温度/反应时间”、“分压/转化率/浓度-时间”、“转化率-温度”、“甲醇的物质的量分数-压强-温度”和“物质的量分数-温度”等关系图。图像丰富、新颖、信息量大,对学生的识图能力、读图能力、分析理解能力和推断能力要求越来越高。③用三段式计算的次数有所增加,不仅包括浓度列三段式,而且还涉及用各组分的分压、转化率、物质的量、物质的量分数代替浓度列三段式进行计算,题目还会给出一些陌生的表达式,与图像及三段式相结合进行计算。计算题型填空考查越来越灵活多变,不再是套用公式简单计算,对学生的计算能力、分析能力、公式理解能力、知识点剖析能力、灵活运用能力、综合能力要求越来越高。对于医学、工业生产、环境方面的重要物质经常考查提高转化率的措施或是提高化学反应速率的措施,对学生运用知识于生活实践的能力要求越来越高。

表3 2018-2022全国卷“化学反应速率和化学平衡”考查情境和特点统计
如表3所示,对考查情境进行统计分析,发现“化学反应速率和化学平衡”部分的知识考查情境为在医学、工业生产、环境等领域有着重要贡献的化学物质的合成与应用,同时与科技发展前沿密切相关。
2 备考建议
2.1 串联知识点 促进知识结构化
思维导图有利于学生思维的展开,具有激发思维、发散思维和集中思维的优点,可以帮助学生理清各知识点的关系,在知识整理汇总的过程中既能帮助理解又能加深记忆,培养学生的思维习惯,复习时大大减少了枯燥乏味的文字,帮助学生高效快速理解记忆[6]。当学生接触该模块时,面对繁冗的概念、原理及方法,头脑容易混乱,无法建立完整的知识网,导致学生遇到难题时,不知如何着手。因此,教师可以利用思维导图,引导学生将该模块知识点的概念、原理及方法融为一体,串联起来,进行科学组合,构建清晰完整的知识网,使繁杂的知识简单化,结构化,进而帮助学生高效利用知识点,快速掌握该模块,考试时减少知识点错乱的现象出现。如图1所示简单化学反应速率思维导图,仅以简单的框架结构将知识点高度概括,便于学生复习,还可以融合学生错题集整理相关知识内容,拓宽思维导图内容。

图1 化学反应速率思维导图
2.2 学会提取有效信息及微观探究 培养学习方法与策略
“化学反应速率和化学平衡”模块的考查题中,解题所需的信息通常与大量文字、图像以及一些从未见过的表达式相结合给出信息[6],需要学生仔细审题,快速理解题目意图,便于解答试卷。题目综合性较强,学生在备考时应该学会提取有效信息,把陌生的文字信息、表达式信息、图像信息与知识经验相联系,做到触类旁通,有效增加题目熟悉感,增强自信心,提高做题效率[6]。同时,在学习化学知识的过程中,学生不能只停留在宏观上,教师应该引导学生通过微观探究了解化学反应的实质,要培养学生透过现象看本质的能力,让学生从微观角度分析各外界因素变化对化学平衡影响的实质。在“化学反应速率和化学平衡”模块的复习中,不仅要求教师在教学过程中要有意识地培养学生分析问题、解决问题的能力,帮助学生发展思维方式,寻找解决问题的方法,有效提高学习效率,而且要求教师引导学生透过现象,发现问题的本质,从根本上解决问题,帮助学生更直观的分析其影响,使学生分析知识本质后,对知识点的理解更为透彻,对知识点的印象更为深刻[6]。学生应该掌握的常见解题策略如下:
1)“三段式法”[7]:首先,根据题目写出对应的化学反应方程式;然后,按照起始、变化、平衡三段写出各物质对应的物理量(不一定是浓度或者物质的量,需根据题目找到最利于计算的物理量);最后,根据所求的物理量,选择合适的计算公式进行计算。

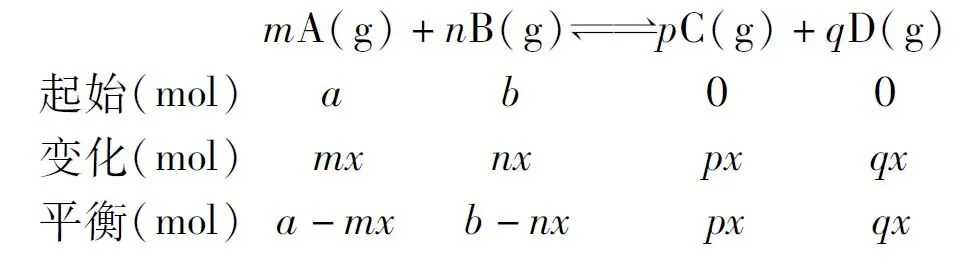

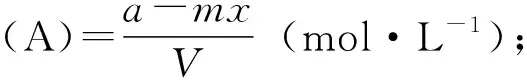

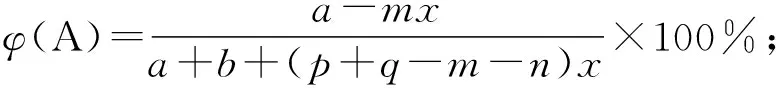


本题考查灵活运用三段式解决计算型填空题,①至⑥为三段式推导出的常用公式。
2) “比值法”[7]:比较化学反应速率大小时(不同物质之间),转化为比较化学反应速率与对应的化学计量数的比值。
A、ν(A)=0.5 mol·L-1·s-1
B、ν(B)=0.8 mol·L-1·s-1
C、ν(C)=0.9 mol·L-1·s-1
D、ν(C)=1.2 mol·L-1·s-1
首先,分析题目是较可逆反应中化学反应速率大小的对比,采用“比值法”进行比较,v(A)/a=0.5/1=0.5、v(B)/b=0.8/2=0.4、v(C)/c=0.9/3=0.3、v(D)/d=1.2/4=0.3,由此本题化学反应速率最快的是A。
3) “图像分析法”:① 看关系图中横坐标和纵坐标分别代表的物理量;② 看关系图中曲线的变化趋势;③ 分析关系图中有特殊意义的点,常见拐点、断点,例如拐点,分析关系图中的拐点,先出现拐点说明这条曲线先达到平衡,则该条线表示的数值比另一条线表示的数值大,记忆口诀“先拐先平数值大”;④ 分析辅助线。
【例3】(2022年全国甲卷,第28题第②题)在1.0×105Pa将TiO2、C、Cl2以物质的量比1∶2.2∶2进行反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图2所示。
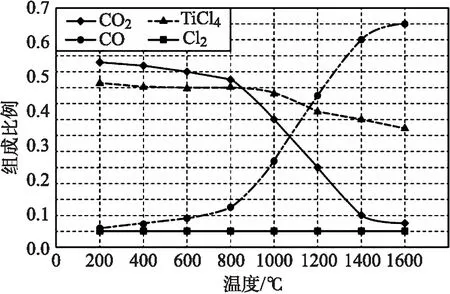
图2 平衡组成随温度变化理论计算结果示意图

首先分析图像中横、纵坐标对应的物理量,得到1400 ℃时,体系中气体平衡组成比例CO2和CO分别是0.05和0.6,然后根据反应式推理平衡常数的计算公式Kp(1400 ℃)=(0.6P总)2/0.05P总=(0.6×1.0×105Pa)2/(0.05×1.0×105Pa)=7.2×105Pa。
本题考查了图像分析、平衡常数的计算、相关公式的推理,灵活运用各种解题策略。
2.3 熟记规律 轻松解题
1)根据图像比较反应速率大小:分析图像,化学反应达到平衡所需的时间越短,对应的浓度、压强、或温度就越大,则对应的反应速率越大[8]。
2)气体反应体系中充入“惰性气体”(不参加化学反应的气体)时,对反应速率的影响如图3所示:
3)当某一因素变化时,平衡总是朝着抵消这种变化的方向移动。常见考点,温度和压力的变化对反应速率的影响结果,如表4所示。
4)“正逆相等,变量不变”判断平衡状态:①“正逆相等”是指同一种物质的正反应的速率与逆反应的速率相等;②“变量不变”是指一个物理量随着化学反应进行而改变,当该物理量不变时,化学反应达到平衡状态;如果一个物理量随反应的进行保持不变,则该物理量不能作为判断化学是否平衡的依据。化学平衡移动判断的一般思路,如图4所示[9]。

图4 判断化学平衡移动的一般思路图
5)最优化工生产条件的原则:① 化学反应速率,既不能过快,也不能过慢;② 注意外界条件对化学反应速率和化学平衡移动的影响;③ 在保证质量安全的大前提下,多采用价格低廉的可替代原料,提高昂贵原料的利用率;④ 改善工艺条件时,综合考虑设备的承受能力;⑤ 考虑温度对催化剂活性的影响,便于实现较好的催化效果。
6)用瞬时速率突破难点。近年高考题中常常会给出瞬时速率相关公式进行考查“化学反应速率和化学平衡”,利用瞬时速率进行解题实则是打破常规的解题思路,从不同角度解题,拓展学生的思维。首先,充分理解瞬时速率的概念以及瞬时速率与各个公式中的相关物理量之间的关系;其次,利用瞬时速率相关公式理解各外界因素对反应速率的影响;再次,利用瞬时速率理解影响平衡移动的因素及平衡移动原理;最后,利用瞬时速率理解并计算化学平衡常数[10]。
2.4 理论联系实际,提高学习兴趣
“化学反应速率和化学平衡”这部分知识虽然理论性很强,但不仅仅是理论,而且可以为生活服务。在该模块的复习中教师可以引导学生积极思考理论知识与实际生活之间可能存在的联系,循序渐进中引导学生挖掘知识更深层次的社会价值。在与化学工程相关的题目中,学会分析反应的特点,思考各因素的相互影响、讨论如何趋利避害、考虑可实施性,得到最优化的生产条件以提高产物转化率从而获得更高的收益。通过教师一系列的引导让学生感受到该模块知识的奥妙与魅力所在,让学生通过自己对知识的运用从而收获成就感,达到激发学生的学习兴趣的目的。
例如合成氨,利用“化学反应速率和化学平衡”的知识选择合成氨的条件,① 增大压强,化学反应速率增大,平衡正向移动,则氨的含量提高;② 升高温度,化学反应速率增大,但平衡逆向移动,则氨的含量降低;③ 使用催化剂,化学反应速率增大。综合上述考虑,选择10~30 MPa 的高压、400~500 ℃ 的温度、铁触媒作催化剂能够最大限度合成氨[11],从而解决固定氮源,从本质上增产粮食,解决饥荒问题,养育众多人口。诺贝尔奖曾三次授予合成氨相关研究领域的科学家,足以证明合成氨研究对人类生活的重要意义,所以要帮助学生掌握该模块知识,增强学生知识来源于生活,知识又服务于生活的认知。
2.5 关注科技前沿信息,创设真实情境
经过表2中考查情境的统计,“化学反应速率与化学平衡”的试题情境主要是在医学、工业生产、环境等领域有着重要贡献的化学物质的合成与应用,同时与科技发展前沿密切相关,所以教师应该紧跟科技、社会发展潮流,把握最新的科技前沿信息,并选择有意义的情境融入化学复习中,更新学生的认知、开拓学生视野;学生也应该多与老师交流,并在日常生活中多关注环境、生命、信息和能源科学、材料化学等现代科学技术[12]。例如,据2019中国航空报讯:20世纪50年代以来,随着航空航天工业的快速发展,钛合金材料及其运用得到极大发展,因比重轻、耐热、耐寒、韧性好钛合金主要作为火箭、导弹及宇宙飞船等的结构、容器制造材料。钛化学活性高,在熔炼温度下易与许多元素发生反应,故钛的提取相当困难[13]。基于这样的背景,2022年全国甲卷考查了以钛为核心的化学知识。
【例4】(2022年全国甲卷)金属钛(Ti)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将红金石(TiO2)转化为TiCl4,再进一步还原得到钛。(具体考查知识信息略)
3 总结
综上所述,“化学反应速率和化学平衡”模块内容具有复杂性、综合性和理论性的特点。2018~2022年全国高考卷对“化学反应速率和化学平衡”的考查主要内容为平衡常数的表达式及计算、转化率的影响因素及提高转化率的措施、平衡移动的影响因素及平衡移动的方向、三段式的应用及图像分析等,重在考查对基础知识点的掌握、计算能力、分析图像能力等。根据统计分析给出备考建议,帮助学生复习该模块知识点,真正掌握该模块。
