乙醛脱氢酶2基因多态性与急性脑梗死的相关性研究
2023-11-29司英丽张冬青
司英丽,张冬青
中国人民解放军总医院第四医学中心检验科,北京 100048
脑卒中是脑血管疾病中的常见病和高发病,全球疾病负担数据分析表明,脑卒中的发病率和病死率均呈上升趋势[1]。随着我国老龄化加剧,脑卒中的发病率也快速上升,其中急性脑梗死(ACI)占比较大[2],严重影响患者的生存质量。ACI是指由各种原因导致的脑血管狭窄,甚至闭塞,而引起脑组织缺血、缺氧性改变,进而造成局部区域脑组织功能缺损的症状和体征[3]。ACI具有较高的致残率及致死率,且多发于中老年人,严重危害其生命健康[4],给社会和家庭带来沉重的负担[5-6]。乙醛脱氢酶2(ALDH2)参与乙醇的代谢,能够促进毒性中间产物乙醛和4-羟基壬烯醛(4-HNE)的转化,具有明确的解毒作用,ALDH2可能通过清除毒性代谢醛类等发挥神经保护作用[7]。有研究表明,ALDH2编码基因多态性及氧化应激产物4-HNE水平升高是脑卒中的易感因素[8],并认为4-HNE可能是缺血性脑卒中的潜在生物标志物之一[9]。本研究对不同临床分组的ACI患者和健康人群的ALDH2基因多态性进行分析,观察ALDH2基因多态性在ACI患者中的分布情况,以期为临床提供参考依据,现报道如下。
1 资料与方法
1.1一般资料 选取2019年8月至2021年8月在本院神经内科就诊的130例ACI患者作为ACI组,其中男96例,女34例;年龄48~82岁,平均(66.3±11.9)岁。纳入标准:(1)均符合中华神经科学学会制定的ACI诊断标准[10];(2)均为初次发病;(3)均经CT或MRI检查,有颈动脉系统和(或)椎-基底动脉系统的症状和体征。排除标准:(1)脑实质出血、出血性脑梗死、高血压脑病、短暂性脑缺血发作者;(2)近3个月内使用过抗癫痫药物、多巴胺类药物者;(3)存在血液系统疾病、恶性肿瘤、严重肝肾功能不全及心力衰竭、感染者。根据头颅CT或MRI检查结果所示病灶大小将ACI组进一步分为腔隙性脑梗死组(33例,病灶最大径小于1.5 cm)、小梗死组(41例,病灶最大径1.5~3.0 cm,≥1个脑解剖部位)和大梗死组(56例,病灶最大径大于3.0 cm,≥2个脑解剖部位)。另选择同期体检中心130例体检健康者作为对照组,其中男93例,女37例,年龄49~80岁,平均(64.3±7.3)岁。两组性别、年龄等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。所有研究对象及其家属均知情同意本研究并签署知情同意书。本研究经本院医学伦理委员会审核批准。
1.2仪器与试剂 使用主要仪器包括LightCycler®480Ⅱ型实时荧光定量聚合酶链反应(PCR)检测仪(瑞士Roche公司)、全自动生化分析仪Roche cobas c701(瑞士Roche公司),使用主要试剂盒包括血液基因组提取试剂盒(北京天根生化科技有限公司)、ALDH2基因多态性检测试剂盒(苏州旷远生物分子技术有限公司)、4-HNE检测试剂盒(上海邦奕生物科技有限公司)。所有步骤均严格按照试剂盒说明书进行操作。
1.3方法
1.3.1标本采集 采集所有研究对象空腹静脉血7 mL,其中2 mL使用乙二胺四乙酸二钾(EDTA-K2)抗凝,-20 ℃保存用于提取DNA;另外5 mL于2 h内以3 500 r/min离心5 min,分离上层血清,-80 ℃冰箱保存用于检测血清4-HNE水平。
1.3.2DNA提取 按照血液基因组提取试剂盒说明书提取DNA,使用美国Nano Drop 2000分光光度计进行核酸标本质量的评估和浓度的检测,选取吸光度(A260/A280nm)比值在1.7~1.9区间的标本用于ALDH2基因多态性的检测。
1.3.3基因多态性分析 采用PCR-荧光探针法进行基因多态性分析,按照ALDH2基因多态性检测试剂盒说明书操作,对研究对象的ALDH2基因位点进行检测,同时做空白对照和弱阳性对照。PCR反应总体系为25 μL,反应条件:预变性95 ℃、3 min,变性95 ℃、20 s,退火58 ℃、30 s,延伸65 ℃、45 s;10个循环:变性95 ℃、20 s,退火58 ℃、30 s;双通道采集荧光信号;65 ℃、45 s,30个循环。

2 结 果
2.1PCR-荧光探针法检测基因型结果 ALDH2基因位点突变产生3种基因型:纯合野生型GG、纯合突变型AA和杂合突变型GA。检测纯合野生型标本时,FAM检测通道(野生型)结果为阳性,VIC检测通道(突变型)结果为阴性;检测纯合突变型标本时,FAM检测通道结果为阴性,VIC检测通道结果为阳性;检测杂合突变型标本时,FAM和VIC检测通道结果均为阳性。
2.2ACI组与对照组ALDH2基因的多态性比较 ACI组ALDH2突变基因型AA比例高于对照组,差异有统计学意义(χ2=4.599,P<0.05)。ACI组A等位基因频率(29.6%,77/260)高于对照组的21.5%(56/260),差异有统计学意义(χ2=4.455,P=0.035)。见表1。
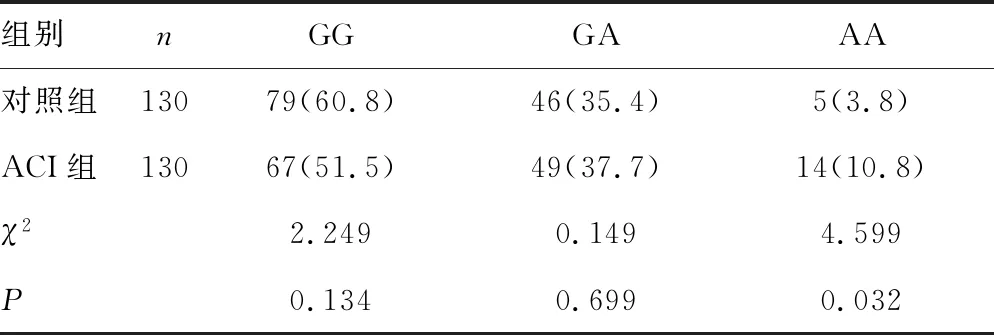
表1 ACI组与对照组ALDH2基因的多态性比较[n(%)]
2.3不同病灶大小组ALDH2基因的多态性比较 大梗死组ALDH2突变基因型AA比例高于腔隙性脑梗死组,差异有统计学意义(P<0.05)。大梗死组A等位基因频率(35.7%,40/112)高于腔隙性脑梗死组的21.2%(14/66),差异有统计学意义(χ2=4.133,P<0.05)。见表2。

表2 不同病灶大小组ALDH2基因的多态性比较[n(%)]
2.4各组4-HNE水平比较 ACI组4-HNE水平为(17.79±7.62)ng/mL,高于对照组的(11.83±7.52)ng/mL,差异有统计学意义(t=6.348,P<0.05);腔隙性脑梗死组4-HNE水平为(16.29±8.71)ng/mL,低于小梗死组的(18.30±5.27)ng/mL和大梗死组的(18.31±8.36)ng/mL,差异均有统计学意义(t=-1.225、-1.187,P<0.05)。
2.5不同基因型ACI患者的4-HNE水平比较 ACI组中ALDH2基因纯合突变基因型AA患者血清4-HNE水平为(32.65±6.44)ng/mL,高于纯合野生型GG患者的(13.24±3.25)ng/mL和杂合基因型GA患者的(19.89±2.39)ng/mL,差异有统计学意义(t=11.228、6.670,P<0.05)。
3 讨 论
ACI是指脑组织的血液供应突然中断而造成的脑组织坏死,主要特征是起病急、病情重,表现为头痛、耳鸣、呕吐等症状,对人们的健康与社会的发展均造成了严重威胁。脑梗死的发病不仅与年龄、性别、饮食习惯、生活环境等因素有关,而且与遗传因素、体内脂质过氧化产物的堆积也有关。
近年来,氧化应激学说已成为缺血性脑卒中研究的热点,脂质过氧化物反应中产生的主要物质是醛基类产物,可与细胞内许多大分子相互作用产生多种化合物,导致DNA损伤和蛋白质失活而对组织造成损伤[11],4-HNE多来源于不饱和脂肪酸,在氧化应激反应过程中由脂质过氧化产生,4-HNE大量在体内蓄积,毒性很大,会引发各类疾病[12-13]。参与4-HNE代谢的酶系统主要有乙醛脱氢酶、醛糖还原酶和谷胱甘肽-S-转移酶,其中乙醛脱氢酶的主要作用是将醛类物质催化为酸类物质,即把有害的物质转变为无害的物质。乙醛脱氢酶包括许多种同工酶,ALDH2是代谢活性最强的同工酶,主要分布在人的大脑、肺、肝脏、心脏等组织,人ALDH2编码基因位于第12号染色体,第1 510位碱基鸟嘌呤(G)被碱基腺嘌呤(A)替换,致使编码的谷氨酸变为赖氨酸[14],基因突变最终导致ALDH2结构发生改变,突变ALDH2与辅酶NAD(P)+的结合受损,其中杂合突变型ALDH2的酶活性下降,仅为正常活性的30%~40%,纯合突变型ALDH2的酶活性几乎丧失[15],因此,会导致4-HNE等醛基类产物的积累。ALDH2基因也被认为是缺血性脑卒中及高血压、糖尿病、大动脉粥样硬化的易感基因之一[16-18]。
本研究结果表明,ACI组A等位基因频率(29.6%,77/260)高于对照组的21.5%(56/260),差异有统计学意义(χ2=4.455,P=0.035)。本研究同时对各组血清4-HNE水平进行分析,大梗死组ALDH2突变基因型AA比例高于腔隙性脑梗死组,差异有统计学意义(P<0.05)。大梗死组A等位基因频率(35.7%,40/112)高于腔隙性脑梗死组的21.2%(14/66),差异有统计学意义(χ2=4.133,P<0.05)。ACI组ALDH2基因纯合突变基因型AA患者血清4-HNE水平为(32.65±6.44)ng/mL,高于纯合野生型GG患者的(13.24±3.25)ng/mL和杂合基因型GA患者的(19.89±2.39)ng/mL,差异有统计学意义(t=11.228、6.670,P<0.05)。说明携带ALDH2纯合突变基因与4-HNE水平升高显著相关,ALDH2纯合突变基因是缺血性脑卒中的易感基因之一[19]。
综上所述,ALDH2 G>A与ACI的发生密切相关,且纯合突变基因型AA与ACI的发生密切相关,因此,氧化应激产物4-HNE水平升高及其代谢酶乙醛脱氢酶编码基因ALDH2位点多态性(即携带纯合突变等位基因)是ACI的易感因素,然而本研究可能受环境因素和遗传因素影响,且样本量相对偏少,因此,仍需进一步扩大样本量进行深入研究。
