脾氨肽口服溶液对大鼠变应性鼻炎复发的疗效及作用机制研究
2023-11-29粆香王铁山秦瑜李贺任嘉慧石颖慧宗玉涵高鹏翼王浩谢心悦刘含之王安琪潘彦舒
粆香 王铁山 秦瑜 李贺 任嘉慧 石颖慧 宗玉涵 高鹏翼 王浩 谢心悦 刘含之 王安琪 潘彦舒
变应性鼻炎又称过敏性鼻炎(allergic rhinitis,AR),是一种人体接触变应原后由特异性免疫球蛋白E(Immunoglobulin E,IgE)介导的辅助型T细胞2(T helper 2 cell,Th2)类型鼻黏膜慢性非感染性炎症反应[1-4]。AR在中医学属“鼻鼽”范畴,在古代文献中还有“鼽嚏”“鼽鼻”“鼽水”“鼻流清涕”等述描与本病症状类似。本病最早以“鼽嚏”一词记载于《礼记·月令》∶“季秋行夏令,则其国大水,冬藏殃败,民多孰嚏。”[5-6]
AR患者主要表现为鼻痒、鼻塞、流清涕、打喷嚏,可伴眼痒、流泪、眼部红肿等,症状具有季节性、反复性的特点[4]。流行病学调查发现,AR已成为全球性健康问题,20%~30%的成年人和高达40%的儿童受其影响[2-4]。现有研究表明,AR发病涉及多种炎症细胞、细胞因子及信号传导通路,以Th1作用减弱Th2应答增强最为经典[7-9]。《中国变应性鼻炎诊断和治疗指南(2022年修订版)》[10-11]指出,目前治疗AR的常用药物包括糖皮质激素、抗组胺药、抗白三烯药、肥大细胞膜稳定剂、减充血剂、抗胆碱药、中药、鼻腔盐水冲洗药、抗IgE治疗等,其中一线用药为口服抗组胺药与鼻喷糖皮质激素[12-14]。以上治疗虽然可以有效缓解过敏症状,但不能预防AR复发,患者反复发病影响生活质量。现代医学研究多侧重于AR治疗,鲜有对AR复发相关研究的报道。AR作为一种季节性、反复性疾病,对其复发机制及治疗的探索也不容忽视[14-15]。
动物类中药活性成分安全性高、疗效确切,在AR治疗中显示出独特的研发潜力和优势。脾氨肽口服溶液是以动物类中药牛脾为原料制成的含多肽氨基酸和多核苷酸的混合溶液,临床治疗AR疗效确切,但作用机制有待进一步探究。同时,脾氨肽口服溶液具有双向免疫调节功能,调节免疫失衡作用突出,因而其防治AR复发的疗效和作用机制也极具探索价值[16-17]。
本研究创新性地建立AR复发大鼠模型,并探究脾氨肽口服溶液防治AR复发的疗效和免疫机制,以期揭示动物类中药牛脾提取物防治AR复发的现代生物学机制。
1 材料与方法
1.1 实验动物及实验环境
SPF级雌性SD大鼠32只,8周龄,体质量(200±20)g,购自斯贝福(北京)生物技术有限公司,实验动物使用许可证号SCXK(京)2019-0010,均在北京中医药大学动物实验中心进行饲养。大鼠适应性饲养7天后开始进行实验,饲养环境:温度(23±2)℃、相对湿度50%±10%,大鼠自由进食饮水[2]。
1.2 伦理审查
本研究中动物实验过程均按照北京中医药大学伦理委员会的规定操作,已通过北京中医药大学动物伦理委员会审批,批准号:BUCM-4-20211022020-4025。
1.3 主要药物与试剂
脾氨肽口服溶液(规格10 mL:10 mg,批号:210115,购自北京第一生物化学药业有限公司);氯雷他定片(10 mg,批号:20023030,购自扬子江药业集团上海海尼药业有限公司)。
卵清蛋白(ovalbumin from egg white,OVA)(10 g,批号:SLCH2414,北京百诺威生物科技有限公司);氢氧化铝凝胶(Imject Alum Adjuvant)(50 mL,批号:VI311256,北京百诺威生物科技有限公司);gibco1640培养基(500 mL,批号:8121249);4%多聚甲醛(500 mL,批号:4500111011,北京兰博利德商贸有限公司);EDTA脱钙液(500 mL,批号:567250222,北京百诺威生物科技有限公司);细胞冻存液(100 mL,批号:2145345,北京百诺威生物科技有限公司);PBS缓冲液(Phosphate Buffered Saline,PBS)(500 mL,批号:AC13074266,北京兰博利德商贸有限公司),LEGENDplexTM大鼠Th细胞因子面板检测抗体试剂盒(批号:B314751,BIOLEGEND(北京)生物科技有限公司);大鼠IgG、OVA特异性IgG、OVA特异性IgE ELISA检测试剂盒(批号分别为220105、221103K4、R1216H029,均购自BIOLEGEND(北京)生物科技有限公司);大鼠IgE ELISA检测试剂盒(批号:R220311-117a,欣博盛生物科技有限公司);CD8抗体(100 μg,批号:B334055),干扰素γ(interferon gamma,IFN-γ)抗体,CD3抗体(100 μg,批号:B279666),CD25抗体(100 μg,批号:B302343),白细胞介素(interleukin,IL)-4抗体(100 μg,批号:B332499),CD4抗体(100 μg,批号:B344817),ZUBNIER抗体(100 μg,批号:B335395),FOXP3抗体(100 μg,批号:2410199),以上均购自BIOLEGEND(北京)生物科技有限公司。
1.4 主要仪器
流式细胞分析仪(型号:LSRFortessa SORP,美国BD公司);多功能酶标仪(型号:I3x,美国Thermo Fisher Scientific公司);台式自动化成像仪(型号:EVOS FL Auto 2,美国Thermo Fisher Scientific公司);恒温水浴锅(型号:SY-1-2,天津欧诺仪器股份有限公司);离心机(型号:Velocity 14, 生命动力亚洲有限公司);组合式全温震荡摇床(型号:ZQTF-8F8,上海知楚仪器有限公司);荧光细胞分析仪(型号:Rigel S2, 北京科誉兴业科技发展有限公司)。
1.5 实验方法
1.5.1 动物分组 适应性喂养7天后,将32只健康SPF级SD雌性大鼠按随机数字表分为空白组、模型组、脾氨肽组、氯雷他定组4组,每组8只。
1.5.2 动物实验周期划分 实验第0~7天:预防给药期;第8~21天:全身基础致敏期;第22~28天:局部激发强化致敏期;第29~35天:巩固给药期;第36~42天:恢复期;第43~49天:二次激发期。
1.5.2 造模方法 本研究造模方法分两阶段完成。
全身基础致敏(14天):以3 mg卵清蛋白为抗原,30 mg氢氧化铝凝胶为佐剂,抽取1 mL生理盐水配制成浓度为0.3%的OVA悬液后予腹腔注射,隔日1次,共7次;空白组用相同剂量的生理盐水代替[6]。
局部激发强化致敏(7天):(1)滴鼻。腹腔注射免疫阶段结束后,双侧鼻腔都以浓度为5%的卵清蛋白-生理盐水溶液(0.5 g OVA加10 mL生理盐水制成混悬液)50 μL滴鼻局部激发强化致敏刺激,每日1次,共7次。空白组用等量生理盐水代替[6,12],方法同上;(2)雾化。腹腔注射阶段结束后,每间隔3日使用浓度为5%的卵清蛋白-生理盐水溶液进行一次雾化。将各组大鼠分别放置于透明容器中,在保障大鼠不会缺氧的条件下连接超声雾化器,调至1 mL/min,每组雾化4分钟,雾化激发10分钟后观察大鼠鼻部行为学表现10分钟,对每只大鼠进行鼻部症状行为学评分,判断否造模是否成功。空白组在相同条件下用生理盐水替代进行相应实验[6]。
1.5.3 给药方法 本实验中SD雌性大鼠脾氨肽口服溶液、氯雷他定片药物干预剂量按成人脾氨肽每日口服剂量60 mg,氯雷他定每日口服剂量10 mg,经动物标准公式(假设人的剂量为X mg/kg,大鼠的剂量=6.3X mg/kg)计算而得(大鼠每周称重1次)。脾氨肽口服溶液每日给药剂量为7.56 mg/kg,氯雷他定片每日给药剂量为1.26 mg/kg。
空白组:等量超纯水腹腔注射,等量生理盐水滴鼻、雾化。
模型组:适应性喂养1周后采用OVA全身基础致敏及鼻黏膜局部激发强化刺激致敏的方法建立AR复发大鼠模型,造模成功后进入巩固给药期,本组不做任何其它处理,恢复期为期1周,之后进行为期1周的二次激发实验,每隔3日做1次行为学测试并评分,本阶段第3次行为学评价完成后取材进行后续检测[6]。
脾氨肽组:适应性喂养1周后采用OVA全身基础致敏及鼻黏膜局部激发强化刺激致敏的方法建立AR复发大鼠模型,造模成功后进入巩固给药期,本组用脾氨肽口服溶液干预(7.56 mg/kg),给药周期为适应性喂养期至恢复期,恢复期为期1周,之后进行为期1周的二次激发实验,每隔3日做1次行为学测试并评分,本阶段第3次行为学评价完成后取材进行后续检测。
氯雷他定组:适应性喂养1周后采用OVA全身基础致敏及鼻黏膜局部激发强化刺激致敏的方法建立AR复发大鼠模型,造模成功后进入巩固给药期,本组用氯雷他定干预(1.26 mg/kg),给药周期为适应性喂养阶段至恢复期结束,恢复期为期1周,之后进行为期1周的二次激发实验,二次激发期间不给药,每隔3日做1次行为学测试并评分,本阶段第3次行为学评价完成后取材进行后续检测。
1.6 指标检测
1.6.1 鼻部症状行为学评分 局部激发强化阶段每隔3日对空白组、模型组、脾氨肽组、氯雷他定组大鼠进行一次以鼻部症状(即嚏喷、流清涕、鼻痒等表现)为主的行为学观察和记录,并对鼻部诸症进行叠加量化记分,观察治疗前后各组大鼠鼻部症状改善情况。观察记录时间为激发或给药干预后30分钟内[7,18-22]。评价量表见表1。

表1 大鼠鼻部症状行为学评价量表
1.6.2 外周血嗜酸性粒细胞、嗜碱性粒细胞计数 实验取材阶段,各组大鼠腹主动脉取血后行血常规检测,检测指标包括:白细胞计数、红细胞计数、血红蛋白含量、白细胞五分类(嗜酸性粒细胞、嗜碱性粒细胞、中性粒细胞、淋巴细胞、单核细胞)计数和比例共8项。
1.6.3 苏木精—伊红(hematoxylin-eosin,HE)染色观察鼻甲组织病理形态 实验取材时,每组随机选择6只大鼠,取部分鼻甲组织,生理盐水冲洗后,固定于4%多聚甲醛溶液中,脱钙处理,常规石蜡包埋,切片并HE染色,观察鼻甲组织病理形态[23-25]。根据病变的分布、严重程度和形态学特点使用合适的诊断术语并将病变分为4个等级:轻微、轻度、中度、重度,分别用1、2、3、4表示,-表示正常。本次拍照均为200倍视野。
1.6.4 Elisa检测IgE、IgG、OVA特异性IgE、OVA特异性IgG表达情况 实验取材时,收集各组大鼠血清样本,每组随机选择5只大鼠样本,按照相应Elisa检测试剂盒说明书操作,用酶标仪在450 nm波长分别检测各样本IgE、IgG、OVA特异性IgE、OVA特异性IgG的OD值。
1.6.5 流式细胞检测Th1、Th2、Th17、Treg细胞比例 验取材时,收集各组大鼠血清样本,每组随机选择5只大鼠样本,提外周血单个核细胞(Peripheral blood mononuclear cell,PBMC),用抗体CD3、CD4、CD8、CD25、ZUBNIER胞外染色,抗体FOXP3、IL-17A、IL-4、IFN-γ胞内染色,使用流式细胞分析仪检测Th1细胞、Th2细胞、Th17细胞、Treg细胞的比例,并分析其功能变化。
1.6.6 检测炎症因子IFN-γ、IL-5、IL-2、TNF-α、巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GMCSF)、IL-4、IL-17F、IL-17A、IL-13、IL-22、IL-6表达情况 实验取材时,收集各组大鼠血清样本,每组随机选择5只大鼠样本,采用LEGENDplexTM细胞因子面板及IFN-γ、IL-5、IL-2、TNF-α、GMCSF、IL-4、IL-17F、IL-17A、IL-13、IL-22、IL-6对应的捕获珠子,使用流式细胞分析仪同时定量检测多种细胞因子[26-30]。
1.7 统计学方法

2 结果
2.1 脾氨肽口服溶液对AR复发大鼠鼻部症状行为学评分的影响
各组大鼠分别于局部激发强化期、巩固给药期和二次激发期隔日进行一次鼻部症状行为学评分,即实验第22、25、29、31、34、38、43、47、49天,依据《鼻部症状行为学评价量表》进行鼻部症状行为学评分。记录各组大鼠鼻部症状行为学评价得分,并计算出每组大鼠每次鼻部症状行为学评价得分的平均值,得到各组大鼠鼻部症状行为学评分得分情况及其变化趋势。见表2,图1。

图1 各组AR模型大鼠鼻部症状行为学评分变化折线图
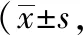
表2 各组AR模型大鼠鼻部症状行为学评分表鼠只=8,分)
鼻部症状行为学评分显示,与空白组相比,模型组评分持续处于最高水平,二次激发期略降低。与模型组相比,脾氨肽组首次局部激发强化期鼻部症状行为学评分较高,恢复期明显下降,二次激发期期略有回升,但总体低于模型组,氯雷他定组与之相反。实验第43天时,脾氨肽组和氯雷他定组鼻部症状行为学评分基本一致。表明脾氨肽口服溶液具有降低AR复发的作用。后续实验中未继续给药,故行为学评分呈现上升趋势。
2.2 外周血嗜酸性粒细胞和嗜碱性粒细胞水平
各组大鼠于实验第49天,腹主动脉取外周血计数嗜酸性粒细胞,得到各组大鼠嗜酸性粒细胞变化情况。模型组大鼠嗜酸性粒细胞均值处于最高水平,且与空白组存在统计学差异(P<0.01)。氯雷他定组与模型组存在统计学差异(P<0.05)。见表3。
各组大鼠于实验第49天,腹主动脉取外周血计数嗜碱性粒细胞,得到各组大鼠嗜碱性粒细胞变化情况。模型组大鼠嗜碱性粒细胞均值处于最高水平,且与空白组存在显著差异(P<0.001)。脾氨肽组和氯雷他定组嗜碱性粒细胞水平均显著低于模型组(P<0.05),表明脾氨肽口服溶能显著降低外周血嗜碱性粒细胞水平。见表3。
2.3 脾氨肽口服溶液对AR复发大鼠鼻甲组织病理形态的影响
空白组大鼠鼻腔结构完整,鼻中隔软骨结构完整,左右鼻腔内鼻甲结构完整,尚未见颌鼻甲结构,可能与取材部位有关,不影响诊断结构;鼻黏膜结构完整,清晰可见黏膜层纤毛、支持细胞、嗅细胞、基底细胞以及杯状细胞,结构未见明显异常。
模型组大鼠鼻腔结构完整,鼻中隔软骨结构完整, 左右鼻腔内鼻甲结构完整未见明显异常; 病变集中于鼻黏膜部位,可见部分大鼠鼻黏膜淋巴细胞浸润, 程度均为轻微, 组间发病率为2/5;可见个别大鼠steno腺轻度空泡变性;可见个别大鼠黏膜内杯状细胞轻度增生。
脾氨肽组大鼠鼻腔结构完整,鼻中隔软骨结构完整,左右鼻腔内鼻甲结构完整未见明显异常;鼻黏膜部位病变程度较轻,可见个别大鼠轻微淋巴细胞浸润。与模型组相比,脾氨肽组大鼠鼻腔病变改善明显,表现为杯状细胞增生被明显抑制。
氯雷他定组大鼠鼻腔结构完整,鼻中隔软骨结构完整,左右鼻腔内鼻甲结构完整未见明显异常;鼻黏膜部位病变程度较轻,可见个别大鼠杯状细胞轻度增生;可见个别大鼠轻度淋巴细胞浸润。与模型组相比,氯雷他定组大鼠鼻腔未见明显差异。见图2。

图2 各组AR模型大鼠鼻组织病理形态(HE染色)
2.4 脾氨肽口服溶液对AR复发大鼠总IgE、总IgG、OVA特异性IgE、OVA特异性IgG OD值的影响
各组大鼠于实验第49天,腹主动脉取外周血,分离得到血清,用Elisa试剂盒检测各组大鼠IgG、IgE、OVA特异性IgG和OVA特异性IgE水平,得到各项检测指标OD值,并比较IgG/IgE、OVA特异性IgG/OVA特异性比值差异。见表4。
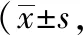
表4 各组AR模型大鼠血清免疫蛋白表达情况鼠只=5)
Elisa检测结果显示,与空白组相比,模型组大鼠IgG OD值、IgG/IgE均降低,IgE OD值升高,且差异存在统计学意义(P<0.05)。与模型组相比,脾氨肽组和氯雷他定组IgG OD值、IgG/IgE均升高,表明AR发生会导致IgE升高,脾氨肽口服溶液和氯雷他定片均可提升AR复发大鼠IgG水平,激活免疫系统,调节机体炎症状态。与空白组相比,模型组大鼠OVA特异性IgG OD值、OVA特异性IgG/OVA特异性IgE均降低,OVA特异性IgE OD值升高,脾氨肽组和氯雷他定组OVA特异性IgG OD值、OVA特异性IgG/OVA特异性IgE均高于模型组,且脾氨肽组OVA特异性IgG/OVA特异性IgE显著高于模型组(P<0.01),提示脾氨肽口服溶液也能通过调节OVA特异性IgG和OVA特异性IgE水平减轻机体炎症反应,防治AR。
2.5 脾氨肽口服溶液对AR复发大鼠Th1、Th2、Treg、Th17的影响
各组大鼠于实验第49天,腹主动脉取外周血,分离得到血清,规范制备检测样品,运用流式细胞分析仪检测Th1、Th2、Treg、Th17等的数量及比例。见表5,图3~5。

空白组 模型组 脾氨肽组 氯雷他定组

空白组 模型组 脾氨肽组 氯雷他定组

空白组 模型组 脾氨肽组 氯雷他定组
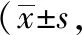
表5 各组AR模型大鼠免疫细胞、炎症因子等流式检测结果鼠只=5)
从细胞比例来看,与空白组相比,模型组Th1、Treg均降低,Th2、Th17均升高,且Th2升高更明显(P<0.05);与模型组相比,脾氨肽组、氯雷他定组Th1、Treg均升高,Th2、Th17均降低,且氯雷他定组下降更明显(P<0.05)。从mean值来看,与空白组相比,模型组IL-4、IL-17均升高,IFN-γ降低,且IFN-γ降低更明显(P<0.05);与模型组相比,脾氨肽组、氯雷他定组IL-4、IL-17均升高,IFN-γ均降低。提示脾氨肽口服溶液可能是通过影响IL-4、IL-17、IFN-γ等炎症因子的分泌,调控Th1/Th2、Treg/Th17的免疫平衡发挥防治AR的作用。
2.6 脾氨肽口服溶液对AR复发大鼠IFN-γ、IL-5、IL-2、TNF-α、GM-CSF、IL-4、IL-17F、IL-17A、IL-13、IL-22、IL-6的影响
各组大鼠于实验第49天,腹主动脉取外周血,分离得到血清,通过流式细胞分析仪用因子检测试剂盒检测各组大鼠IFN-γ、IL-5、IL-2、TNF-α、GM-CSF、IL-4、IL-17F、IL-17A、IL-13、IL-22、IL-6共11种因子,得到各组大鼠以上11种因子的表达情况。见表6。
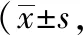
表6 各组AR模型大鼠血清多种炎症因子检测结果鼠只=5)
多种因子检测结果显示,与空白组比较,模型组IFN-γ、IL-5、IL-2、TNF-α、GM-CSF、L-4、IL-17A、IL-13、IL-6水平均高于空白组,且模型组与空白组IL-4水平存在极大差异(P<0.001),提示IL-4升高可引发大鼠AR的发生。脾氨肽组IFN-γ、IL-5、IL-2、TNF-α、GM-CSF、IL-17F、IL-17A、IL-13、IL-22、IL-6水平均高于模型组,IL-4水平低于模型组,提示脾氨肽口服溶液能刺激多种炎症因子分泌,激活免疫系统,并抑制IL-4分泌,减少B细胞种型转换,从而减少IgE产生,预防AR的发生或复发。
3 讨论
3.1 AR复发模型评价
临床研究显示,AR复发发作时患者多出现流涕、喷嚏、鼻痒、鼻塞的症状,鼻黏膜水肿,鼻腔分泌物增多。本次动物实验进行大鼠鼻部症状行为学评分时发现其症状主要为鼻痒、喷嚏,其次为流涕,与临床表现基本一致,且模型组鼻部症状行为学评分显著高于空白组,模型组嗜酸、嗜碱性粒细胞水平均显著高于复发空白组(P<0.01),鼻组织病理切片提示模型组大鼠鼻黏膜出现淋巴细胞浸润,组间发病率为2/5,伴有steno腺轻度空泡变性和黏膜内杯状细胞增生,空白组鼻黏膜结构未见异常。以上结果表明,大鼠AR复发模型造模成功。
3.2 脾氨肽口服溶液在AR复发中的疗效及其作用机制小结
3.2.1 脾氨肽口服溶液对改善AR复发症状疗效确切 脾氨肽口服溶液对防治AR复发疗效确切,主要体现在以下3个方面:
(1)脾氨肽口服溶液不仅能有效减轻AR复发大鼠鼻部喷嚏、流涕、鼻痒等症状,而且能预防AR复发,经过预防治疗的AR大鼠鼻部症状行为学表现较平稳,鼻黏膜组织损伤小,免疫细胞状态稳定;
(2)脾氨肽口服溶液能降低AR复发大鼠嗜酸性粒细胞、嗜碱性粒细胞水平,使之趋近正常水平,缓解过敏反应;
(3)脾氨肽口服溶液能有效减轻AR复发鼻黏膜组织损伤,缓解淋巴细胞浸润,防止steno腺变性。
3.2.2 脾氨肽口服溶液主要通过调节Th1和Th2的免疫平衡起到防治AR复发的作用 从流式多因子检测结果和流式细胞术检测Th1、Th2、Treg、Th-17等的结果来看,脾氨肽口服溶液能降低AR复发大鼠Th2细胞水平,显著下调IL-4,提高Th1细胞比例,刺激INF-γ分泌,增强单核巨噬系统活性,提高机体细胞免疫水平,抑制容易诱发过敏的体液免疫,促进免疫平衡。
3.2.3 脾氨肽口服溶液与氯雷他定片治疗AR复发的机制不同 鼻部症状行为学评分显示,脾氨肽口服溶液能明显减轻AR复发大鼠喷嚏和鼻痒症状,疗效持久且稳定。氯雷他定片在初次鼻炎时能较好地缓解症状,但在复发阶段治疗作用减弱。而脾氨肽口服溶液治疗组(脾氨肽组)行为学评分在复发初期已接近空白组。通过检测各组大鼠嗜酸性粒细胞、嗜碱性粒细胞、总IgE、OVA特异性IgE、炎症因子水平等,发现脾氨肽口服溶液和氯雷他定治疗AR复发的机制不同,具体如下:
(1)从病理涂片结果来看,脾氨肽口服溶液在缓解喷嚏、流涕、鼻痒等AR复发症状的同时能较好地减少杯状细胞增生和黏膜基底细胞增多,氯雷他定虽也能有效缓解鼻部过敏症状,但不能减轻鼻部组织炎症表现;
(2)脾氨肽口服溶液能显著降低AR复发大鼠Th2细胞水平,尤其能抑制IL-4的表达,氯雷他定片对AR复发大鼠Th2水平的影响较小。脾氨肽口服溶液在抑制Th2反应的同时可以促进Th1和IFN-γ的释放,能够恢复被过敏反应破坏的免疫平衡,而氯雷他定片对Th1和Th2都是抑制的。
3.3 进一步开展相关研究的展望
本实验通过鼻部症状行为学评分、外周血嗜酸、嗜碱性粒细胞检测和鼻组织病理检测明确了脾氨肽口服溶液在AR复发中的防治作用,通过Elisa检测IgG、IgE、OVA特异性IgG、OVA特异性IgE、流式细胞术检测Th1、Th2、Treg、Th-17和对IL-4、IFN-γ等炎症因子的检测揭示了脾氨肽口服溶液主要是通过调节免疫球蛋白水平,促进体液免疫和细胞免疫的平衡发挥防治AR复发的作用,但脾氨肽口服溶液防治AR复发的有效成分和作用靶点尚不明晰。在今后的实验中,拟运用表面等离子体共振技术、液相色谱-质谱联用技术等进一步探究脾氨肽口服溶液防治AR复发的有效药物成分,运用定量化学蛋白质组学技术、代谢组学技术等从更深层次揭示脾氨肽口服溶液有效防治AR复发的作用靶点,以期为脾氨肽口服溶液广泛用于AR临床治疗提供更确切的理论支撑[29-32]。
