红曲对克拉玛依地区少数民族颈动脉粥样硬化患者血脂及炎症因子的影响
2023-11-28陈振东党晓玲张红英
施 洋 陈振东 秦 荣 党晓玲 张红英
动脉粥样硬化(AS)作为诱发心脑血管疾病的重要危险因素,目前已被医药工作者重点关注[1]。该病与血脂异常和炎症反应密切相关,病变自动脉内膜起始,伴随脂质积聚、纤维组织增生和钙化,最终导致斑块破裂,形成局部血栓[2]。其中,颈动脉粥样硬化是导致缺血性脑卒中发生的最主要因素,而有效预防斑块形成、积极控制危险因素成为目前临床研究的重点方向。
药物干预已被公认为治疗AS 最重要、最常规的手段之一,而降脂药物因具有调整血液中的脂类成分,减轻血管内皮细胞炎症反应,稳定斑块等作用受到医学界的推荐[3]。红曲为我国历史悠久的发酵制品,具有健脾消食、活血化瘀功效。现代药理学研究发现其具有降血脂、降血压、降血糖、抗炎、抗肿瘤等生物活性[4]。研究表明,红曲内含有洛伐他汀同系混合物,通过抑制羟甲基戊二酰辅酶A(HMG-CoA)还原酶发挥降脂作用[5]。克拉玛依地处我国西北部,少数民族分布较多,饮食以高糖、高脂、高热量食物为主,故血脂异常患者较为常见[6]。基于此,本研究就红曲对克拉玛依地区少数民族颈动脉粥样硬化患者血脂及炎症因子的影响进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月至2020年1月于新疆克拉玛依市中西医结合医院就诊的少数民族颈动脉粥样硬化患者60 例作为研究对象,随机分为观察组和对照组,每组30 例。观察组男19 例,女11 例;年龄54~74 岁,平均(62.6±8.2)岁;高脂血症13 例,高血压17 例。对照组男17 例,女13 例;年龄52~75 岁,平均(61.4±7.5)岁;高脂血症15 例,高血压19 例。
纳入标准:1)颈动脉超声检查显示颈动脉内膜中层厚度(IMT)≥1.0 mm;2)入组前未服用过调脂药物;3)自愿接受本研究且能坚持长期服药;4)签署了知情同意书。排除标准:1)近3 个月内服用利尿剂、β 受体阻断剂、糖皮质激素等可引起继发性血脂异常的药物;2)糖尿病、甲状腺功能异常、肾病综合征、恶性肿瘤等疾病;3)发生过心肌梗死、脑卒中等心脑血管事件;4)合并严重肝肾功能损伤。
1.2 试验药物及试剂
红曲饮片(杭州桐君堂医药药材有限公司中药饮片厂,批号:211101,规格:6 g/袋);阿托伐他汀钙片(浙江乐普制药科技有限公司,批号:201903615B,规格:20 mg/片);人肿瘤坏死因子-α(TNF-α)检测试剂盒,上海爱必信生物科技有限公司,货号:abs510006,规格:96T;人白细胞介素-1β(IL-1β)检测试剂盒,上海爱必信生物科技有限公司,货号:abs551101,规格:96T;人白细胞介素-8(IL-8)检测试剂盒,上海爱必信生物科技有限公司,货号:abs551805,规格:96T。
1.3 治疗方法
观察组给予红曲饮片,1 袋/次,2 次/d,饭后于150 ml 温开水浸泡20 min 待完全溶解后服用,连续服用6 个月;对照组予以阿托伐他汀钙片,20 mg/次,1 次/d,口服,连续服用6 个月。
治疗期间避免服用影响血脂代谢的药物及保健品,生活方式及饮食结构不作特殊要求,每隔1 个月电话随访入组患者的用药情况。
1.4 观察指标
两组患者分别在治疗前和治疗后晨起采集空腹肘静脉血,于COBAS C701 型全自动生化分析仪(德国罗氏公司)检测血脂[总胆固醇(TC)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)及高密度脂蛋白胆固醇(HDL-C))和超敏C反应蛋白(hs-CRP)、白细胞介素-6(IL-6)]水平。采用双抗体夹心酶联免疫吸附试验(ELISA)法,按照试剂盒说明书操作步骤测定血清肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)及白细胞介素-8(IL-8)水平。应用彩色多普勒超声诊断仪(意大利百胜医疗公司)行颈动脉内膜中层厚度(IMT)检查,具体操作如下:患者取仰卧位,探头置于颈总动脉距离分叉处约1 cm,于心室舒张期保存图像,测量颈动脉管腔内膜与中层外膜之间的距离即为该心动周期内的IMT。连续测量3 个心动周期同侧IMT 并取平均值作为实际测量值。并记录治疗期间患者药物不良反应发生情况。
1.5 统计学分析
采用SPSS 22.0 统计软件进行数据分析,计量资料以±s 表示,组间比较采用t检验,计数资料以百分率表示,组间比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 血脂指标
治疗前两组患者TC、TG、LDL-C、HDL-C 水平比较差异无统计学意义(P>0.05);治疗后,两组患者TC、TG、LDL-C 较治疗前显著降低(P<0.05),HDL-C 水平显著升高(P<0.05),与对照组相比,观察组HDL-C 升高程度更显著(P<0.05)。见表1。
表1 两组患者治疗前后血脂指标比较(mmol/L,±s)

表1 两组患者治疗前后血脂指标比较(mmol/L,±s)
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
组别 例数 时间 TC TG LDL-C HDL-C治疗前 7.01±0.68 3.19±0.62 4.67±0.85 0.83±0.15对照组 30 治疗后 5.79±0.63a 1.95±0.75a 3.52±0.74a 1.18±0.40a治疗前 6.94±0.77 3.23±0.59 4.88±0.91 0.81±0.18观察组 30 治疗后 5.62±0.73a 2.04±0.69a 3.74±0.78a 1.40±0.34ab
2.2 炎症因子
治疗前,观察组和对照组患者血清hs-CRP、TNF-α、IL-1β、IL-6 及IL-8 水平比较,差异无统计学意义(P>0.05);治疗后,两组血清hs-CRP、TNF-α、IL-1β、IL-6 及IL-8 水平较治疗前明显下降(P<0.05),但组间比较差异无统计学意义(P>0.05)。见表2。
表2 两组患者治疗前后炎症因子比较(±s)
注:与本组治疗前比较,aP<0.05
组别 例数 时间 hs-CRP(mg/L)TNF-α(ng/ml)IL-1β(pg/ml)治疗前 4.69±0.55 1.24±0.18 5.90±0.82 对照组 30 治疗后 2.07±0.57a 0.80±0.09a 4.10±0.71a 治疗前 4.61±0.58 1.26±0.20 5.88±0.73 观察组 30 治疗后 2.13±0.61a 0.82±0.11a 4.05±0.66a IL-6(pg/ml)IL-8(μg/L)5.69±0.60 17.19±2.37 3.18±0.54a 11.65±2.48a 5.75±0.68 16.71±2.123.31±0.51a 11.44±2.53a
2.3 IMT
治疗前两组患者IMT 比较差异无统计学意义(P>0.05);治疗后,两组IMT 较治疗前显著改善,相较于对照组,观察组IMT 减小程度更明显,差异有统计学意义(P<0.05)。见表3。
表3 两组患者治疗前后IMT 值比较(mm,±s)
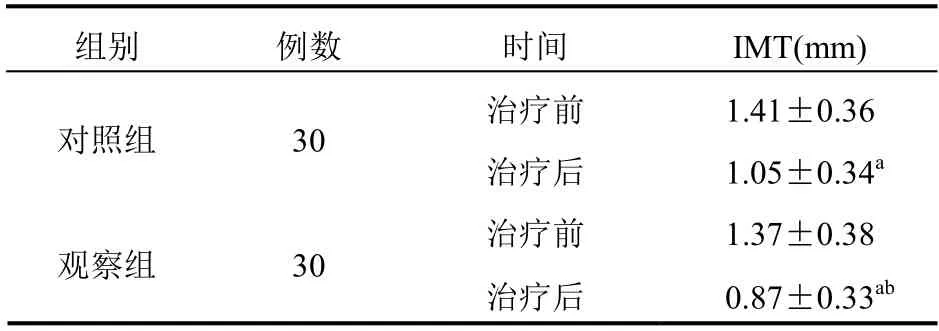
表3 两组患者治疗前后IMT 值比较(mm,±s)
注:与本组治疗前比较,aP<0.05;与对照组治疗后比较,bP<0.05
组别 例数 时间 IMT(mm)治疗前 1.41±0.36对照组 30 治疗后 1.05±0.34a治疗前 1.37±0.38观察组 30 治疗后 0.87±0.33ab
2.4 药物不良反应
两组患者服用相应药物治疗期间,经随访得知,均未出现严重药物不良反应,治疗6 个月后复查肝、肾功能均未出现异常。由于HMG-CoA 还原酶抑制剂类药物具有肌肉损伤的不良反应,故于治疗后对两组患者均进行生化全项检查,结果未见异常,患者也未诉用药期间出现肌肉酸痛等不适症状。观察组在治疗期间出现药物不良反应5 例,其中3 例为胃肠道反应,表现为腹胀、恶心及胃部不适;2 例为神经系统反应,表现为头晕、头痛。对照组在治疗期间出现药物不良反应8 例,其中5 例为胃肠道反应,表现为腹胀、嗳气及腹痛;2 例为皮肤及附属物反应,表现为皮疹、瘙痒;1 例为神经系统反应,表现为头晕。观察组不良反应发生率16.67%(5/30)低于对照组26.67%(8/30),差异有统计学意义(P<0.05)。
3 讨论
AS 主要累及体循环系统的大型肌弹力型动脉和中型肌弹力型动脉,病变分布以心、脑、肾等重要器官为主。该病的发病机制尚未明确,根据不同角度有多种学说阐释,包括脂质浸润学说、内皮损伤反应学说、血小板聚集和血栓形成假说、炎性学说和氧化应激学说等[7]。AS 病变发展过程经历6 个阶段,Ⅰ期为脂质点期,动脉内膜出现小黄点;Ⅱ期为脂质条纹期,内膜可见黄色条纹并含有脂滴;Ⅲ期为斑块前期,内膜和中膜平滑肌层之间形成脂核;Ⅳ期为粥样斑块期,脂质池形成,内膜结构破坏,动脉壁变形;Ⅴ期为纤维粥样斑块期,斑块突入管腔并造成破坏,纤维结缔组织增生、变性、坏死;Ⅵ期为复合病变期,纤维斑块发生出血、坏死、溃疡、钙化,附壁血栓形成[8]。血栓脱落导致血管阻塞,诱发器官缺血坏死,从而影响机体正常功能。
血脂代谢异常涉及TC、TG、LDL-C 的升高伴或不伴有HDL-C 的降低。AS 是一个受多因素影响的复杂病理过程,包括机械性、化学性、生物性等因素,其中血脂异常占重要地位。长期高脂血症环境下,血液中的LDL-C 被氧化修饰成氧化低密度脂蛋白(oxLDL),促使内皮细胞和白细胞表面特性发生变化,与AS 形成和发展密切相关[9]。与LDL-C作用相反,HDL-C 被证实具有抗AS 的作用,通过将胆固醇从肝外组织转运至肝脏内代谢,减少超氧阴离子生成,保护内皮细胞合成和释放的NO 不受破坏[10]。本研究发现,红曲降低TC、TG、LDL-C 水平与阿托伐他汀相当,升高HDL-C 程度明显优于阿托伐他汀,提示其调脂功效强劲,改善血脂代谢异常效果满意。
超声IMT 检查已被广泛应用于临床诊疗中,成为颈动脉粥样硬化的早期敏感指标,与AS 严重程度正相关[11]。IMT 增加预示着颅内动脉小血管发生病变,进而影响大脑微循环,致使脑血流量减少,产生弥漫性低灌注和慢性缺氧,增加脑血流灌注不足发生风险,最终引发脑卒中[12]。近年来的研究证实,IMT 增加不仅与脑血管事件相联,与心血管事件的发生亦有紧密联系[13]。本研究发现,红曲可显著减轻颈动脉粥样硬化病变,消退斑块,作用优于阿托伐他汀。
大量学者认为,炎症反应是AS 的核心环节,参与该进程的核心通路主要涉及IL-1/TNF-α 信号转导通路和IL-6 信号转导通路[14]。IL-1β、IL-6 和TNF-α作为炎症因子,其表达和释放可诱导炎症反应发生,加重血管内皮细胞损伤,刺激平滑肌细胞增殖,导致斑块进展。hs-CRP 在预测未来血管事件中的作用得到肯定,其鉴别意义与TC 和HDL-C 相似[15]。IL-8是一种强有力的炎症因子,在AS 斑块形成、破裂、出血和血栓形成中均发挥重要作用,对于临床预后评估具有重要意义[16]。本研究结果表明,红曲可显著降低患者血清hs-CRP、TNF-α、IL-1β、IL-6 及IL-8水平,抑制炎症因子释放,减轻炎症反应,具有积极的抗炎作用。
综上所述,红曲具有降血脂、抗炎、抑制颈动脉粥样硬化的作用,其改善HDL-C 及IMT 程度优于阿托伐他汀。此外,鉴于红曲在治疗期间发生药物不良反应的概率低于阿托伐他汀,且副作用较轻微,故建议尝试长期服用红曲替代阿托伐他汀治疗AS 患者,以求收获临床满意效果。
