基于OCT2、MRP2探讨加味生脉饮对Lewis肺癌小鼠顺铂化疗的增效减毒机制
2023-11-28徐虹云吴春玉吴林霖刘庆南王丹凝客蕊
徐虹云, 吴春玉, 吴林霖, 刘庆南, 王丹凝, 客蕊
(1.黑龙江中医药大学,黑龙江哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江哈尔滨 150040)
顺铂是临床使用最为广泛的抗癌药物,在治疗肺癌、乳腺癌等实体肿瘤中具有较好疗效,可通过抑制肿瘤细胞DNA 分裂过程,诱导细胞凋亡等方式来达到治疗效果[1-2]。铂类药物虽经过多年研究的改进,但肾脏毒性仍然是其最主要的不良反应。研究[3-4]发现,接受顺铂药物治疗的患者急性肾损伤的比例是其他住院患者的2倍以上。在使用高剂量顺铂治疗的晚期肿瘤患者中,急性肾损伤比例达到69%[5]。急性肾损伤会导致患者肾功能快速下降,严重者会发展为尿毒症甚至造成死亡结局[6]。肾毒性严重阻碍了顺铂的应用,降低了治疗效率。因此,研究顺铂药物的作用机制,提升疗效、降低毒性至关重要。顺铂造成肾毒性的主要原因是顺铂药物经肾小管转运,肾脏内药物浓度较其他器官高,顺铂中氯离子可造成肾小管坏死[7]。有机阳离子转运体2(OCT2)是分布在肾小管中的阳离子转运体,与顺铂的转运高度相关,而存在于肿瘤细胞中的多药耐药相关蛋白2(MRP2)可排出顺铂药物,造成肿瘤耐药性[8-9]。提示这2种通路是改进顺铂疗效、降低肾毒性的关键。近年来,众多研究发现中药联合顺铂具有增效减毒作用[10]。加味生脉饮由《备急千金要方》中经典方剂生脉饮改进而来,具有活血益气的功效,已有研究发现,加味生脉饮可抑制肺部肿瘤细胞的增殖,具有抗癌功效[11]。因此,本研究基于OCT2/MRP2 信号通路探讨加味生脉饮对Lewis 肺癌小鼠顺铂化疗的增效减毒机制,以期拓展顺铂的临床应用,现将研究结果报道如下。
1 材料与方法
1.1 动物与细胞株28只6 ~8周SPF级雄性BALB/c小鼠,体质量17 ~23 g,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0006。此次实验获得黑龙江中医药大学实验动物管理和使用委员会审核(伦理批号:ZYY2019-01-0856)。小鼠Lewis 肺癌细胞株(LLC),购自中国科学院细胞库。
1. 2 药物及制备加味生脉饮,由生晒参、麦冬、五味子、蜂房、地龙组成,各生药饮片,由黑龙江中医药大学附属第一医院中药房提供,将生晒参、麦冬、五味子、蜂房、地龙按3∶6∶2∶2∶3的比例常规方法煎煮,药液过滤浓缩成3 g/mL 后放置于4 ℃冰箱备用。顺铂注射液(齐鲁制药有限公司,生产批号:1W2A1301004B,规格:50 mg/50 mL),用生理盐水稀释成3 mg/kg,置于-20 ℃冰箱备用。
1. 3 试剂与仪器DMEM 培养基(上海源培生物科技公司);胎牛血清和胰蛋白酶(Lonsera 公司);辣根过氧化物酶(HRP)标记山羊抗兔IgG(碧云天生物技术有限公司);GAPDH 兔单克隆抗体,OCT2、MRP2 兔多克隆抗体(美国Abcam 公司);肌酐(Cr)、尿素氮(BUN)测定试剂盒(武汉默沙克生物科技有限公司)。KBX41 电子显微镜(日本奥林巴斯公司);ELx800 酶标仪(美国Bio-Tek 公司);低温冷冻离心机(杭州亿恒科技有限公司);DYY-Ⅲ蛋白电泳仪、DYCZ-40D 转膜仪(北京六一生物科技);高效液相色谱串联质谱(HPLC-MS/MS)由Agilent1200 系列高效液相色谱仪(美国安捷伦公司)和ABAPI4000Q型质谱仪(美国AB公司)组成。
1. 4 Lewis 肺癌小鼠模型构建冻存LLC 细胞于37 ℃复苏后,置于DMEM 培养液(含10%胎牛血清)中,在37 ℃、5% CO2培养箱中培养。细胞培养15 ~20 代,取对数生长期细胞,用胰蛋白酶消化,配制成1 × 106个/mL 的细胞悬液。将0.2 mL细胞悬液接种在小鼠腋窝皮下,接种后每日观察小鼠皮下肿瘤大小,当肿瘤体积≥50 mm3时即为模型构建成功[肿瘤体积(mm3)=长直径(mm)×短直径(mm)2×0.5]。
1.5 分组与给药将28只模型构建成功的小鼠随机分为4组,分别为对照组、顺铂组、联合组、生脉饮组,每组7只。顺铂组与联合组隔天腹腔注射一次3 mg/kg 顺铂注射液,对照组与生脉饮组同时间腹腔注射同体积生理盐水;联合组与生脉饮组使用灌胃方式注入455 mg/kg(根据临床用量换算得出,成人每日用量约为0.45 g/kg)的加味生脉饮,1 次/d,对照组与顺铂组注入同体积纯净水。连续给药14 d。
1.6 观察指标与方法
1. 6. 1 Lewis 肺癌小鼠体质量、状态及肿瘤生长情况 开始给药前及给药结束后测定小鼠体质量,观察小鼠状态;给药期间隔天测定小鼠肿瘤体积。给药结束后处死小鼠,剥离肿瘤组织称质量。
1.6.2 Lewis肺癌小鼠组织病理学 将小鼠肿瘤组织及肾脏组织切片,固定于4%的甲醛溶液中,脱水、包埋、制片,进行HE 染色,并在显微镜下观察拍照。
1. 6. 3 Lewis 肺癌小鼠血清BUN、Cr 浓度 给药结束后取小鼠血液,5424R型高速冷冻离心机离心得血清,使用Cr 测定试剂盒(微板法)、BUN 测定试剂盒(脲酶法)按照说明书指导,使用ELx800 酶标仪测定血清BUN、Cr浓度。
1.6.4 Lewis肺癌小鼠OCT2、MRP2蛋白表达
1. 6. 4. 1 免疫组织化学(IHC)分析 小鼠肿瘤组织及肾脏组织常规固定制片后进行IHC 染色,肿瘤组织切片使用MRP2(1∶500)抗体孵育、肾脏组织用OCT2(1∶200)抗体孵育,SP 法显色,显色后应用显微镜观察拍照。
1.6.4.2 Western Blot 蛋白分析 将小鼠肿瘤组织与肾脏组织分别用液氮研磨,与裂解液(PMSF∶RIPA=1∶100)混合均匀,并在4 ℃离心(转速12 000 r/min,10 min,离心半径8 cm),取上清液加入十二烷基硫酸钠(SDS)-聚丙烯酰氨凝胶电泳(PAGE)缓冲液,煮沸后放冷。样品经SDS-PAGE 凝胶电泳分离蛋白组分,使用PVDF 膜转膜,以5%脱脂奶粉封闭2 h,4 ℃孵育相应一抗(1∶1 000)过夜,洗膜,次日室温孵育二抗(1∶10 000)1 h,洗膜,显影。应用ImageJ 软件扫描蛋白条带进行灰度值分析。以目的条带与内参GAPDH 条带灰度值比值表示目的蛋白的相对表达量。
1.6.5 HPLC-MS/MS 法测定顺铂含量 ①待测液配制:肿瘤组织和肾脏组织分别与生理盐水以1∶10 的比例混合研磨,离心(离心参数同“1.6.4.2”项)后取上清液加入2 倍甲醇,再次离心后取上清液用0.22 μm 滤膜过滤。②色谱参数:色谱柱-Agilent SB C18(150 mm × 2.1 mm × 3.5 μm);流动相(A:0.1%甲酸;B:乙腈);梯度洗脱,流速0.30 mL/min。③质谱参数:质谱离子化模式,正离子,电喷雾离子化源;检测方式,多反应监测;母离子301.2,m/,z,子离子为284.2,m/,z和88.9,m/,z;离子源温度550 ℃。方法学验证符合标准。
1. 7 统计方法采用SPSS 21.0 统计软件处理数据,计量资料用均数±标准差(±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用SNK-,q检验,以,P<0.05为差异有统计学意义。
2 结果
2. 1 各组Lewis 肺癌小鼠状态及体质量比较对照组和顺铂组小鼠给药14 d 后均有脱毛、摄食量减少、活动量减少、反应迟钝等现象;生脉饮组和联合组小鼠毛发较为光滑,摄食量略有减少,反应较灵敏,活动量正常,整体状态优于对照组和顺铂组。
干预14 d 后,各组小鼠体质量均有下降,顺铂组下降幅度最大(P<0.05),顺铂组体质量变化与联合组、生脉饮组有显著性差异(P<0.05),联合组、生脉饮组体质量变化与对照组有显著性差异(P<0.05)。见表1。
表1 各组Lewis肺癌小鼠体质量变化比较Table 1 Comparison of changes in body mass among each group of Lewis lung cancer mice(±s,g)

表1 各组Lewis肺癌小鼠体质量变化比较Table 1 Comparison of changes in body mass among each group of Lewis lung cancer mice(±s,g)
注:①,P<0.05,与对照组比较;②,P<0.05,与顺铂组比较;③,P<0.05,与同组给药第0天比较
体质量变化1.45±0.47 2.38±1.23 0.20±0.65①②0.48±0.97①②8.952<0.001组别对照组顺铂组联合组生脉饮组,F值,P值鼠数/只7 7 7 7体质量给药后第0天20.96±1.39 20.15±1.15 19.86±1.31 20.68±1.27 1.059 0.385给药后第14天19.50±1.30 17.76±1.13①③19.66±1.48①20.20±1.15②4.810 0.009
2.2 各组Lewis肺癌小鼠肿瘤生长情况比较
2.2.1 肿瘤体积变化 随干预天数增加,结果显示:生脉饮组和对照组肿瘤体积不断增加;顺铂组肿瘤体积先下降后增加,至干预结束时肿瘤体积小于生脉饮组和对照组(P<0.05);联合组肿瘤体积呈下降趋势,干预结束时肿瘤体积显著小于生脉饮组、对照组和顺铂组(P<0.05)。见图1。

图1 各组Lewis肺癌小鼠肿瘤体积变化比较(±s)Figure 1 Comparison of changes in tumour volume among each group of Lewis lung cancer mice(±s)
2.2.2 肿瘤质量 至干预结束时,顺铂组、联合组肿瘤质量显著小于生脉饮组和对照组(P<0.001),联合组肿瘤质量显著小于顺铂组(P<0.001)。见图2。

图2 各组Lewis肺癌小鼠肿瘤质量比较(±s)Figure 2 Comparison of tumour mass among each group of Lewis lung cancer mice(±s)
2.3 各组Lewis肺癌小鼠组织病理学变化比较
2.3.1 肿瘤组织病理学变化 对照组、生脉饮组肿瘤细胞结构清晰,细胞形态正常;顺铂组、联合组可见肿瘤细胞坏死,肿瘤细胞边缘模糊,联合组肿瘤细胞坏死面积更大。见图3。
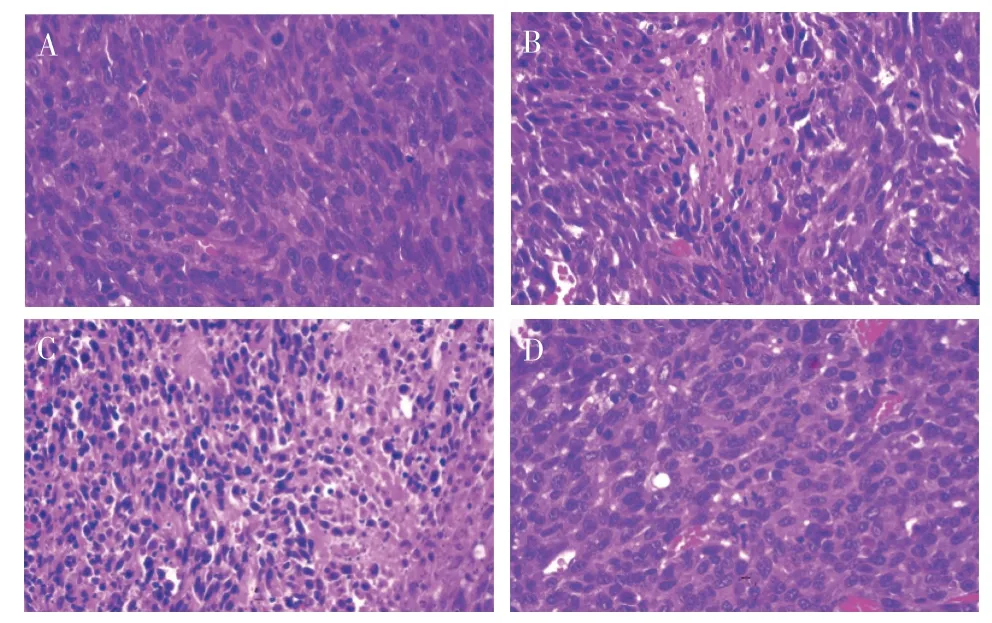
图3 各组Lewis肺癌小鼠肿瘤组织病理学变化比较(HE染色,×400)Figure 3 Comparison of histopathological changes in tumors among each group of Lewis lung cancer mice(HE staining,×400)
2.3.2 肾组织病理学变化 生脉饮组、对照组肾组织细胞形态正常;联合组肾组织细胞损伤较轻,无明显病变;顺铂组肾组织明显病变,肾小管上皮细胞边缘模糊。见图4。
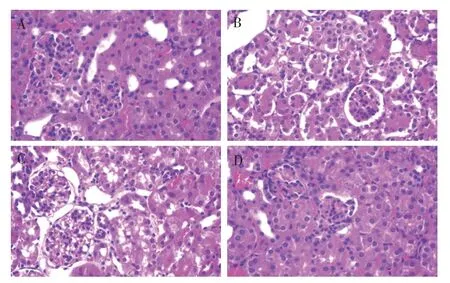
图4 各组Lewis肺癌小鼠肾组织病理学变化比较(HE染色,×400)Figure 4 Comparison of histopathological changes in renal tissues among each group of Lewis lung cancer mice(HE staining,×400)
2.4 各组Lewis肺癌小鼠血清BUN、Cr浓度比较顺铂组小鼠BUN、Cr 水平显著高于其他3 组(P<0.05),联合组、生脉饮组、对照组组间BUN、Cr水平无显著性差异(P>0.05),见表2。
表2 各组Lewis肺癌小鼠血清BUN、Cr浓度比较Table 2 Comparison of serum BUN and Cr concentrations among each group of Lewis lung cancer mice(±s,μmol·L-1)

表2 各组Lewis肺癌小鼠血清BUN、Cr浓度比较Table 2 Comparison of serum BUN and Cr concentrations among each group of Lewis lung cancer mice(±s,μmol·L-1)
注:①,P<0.05,与顺铂组比较
组别对照组顺铂组联合组生脉饮组,F值,P值Cr 35.47±5.41①57.28±6.15 37.34±5.29①31.65±5.93①28.359<0.001鼠数/只7777 BUN 2.41±0.53①3.94±0.97 2.36±0.72①2.45±0.61①7.895<0.001
2. 5 各组Lewis 肺癌小鼠OCT2、MRP2 蛋白表达比较
2. 5. 1 肾组织OCT2 表达情况 IHC 染色结果显示,顺铂组、联合组及生脉饮组OCT2 表达水平较对照组显著升高(P<0.05),联合组与生脉饮组OCT2 表达水平较顺铂组显著降低(P<0.05)。见图5 ~图6。

图5 各组Lewis肺癌小鼠肾组织OCT2免疫组织化学(IHC)染色结果(×400)Figure 5 OCT2 immunohistochemical(IHC)staining results of kidney tissues in each group of Lewis lung cancer mice(×400)

图6 各组Lewis肺癌小鼠肾组织OCT2 免疫组织化学(IHC)阳性面积率比较(±s)Figure 6 Comparison of OCT2 immunohistochemistry(IHC)positive area rate of kidney tissues among each group of Lewis lung cancer mice(±s)
Western Blot检测结果显示,顺铂组OCT2表达水平较对照组显著升高(P<0.001),联合组与生脉饮组OCT2 表达水平较顺铂组显著降低(P<0.01)。见图7 ~图8。

图7 各组Lewis肺癌小鼠肾组织OCT2的Western Blot条带图Figure 7 Western Blot strip chart of renal tissue OCT2 in each group of Lewis lung cancer mice

图8 各组Lewis肺癌小鼠肾组织OCT2相对蛋白表达量比较(±s)Figure 8 Comparison of relative protein expression of OCT2 in kidney tissues among each group of Lewis lung cancer mice(±s)
2. 5. 2 肿瘤组织MRP2 表达情况 IHC 染色结果显示,顺铂组MRP2表达水平较对照组显著升高(P<0.05),联合组与生脉饮组MRP2 表达水平较顺铂组显著降低(P<0.05)。见图9 ~图10。
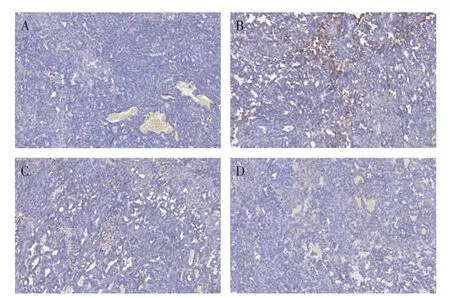
图9 各组Lewis肺癌小鼠肿瘤组织MRP2免疫组织化学(IHC)染色结果(×400)Figure 9 MRP2 immunohistochemical(IHC)staining results of tumour tissues in each group of Lewis lung cancer mice(×400)
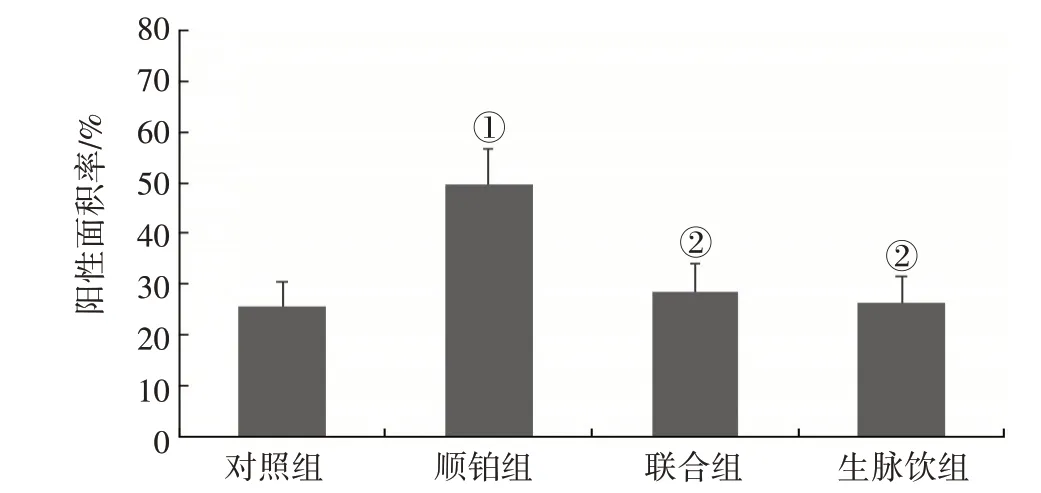
图10 各组Lewis肺癌小鼠肿瘤组织MRP2免疫组织化学(IHC)阳性面积率比较(±s)Figure 10 Comparison of OCT2 immunohistochemistry(IHC)postive area rate of tumour tissues among each group of Lewis lung cancer mice(±s)
Western Blot 检测结果显示,顺铂组MRP2 表达水平较对照组显著升高(P<0.001),联合组与生脉饮组MRP2 表达水平较顺铂组显著降低(P<0.001)。见图11 ~图12。
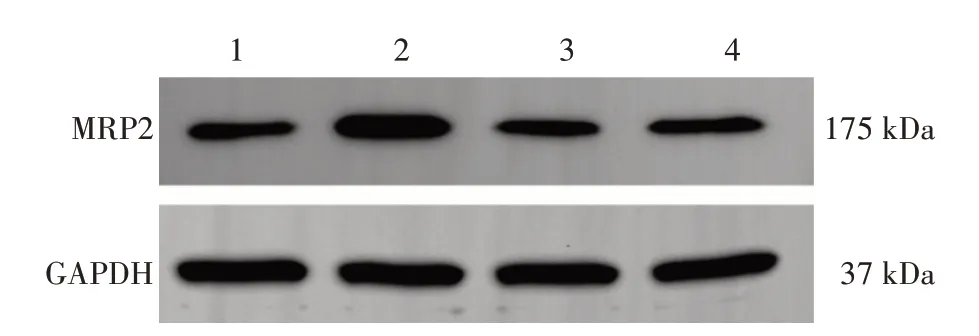
图11 各组Lewis肺癌小鼠肿瘤组织MRP2的Western Blot条带图Figure 11 Western Blot strip chart of tumour tissue MRP2 in each group of Lewis lung cancer mice

图12 各组Lewis肺癌小鼠肿瘤组织MRP2相对蛋白表达量比较(±s)Figure 12 Comparison of relative protein expression of MRP2 in tumour tissues among each group of Lewis lung cancer mice(±s)
2. 6 各组Lewis 肺癌小鼠肿瘤组织和肾脏组织中顺铂含量比较联合组肿瘤组织中顺铂含量显著高于顺铂组(P<0.01),联合组肾脏组织中顺铂含量显著低于顺铂组(P<0.001),见图13 ~图14。

图13 2组Lewis肺癌小鼠肿瘤组织中顺铂含量比较(±s)Figure 13 Comparison of cisplatin content in tumor tissues between the two groups of Lewis lung cancer mice(±s)

图14 2组Lewis肺癌小鼠肾脏组织中顺铂含量比较(±s)Figure 14 Comparison of cisplatin content in kidney tissues between the two groups of Lewis lung cancer mice(±s)
3 讨论
大量研究发现,中西医结合治疗肿瘤疗效确切,可降低西药带来的毒副作用。因此,中西医结合逐渐成为抗癌治疗的主要方式。肺癌患者经化疗后,机体受到损害,出现骨髓抑制、肝肾毒素堆积等情况,在中医理念中为阴伤证候,因此需要补阴益肾,滋养气血[12]。加味生脉饮方中:生晒参大补元气;麦冬、五味子滋阴补气、清热润肺;相比原方增加蜂房、地龙2味药物。中医认为虫类药物在治疗“癌毒”方面具有独特的优势,癌毒与湿、瘀等相互作用,形成肿瘤,且久病入络,虫类药物为血肉有情之品,具备走窜之性,活血通络的性质优于草本和矿物药,且癌症为消耗性疾病,化疗进一步消耗患者元气,二者可同时补虚扶弱,增益正气,减轻化疗毒性[13]。已有研究[14]证明,生脉饮可增加化疗药物的抗肿瘤作用,并降低化疗造成的毒性反应。现代药理学研究[15-18]也证明,加味生脉饮药材中皂苷等成分可抑制肿瘤细胞的生长转移,蜂房中黄酮类、萜类、甾类化学物质具有增强免疫力的作用,而地龙中多肽类组分对肾脏损害具有改善作用,具有较高的潜力。因此,本研究中构建了Lewis 肺癌小鼠模型,考察加味生脉饮与顺铂联用的干预作用,阐明加味生脉饮对肺癌顺铂化疗的增效减毒机制。
铂类药物是抗癌药物的主流,但涉及信号通路众多,缺少选择性易造成肿瘤细胞的耐药性和肾脏毒性,因此构建低毒、高效的治疗方案仍是研究热点[19]。赵星雨等[20]研究表明,生脉饮联合顺铂能抑制肿瘤生长,延长机体存活时间。本研究结果发现,给予加味生脉饮小鼠精神状态、生理活动优于未给予加味生脉饮小鼠,这可能与加味生脉饮能够改善机体营养状况[21]有关。Lewis 肺癌小鼠至给药结束后,对照组肿瘤体积、质量与生脉饮组无显著性差异,说明单用加味生脉饮无法取得理想的抗癌疗效,而联合用药组肿瘤体积、质量显著低于顺铂组,说明顺铂与加味生脉饮联用可以增进疗效,肿瘤组织病理学结果也证明了这一点。肾脏病理学结果证明,顺铂治疗加用加味生脉饮可有效减少顺铂对肾脏组织的损害。以上结果说明,二者联用比单用顺铂有增效减毒的作用。
本研究结果显示,顺铂组肾脏组织中OCT2 高度表达,肿瘤组织中MRP2高度表达。药物进入机体需要跨膜转运,而大部分药物转运需要靠转运蛋白介导,肾脏作为主要的排泄与维持机体平衡的器官,具有多种药物转运体[22]。有机阳离子转运体(OCTs)是肾脏中最重要的药物转运体之一,物质将通过OCTs 进入肾脏组织。OCT2 是OCTs 体系在肾脏中最主要的转运体,主要位于肾脏近端小管处,多种药物主要通过OCT2 输入肾小管细胞[23]。顺铂主要通过OCT2 转运入肾脏,因此顺铂与肾脏的高亲和力可能与OCT2 通路高度相关,OCT2 的高表达使顺铂来不及排出,在肾脏内高度蓄积引起急性肾损伤[24]。既往研究[25]表明,当抑制OCT2 通路时,肾脏药物转运能力下降,顺铂的肾毒性降低。抑制肾脏组织中OCT2 通路,可降低顺铂的肾毒性,达到减毒的效果[26]。本研究中,联合组中OCT2 蛋白表达相比顺铂组被明显抑制,说明加味生脉饮可通过抑制OCT2 通路,降低肾脏对顺铂的摄取,从而减少顺铂对肾脏的损伤。此外,联用加味生脉饮后的小鼠血清BUN、Cr 浓度相比顺铂组明显降低,也证明加味生脉饮可保护肾脏功能。MRP2 属于ATP 结合盒转运蛋白,主要介导底物排出细胞。MRP2 在肿瘤组织中大量存在,可消耗ATP 水解的能量将进入肿瘤细胞的药物转运至体外,研究[27-28]表明,MRP2 底物主要为铂类、长春新碱类药物,可以促成肿瘤细胞对多种抗癌药物的耐药性。且抗癌药物的大剂量、长时间运用会诱导MRP2的高表达,造成药物生物利用度降低[29]。本研究结果显示,顺铂组MRP2 表达量相比对照组显著增加,说明给予顺铂治疗后,肿瘤细胞中MRP2 表达增加,耐药性提高。联合组MRP2表达量相比顺铂组明显降低,说明加味生脉饮也可抑制MRP2表达量,这可能是联合组抗肿瘤疗效更佳的原因。本研究中,联合组肿瘤组织中顺铂含量明显高于顺铂组,联合组肾脏组织中顺铂含量明显低于顺铂组,说明加味生脉饮可能通过选择性影响OCT2 和MRP2 通路,增加了肿瘤组织的顺铂浓度,减少了肾脏组织的顺铂浓度,从而达到减毒增效的作用。
综上所述,加味生脉饮与顺铂联用可改善肺癌治疗效果,OCT2/MRP2 信号通路在顺铂肾脏毒性与耐药性中起重要的调控作用,加味生脉饮可能抑制肾脏中OCT2 与肿瘤细胞中MRP2 的蛋白表达,从而降低顺铂治疗的肾脏毒性,提高顺铂的抗肿瘤效果。本研究为加味生脉饮临床辅助治疗肺癌提供了理论依据,但具体机制仍待进一步深入研究。
