宣肺开闭汤通过抑制TGF-β1/Smad3通路减缓小鼠肺纤维化进展
2023-11-28孔维祎郝欧美盛秋菊
孔维祎, 郝欧美, 盛秋菊
(1.辽宁中医药大学,辽宁沈阳 110032;2.辽宁中医药大学附属医院,辽宁沈阳 110032)
肺纤维化(pulmonary fibrosis,PF)是一种慢性间质性肺疾病,其主要特征为肺成纤维细胞异常增殖、细胞外基质(extracellular matrix,ECM)的过度积累及组织结构破坏等,最终导致肺瘢痕形成、肺功能不全和呼吸衰竭[1-2]。目前,临床常用治疗肺纤维化的药物以激素、免疫抑制剂及细胞毒性药物为主,但由于明显的毒副作用导致其治疗效果并不理想[3]。肺移植也是肺纤维化治疗的有效方法,但由于肺配体稀缺且移植费用高昂,使其在临床上的应用受到一定的限制。而中医药对防治肺纤维化具有一定的优势,且能有效改善患者生活质量[4]。中医学将肺纤维化归属于“肺痿”“肺痹”“肺胀”等范畴,认为其发病机制为气虚血瘀,痰热互结,痹阻肺络[5]。本课题组前期应用宣肺开闭汤治疗各种肺炎患者,发现其可明显延缓患者肺纤维化的发生,但其抗肺纤维化机制尚不明确。近年来,有大量相关研究证实,转化生长因子β1(TGF-β1)/Smads 信号通路与器官纤维化的发生密切相关,其中,TGF-β1 是导致纤维化的关键介质,可介导细胞的多种生物学活性,包括生长、分化、迁移、凋亡等,并能激活Smads信号通路,促进促纤维化因子的过度表达[6-7]。目前,关于调控TGF-β1/Samds 信号通路对肺纤维化的防治受到学者们的广泛关注。因此,本研究构建博来霉素诱导小鼠肺纤维化模型,观察宣肺开闭汤对肺纤维化小鼠TGF-β1/Samds 信号通路的影响,探讨宣肺开闭汤抗肺纤维化的作用机制,以期为临床应用宣肺开闭汤治疗肺纤维化提供基础数据,现将研究结果报道如下。
1 材料与方法
1. 1 实验动物60 只6 周龄雄性C57BL/6J 小鼠,体质量18 ~20 g,均购自长春亿斯实验动物技术有限公司,实验动物生产许可证号:SCXK(吉)2018-0007。实验单位为辽宁中医药大学,实验动物使用许可证号:SYXK(辽)2019-0004,饲养环境:20 ~25 ℃,相对湿度55%~65%,光照12 h/黑暗12 h 交替,普通饲料喂养,自由饮食摄水。动物实验方案已获得辽宁中医药大学动物伦理审批委员会审批通过,审批号:AEWC-211606。
1. 2 试剂与仪器博来霉素(天津太和制药有限公司生产,批号:国药准字H20055883);TGF-β1/Smads 通路激活剂SRI-011381 hydrochloride(北京百奥莱博科技有限公司,批号:53562ES08);小鼠抗TGF-β1 单克隆抗体、小鼠抗Smad3 抗体(美国Abcam 公司);羟脯氨酸(hydroxyproline,Hyp)含量测定试剂盒(南京建成悦浩科技有限公司);兔抗α-平滑肌肌动蛋白(α-SMA)抗体(美国Sigma公司)。T100 PCR 仪(伯乐生命医学产品有限公司);HBS-1101 酶标仪(南京德铁实验设备有限公司);CX41-12C02倒置显微镜(日本Olympus公司)。
1. 3 药物宣肺开闭汤由杏仁、桑白皮、鱼腥草、僵蚕、白花蛇舌草、芦根、太子参、贝母、麦冬、生石膏、沙参各10 g,桔梗、黄芩、枇杷叶、蝉衣、丹参各8 g 等组成,其组方中药材均购自北京同仁堂连锁药店有限公司。制备:先将以上中药材加水浸泡30 min,后加水稍没过中药为度,武火煎煮至沸腾,后转至文火维持60 min,倒出药液后同上述方法再次加水煎煮,将两次煎煮的药液混合并浓缩至不同生药含量,即2、4、8 g/mL,保存于-20 ℃冰箱待用。
1.4 分组、模型制备与给药将60只小鼠适应性喂养1周后,随机分为空白组,模型组,宣肺开闭汤低、中、高剂量组及宣肺开闭汤高剂量+SRI-011381 组,每组各10 只。除空白组外,其余各组小鼠均构建肺纤维化模型[8]。方法:应用2%戊巴比妥钠45 mg/kg腹腔注射麻醉满意后,固定小鼠于解剖台,颈部剃毛消毒,沿正中线切开并暴露气管,将5 mg/L 博来霉素生理盐水溶液经气管注入,剂量为0.3 mL,注入后翻转小鼠,使药物在肺部均匀分布。空白组小鼠仅注射等体积的生理盐水干预。后将各组小鼠分笼饲养。模型制备成功标准:小鼠活动力降低,且出现挠鼻、咳嗽等呼吸道症状。
造模成功后,根据文献研究[9],宣肺开闭汤低、中、高剂量组小鼠分别给予灌胃200、400、800 mg·kg-1·d-1的宣肺开闭汤;宣肺开闭汤高剂量+SRI-011381 组给予灌胃800 mg·kg-1·d-1的宣肺开闭汤后,腹腔注射TGF-β1/Smads 通路激活剂SRI-011381 hydrochloride10 mg·kg-1·d-1干预;空白组和模型组给予灌胃等积体的生理盐水。每日1 次,连续给药28 d。
1.5 观察指标与方法
1. 5. 1 HE 染色法观察肺组织病理变化及炎症评分 给药结束后,断头法处死各组小鼠,消毒开胸,取小鼠肺组织并固定于4%多聚甲醛溶液中,制作石蜡切片。常规脱蜡至水,将组织切片浸泡于去离子水中,加入苏木素染色1 min,冲洗干净后加入伊红染色,30 s后取出组织切片脱水透明,封片后置于显微镜下观察。参照Wzapiel 法[8]评估小鼠肺泡腔炎症程度,评分标准见表1。

表1 肺泡腔炎症程度评分标准Table 1 Scoring of the degree of alveolar inflammation
1.5.2 Masson 染色法观察肺组织纤维化及纤维化程度评估 将肺组织切片常规脱蜡至水,加入苏木素染色5 min,PBS 冲洗后加入Masson 蓝化液返蓝,3 min 后冲洗干净,再加入品红染液染色5 min,后用1%磷钼酸水溶液处理切片1 min。将切片浸于苯胺蓝夜或绿液复染2 min,0.2%冰醋酸处理1 min,90%乙醇脱水后透明,中性树胶封片,于显微镜下观察。参照Wzapiel 法[8]评估小鼠肺间质纤维化程度:无肺间质纤维化计为0分;轻度肺间质纤维化,病变面积小于20%时计为1 分;中度肺间质纤维化,病变面积为20%~50%时计为2 分;重度肺间质纤维化,病变面积大于50%时计为3分。
1. 5. 3 免疫组织化学法测定肺组织中α-SMA
表达 肺组织切片常规脱蜡至水,用抗原修复切片,后在切片中加入山羊血清封闭。加入一抗α-SMA 抗体(1∶400),再加入生物素化山羊抗兔IgG二抗(1∶1 000),DAB显色,苏木素复染,经脱水透明后封片。应用图像分析软件系统,每张切片随机选取染色区域6个高倍视野,测定其吸光度(OD)值。
1. 5. 4 ELISA 法测定肺组织Hyp 含量 取各组小鼠左肺下叶组织0.8 ~1 g,按照1∶9 的比例加入生理盐水进行匀浆,在4 ℃环境下,以离心机3 000 r/min(离心半径15 cm)离心10 min,收集上清液。采用Hyp ELISA 试剂盒测定肺组织均浆液中Hyp 的含量,应用酶标仪于550 nm 波长处测定OD值。
1.5.5 蛋白免疫印迹(Western Blot)法检测肺组织中TGF-β1、Smad3 蛋白表达 取小鼠肺组织,提取总蛋白,用二喹啉甲酸(BCA)法检测总蛋白浓度。将蛋白溶液的终浓度配制为2 μg/mL,置于热水中煮沸10 min后,保存在-20 ℃冰箱中。取30 μg的蛋白样品进行电泳(200 V 电压),转移蛋白样品至PVDF 膜上,用5%脱脂奶粉封闭PVDF 膜1 h,将一抗TGF-β1、Smad3(1∶1 000)加入到PVDF膜上,4 ℃孵育过夜,冲洗PVDF 膜后,加入二抗(1∶1 000),室温孵育2 h。洗膜后,加入ECL 液,曝光显影后用Image Lab 软件分析条带灰度值。以β-actin为内参。
1. 5. 6 实时定量聚合酶链反应(RT-PCR)法检测肺组织中TGF-β1、Smad3 mRNA 表达 取小鼠肺组织研磨,匀浆,加入TRIzol 裂解液裂解,提取总RNA,提取步骤按照试剂盒说明书进行。逆转录总RNA为cDNA,操作步骤按照试剂盒说明书操作。TGF-β1 引物序列,上游:5’-GTTCCTGCCA TTCTGGTGCA-3’,下游:5’-TGCGTGTCAGGGG TTGGTTAC-3’,扩增片段长度293 bp;Smad3 序列,上游:5’-CTACCGACTGCGAGGCATAA-3’,下游:5’-CGAGCCGATACATCGATCCT-3’,引物扩增片段长度530 bp;GAPDH(内参)引物序列,上游:5’-CAGATGCTCGCAAGGTAGGA-3’,下游:5’-ACAGAAGTAGTACGCAGACTG-3’,扩增片段长度469 bp。PCR 反应条件:95 ℃预变性2 min;95 ℃变性15 s,60 ℃退火1 min,共计40个循环。用2-△△CT法分析目的基因相对表达量。
1.6 统计方法采用Graphpad priam 8.0 软件进行统计学分析。计量资料以均数± 标准差(x±s)表示。多组间比较采用单因素方差(One-way ANOVA)分析,各组间两两比较采用LSD-,t检验,以,P<0.05表示差异有统计学意义。
2 结果
2. 1 各组小鼠肺组织病理学变化及炎症评分比较图1 结果显示:空白组小鼠肺组织结构正常,无间隔水肿,肺泡可见少量的炎性细胞浸润,肺泡腔炎症评分显著高于空白组(P<0.05);模型组小鼠肺泡间隔增厚,肺泡结构破坏连成大片状实变,实变区内可见大量的炎性细胞浸润,肺泡腔炎症评分显著高于空白组(P<0.05);宣肺开闭汤低、中、高剂量组小鼠肺组织结构较模型组明显改善,肺泡间隔增厚程度明显减轻,炎性细胞浸润也明显减少,肺泡腔炎症评分显著低于模型组(P<0.05),且各剂量组作用效果呈剂量依赖性;宣肺开闭汤高剂量+SRI-011381组小鼠肺组织病理学表现与模型组相似,肺泡腔炎症评分较宣肺开闭汤高剂量组明显增加(P<0.05)。
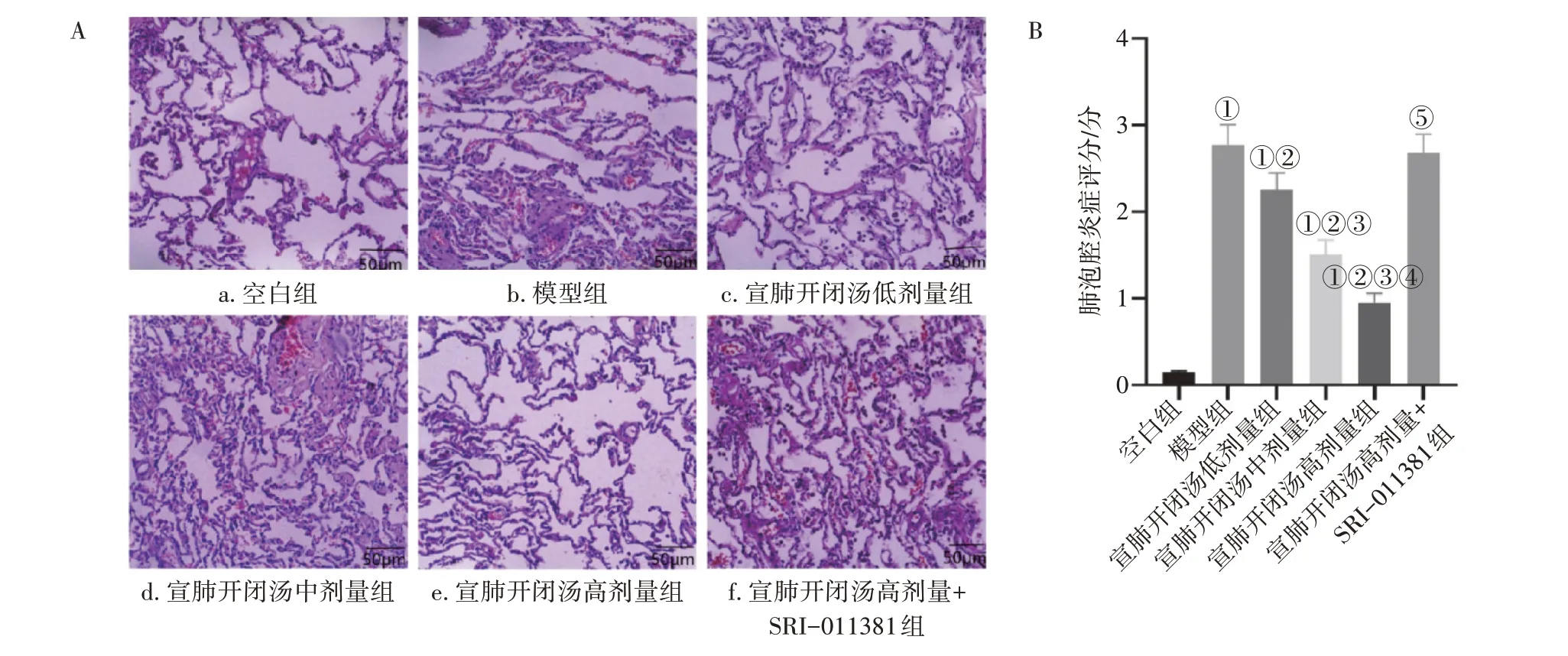
图1 各组小鼠肺组织病理学变化及炎症评分比较Figure 1 Comparison of lung tissue pathological changes and inflammation scores among each group of mice
2.2 各组小鼠肺组织纤维化情况及评分比较图2结果显示:空白组可见极少量的蓝色胶原纤维沉积于肺泡间隔及肺血管壁;模型组可见典型的肺间质纤维化变化,肺泡间隔及肺血管壁可见片状或束状胶原纤维沉积,大量蓝染胶原沉积于肺腔内,肺纤维化程度评分显著高于空白组(P<0.05);宣肺开闭汤低、中、高剂量组蓝色纤维主要表达于支气管壁、肺血管壁的肌层下,肺纤维化程度评分显著低于模型组(P<0.05),且呈剂量依赖性;与宣肺开闭汤高剂量组比较,宣肺开闭汤高剂量+SRI-011381组肺纤维化程度评分显著升高(P<0.05),肺组织纤维化程度与模型组相似。
图2 各组小鼠肺组织纤维化情况及评分比较Figure 2 Comparison of lung tissue fibrosis and scores among each group of mice
2. 3 各组小鼠肺组织中α-SMA 表达比较图3结果显示:与空白组比较,模型组小鼠肺组织中可见大量的α-SMA 棕黄色阳性染色细胞聚集成团,α-SMA OD 值升高(P<0.05);与模型组比较,宣肺开闭汤低、中、高剂量组阳性染色细胞数量减少,α-SMA OD 值降低(P<0.05),且呈剂量依赖性;与宣肺开闭汤高剂量组比较,宣肺开闭汤高剂量+SRI-011381 组小鼠肺组织中可见α-SMA 棕黄色阳性染色细胞数量明显增加,α-SMA OD值升高(P<0.05)。
2. 4 各组小鼠肺组织中Hyp 含量比较图4 结果显示:与空白组比较,模型组小鼠肺组织中Hyp含量显著升高(P<0.05);与模型组比较,宣肺开闭汤低、中、高剂量组小鼠肺组织中Hyp 含量均显著降低(P<0.05),且呈剂量依赖性;与宣肺开闭汤高剂量组比较,宣肺开闭汤高剂量+SRI-011381 组小鼠肺组织中Hyp 含量显著增加(P<0.05)。
2.5 各组小鼠肺组织中TGF-β1、Smad3的蛋白表达比较图5结果显示:模型组小鼠肺组织中TGF-β1、Smad3 的蛋白表达水平均高于空白组(P<0.05);宣肺开闭汤低、中、高剂量组小鼠肺组织TGF-β1、Smad3 的蛋白表达水平均低于模型组(P<0.05);与宣肺开闭汤高剂量组比较,宣肺开闭汤高剂量+SRI-011381 组小鼠肺组中TGF-β1、Smad3 的蛋白表达水平均明显升高(P<0.05)。
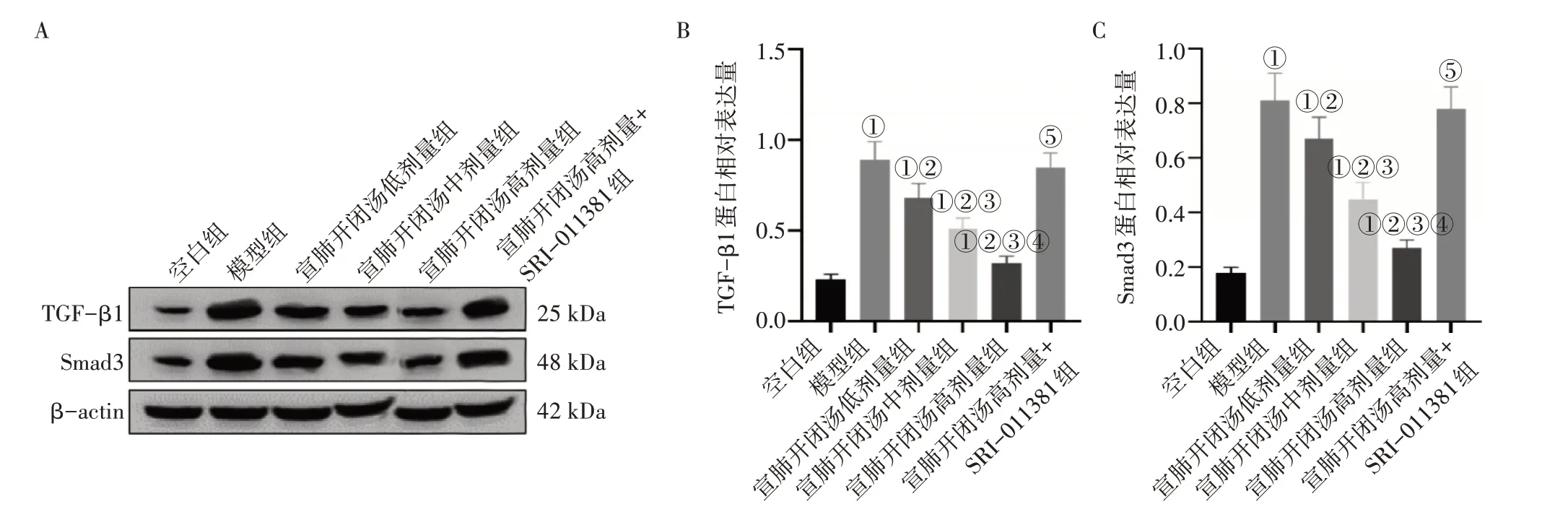
图5 各组小鼠肺组织中TGF-β1、Smad3的蛋白表达比较Figure 5 Comparison of protein expressions of TGF-β1 and Smad3 in lung tissue among each group of mice
2.6 各组小鼠肺组织中TGF-β1、Smad3 的mRNA
表达比较图6结果显示:与空白组比较,模型组小鼠肺组织中TGF-β1、Smad3 的mRNA 表达水平均显著升高(P<0.05);宣肺开闭汤低、中、高剂量组小鼠肺组织TGF-β1、Smad3 的mRNA 表达水平均明显低于模型组(P<0.05),且呈剂量依赖性;与宣肺开闭汤高剂量组比较,宣肺开闭汤高剂量+SRI-011381 组小鼠肺组中TGF-β1、Smad3的mRNA表达水平均显著升高(P<0.05)。
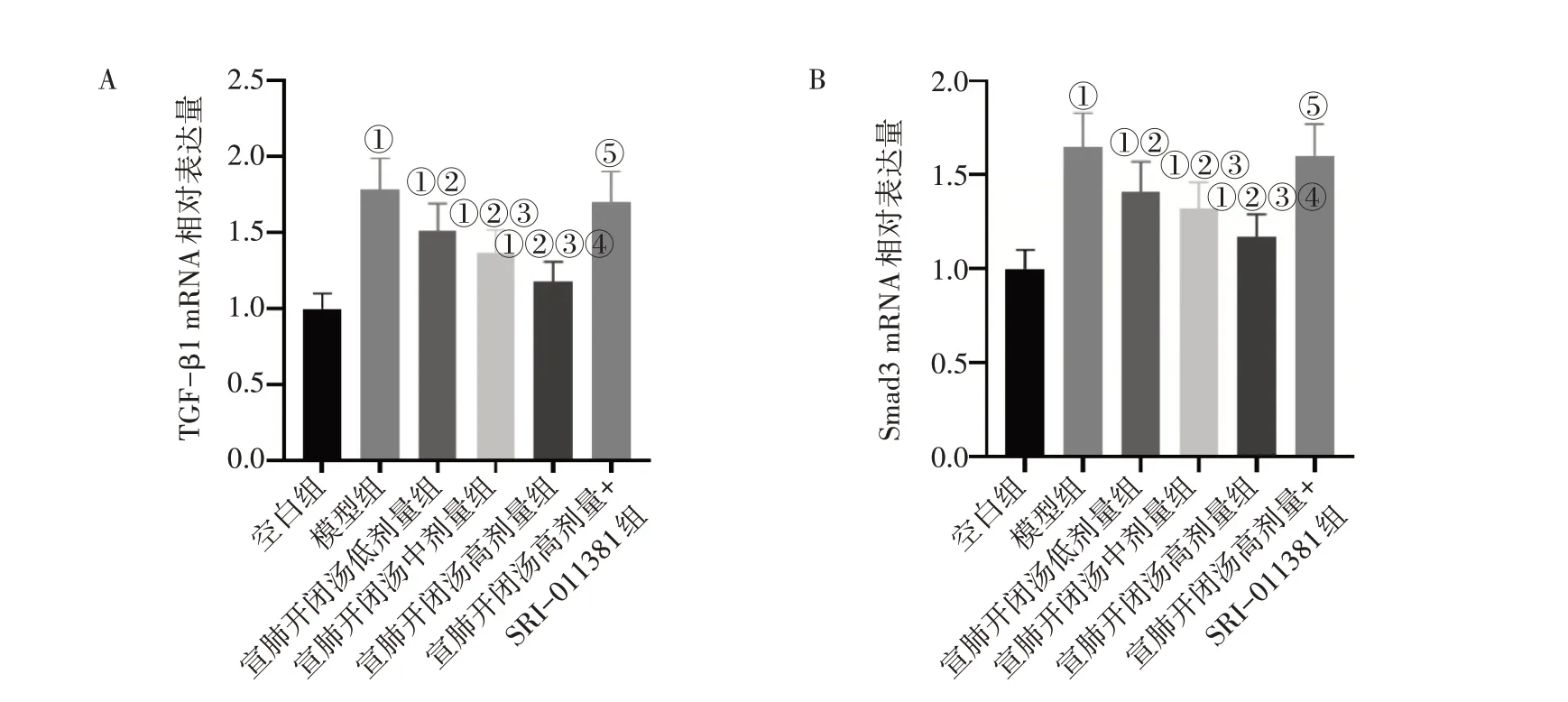
图6 各组小鼠肺组织中TGF-β1、Smad3的mRNA表达比较Figure 6 Comparison of mRNA expressions of TGF-β1 and Smad3 in lung tissue among each group of mice
3 讨论
近年来,肺纤维化的发病率和死亡率呈逐年上升的趋势,且新冠肺炎重症患者以肺纤维化为主要特征,由于肺纤维化不易逆转,对患者的生命造成了严重的威胁,因此,寻找和开发治疗肺纤维化新的有效药物尤为重要[10]。肺纤维化临床证候错综复杂,患者在临床上通常表现为呼吸潜短且不相顺接,随着肺纤维化程度的加重,患者逐渐会出现瘀血阻滞、肺络不通的表现[11]。本研究应用的宣肺开闭汤中:杏仁、桑白皮、贝母、枇杷叶,清热润肺,化痰止咳;太子参、麦冬、沙参、芦根益气健脾生津,加强润肺功效;鱼腥草、白花蛇舌草、黄芩、生石膏,清热解毒,加强退热功能;蝉衣、僵蚕为虫药,疏风止咳、祛风通络;桔梗,宣肺,利咽,祛痰,排脓;丹参,活血化瘀,凉血消痈。全方共奏宣肺开闭、清肺通络功效,符合肺纤维化中医病机特点。
本研究采用气管灌注博来霉素诱导小鼠肺纤维化模型,结果发现,肺纤维化模型组小鼠肺组织出现明显的肺泡炎症及纤维化等改变。羟脯氨酸(Hyp)是机体胶原纤维特有的氨基酸之一,其在肺组织中的含量可评定肺间质纤维化程度,目前已被临床广泛应用[12]。本研究通过检测肺组织匀浆中Hyp 含量发现,模型组小鼠Hyp 含量明显增加。给予不同剂量的宣肺开闭汤后发现,Hyp含量明显降低,肺组织纤维化、炎症程度明显减轻,且随着宣肺开闭汤剂量的增加效果更显著,表明宣肺开闭汤可有效改善小鼠肺纤维化。
成纤维细胞灶主要由肌成纤维细胞(MFb)构成,是继发性肺纤维化的主要病理学特征之一[13]。MFb 是造成细胞外基质(ECM)异常沉积的主要效应细胞[14]。研究[15]表明,MFb 可抑制成纤维细胞的增殖和分化,进而对肺纤维化程度发挥减缓作用。α-SMA 是成纤维细胞向MFb 转化的标志性蛋白,其蛋白表达水平可间接反映MFb 的增殖情况[16]。本研究结果显示,模型组小鼠肺组织中α-SMA表达明显升高,不同剂量的宣肺开闭汤干预后,小鼠肺组织中α-SMA 表达明显降低,提示宣肺开闭汤可阻止肺组织中α-SMA 表达,进而通过抑制MFb的增殖来抑制肺纤维化的发展。
有研究[17]表明,TGF-β可调控肺成纤维细胞中α-SMA 的表达。TGF-β1作为一种致纤维化因子可介导肺纤维化的发生,其是通过诱导ECM 过度沉积,并对成纤维细胞过度增殖和分化起促进作用所致[18]。Smad蛋白是TGF-β1诱导纤维化作用的关键效应分子之一,当TGF-β1结合其受体后,磷酸化Smad2、Smad3、Smad4 后,形成复合物转移到细胞核,进而启动TGF-β1靶基因的转录。侯欢等[19]研究发现,Smad3 抑制剂可通过抑制Smad3 的磷酸化减少TGF-β1处理的人真皮成纤维细胞的肌成纤维细胞分化和胶原合成;还有研究[20]发现,TGF-β1/Smad3 信号通路可介导纤维化、凋亡和炎症反应,抑制纤维化疾病中TGF-β1/Smad3 信号通路的活性,对治疗疾病有重要作用。本研究结果显示,模型组小鼠肺组织中TGF-β1、Smad3 的蛋白及mRNA 表达明显升高,宣肺开闭汤干预后,各剂量组小鼠肺组织中TGF-β1、Smad3 的蛋白及mRNA表达均明显降低,提示宣肺开闭汤可能通过抑制TGF-β1/Smad3 信号通路抑制小鼠肺纤维化进程。为了验证该结果,本研究采用TGF-β1/Smad3信号通路激活剂SRI-011381 hydrochloride 和高剂量的宣肺开闭汤联合干预肺纤维化小鼠,结果显示SRI-011381 hydrochloride 能减弱宣肺开闭汤对小鼠肺纤维化进程的抑制作用。
综上所述,宣肺开闭汤可抑制博来霉素诱导小鼠肺纤维化的进程,其作用机制与抑制TGF-β1/Smad3信号通路有关。
