篮状菌属糙刺孢篮状菌组的两个中国新记录种
2023-11-27王龙
王 龙
(中国科学院 微生物研究所真菌学国家重点实验室,北京100101)
1 引言
篮状菌属(TalaromycesC.R. Benj.)真菌广泛分布于陆地、水体(淡水和海水)、空气等环境,是自然界物质循环中的重要分解者。篮状菌的无性阶段一般形成对称双轮生帚状枝(symmetrical biverticillate penicillus)的产分生孢子结构,即在分生孢子梗茎(孢梗茎)顶端产生簇生的、大小相近的梗基(metula),在梗基顶端产生簇生的、大小相近的披针形瓶梗(phialide),梗基和瓶梗均呈轴对称排列,在瓶梗顶端产生向基性生的链状排列的分生孢子。若产生有性繁殖结构,则会形成裸囊壳(gymnothecium)型子囊果,内含无规则排列的球形至椭球形子囊,子囊壁较薄,易消解,每个子囊内含8个子囊孢子,子囊孢子通常呈椭球形,壁通常粗糙[1, 2]。
目前,基于3个蛋白质基因序列,即β-tubulin gene(BenA)、calmodulin gene(CaM)、DNA-dependent RNA polymerase II second largest subunit gene(Rpb2)和rDNA ITS1-5.8S-ITS2(ITS)序列的分析,篮状菌属被划分为8个组(section),即杆孢篮状菌组(sect.BacillisporiYilmaz, Frisvad &Samson、sect.HeliciYilmaz, Frisvad &Samson)、岛篮状菌组(sect.Islandici(Pitt) Yilmaz, Frisvad &Samson)、紫篮状菌组(sectPurpureiStolk &Samson)、近膨篮状菌组(sect.SubinflatiYilmaz, Frisvad &Samson)、篮状菌组(sect.Talaromyces)、糙刺孢篮状菌组(sect.TrachypermiYaguchi &Udagawa)和细梗篮状菌组(sect.TenuesB.D. Sun, A.J. Chen, Houbraken &Samson),篮状菌属目前已报道约200种[2-8]。
糙刺孢篮状菌组是篮状菌属中已发现物种较多的组,该组全球已报道36种,我国仅发现12个种[4-7, 9-12]。该组物种通常生长局限,一般形成双轮生和/或三轮生帚状枝的无性产孢结构,少数还兼有单轮生帚状枝,有些种会产生白色或黄白色裸囊壳型的有性繁殖结构。少数种产生嗜氮酮类色素(azaphilones),呈红色可溶性色素扩散到培养基中,或只存在于菌丝内而不扩散的培养基中,使得菌落背面呈红色,如白双轮篮状菌(T.albobiverticillius(H.M. Hsieh, Y.M. Ju &S.Y. Hsieh) Samson, N. Yilmaz, Frisvad &Seifert),暗玫瑰篮状菌(T.atroroseusN. Yilmaz, Frisvad, Houbraken &Samson),红色素篮状菌(T.rubrifaciensW.W. Gao)等。该类色素结构类似于橙色或红色红曲色素(orange or redMonascuspigments),如丝红素(mitorubrin)、暗玫瑰素(atrorosin),而且上述这三个种均不产真菌毒素,因此它们具有用于开发食用色素的潜力[13, 14]。
本文报道该组的我国两个新记录种,即热微黄篮状菌(T.calidominioluteusHoubraken &Pyrri)和卡迪斯篮状菌〔T.gaditanus(C. Ramírez and A.T. Martínez) Houbraken and Soccio〕,其中卡迪斯篮状菌产生红色可溶性色素。
2 材料与方法
2.1 菌株分离
土壤样品中真菌的分离采用倍比稀释涂布平皿法[15, 16],即将样品碾碎混匀,取约1 g样品放入装有9 mL灭菌的0.1%琼脂水溶液的大试管中,摇匀成悬浊液,作为第一稀释度,然后取该稀释度的悬浊液1 mL倒入第二个同样的大试管中摇匀,作为第二稀释度,依此类推直到第五个稀释度,取最后两个连续的稀释度的悬浊液约1 mL倾倒于氯硝胺虎红氯霉素琼脂培养基(Dichloran rose bengal chloramphenicol agar,DRBC)上,用无菌涂布棒均匀涂布,于25 ℃倒置培养,等菌长出后挑取单菌落获得纯培养菌株。本研究的菌株保存在中国普通微生物菌种保藏管理中心 (AS3.8022、CGMCC 3.15382和AS3.16376)。
2.2 传统分类学研究
菌株的鉴定培养使用查氏酵母精琼脂(Czapek yeast autolysate agar, CYA)培养基在25 ℃和37 ℃培养7天和麦芽精琼脂(5% malt extract agar, MEA)培养基在25 ℃培养7天,然后进行菌落形态的观测和描述,分生孢子、菌丝体、渗出液和可溶性色素及菌落背面的颜色命名参考Ridgway的命名法,产孢结构的普通光学显微镜观测挑取在MEA上25 ℃培养7天的菌体材料进行[2, 17]。
2.3 基因扩增及测序
采用植物基因组DNA提取试剂盒(通用型TSP101-200,擎科生物技术有限公司)提取真菌基因组DNA。上述四个遗传标记的PCR扩增方法参考王龙等[18],其中扩增BenA的引物参考Glass and Donaldson[19],CaM的引物参考Wang[20],Rpb2的引物参考Jiang et al.[21],ITS的引物参考White et al.[22]。扩增产物经2%的琼脂糖凝胶电泳后纯化,然后交给擎科生物技术有限公司进行双向测序。
2.4 分子系统学分析
测序得到序列使用Bioedit 7.0.9[23]进行人工校对并删除引物序列,然后提交到GenBank(热微黄篮状菌AS3.8022:BenA= OQ992535,CaM= OQ992536,Rpb2 = OQ992537,ITS = OQ981605;CGMCC 3.15382:BenA= ON569410,CaM= OQ626763,Rpb2 = OQ626765,ITS = OQ608443;卡迪斯篮状菌AS3.16376(DJ6-12):BenA= ON569411,CaM= OQ626764,Rpb2 = ON569397,ITS = OQ608444)。选择糙刺孢篮状菌组中34个种的模式菌株和本研究的三个菌株的上述四个基因序列组合进行分子系统发育学分析,以紫篮状菌组的褐孢篮状菌(T.brunneosporusRodr.-Andr., Cano &Stchigel)作为外群。这些菌株的BenA-CaM-Rpb2-ITS组合序列矩阵包括空格(gap)共1889个位点(site)。系统发育学分析采用最大似然法(Maximum Likelihood, ML),分析软件使用MEGA6[24],最适碱基替代模型(substitution model)和位点演化速率(rates among sites)设为“K2+GI”,系统树中各演化支的可靠性采用自展法(bootstrap)1 000次重复进行评估(图 1),序列矩阵中的空格“gaps”的处理选择“partial deletion”[25]。
3 结果与分析
3.1 分子系统学分析结果
根据三个蛋白质基因和ITS组合序列矩阵的分子系统学分析结果显示我国菌株AS3.8022和CGMCC 3.15382与热微黄篮状菌的模式菌株CBS 147313 聚在一个分支,AS3.16376与卡迪斯篮状菌的模式菌株CBS 169.81聚在一起,bootstrap支持率均分别为100%和99%。通过上述传统分类学和DNA序列系统发育学分析方法对这两株菌进行了准确鉴定,参考我国已发表的篮状菌物种,确定热微篮状菌和卡迪斯篮状菌为我国新记录种(图1~3)。
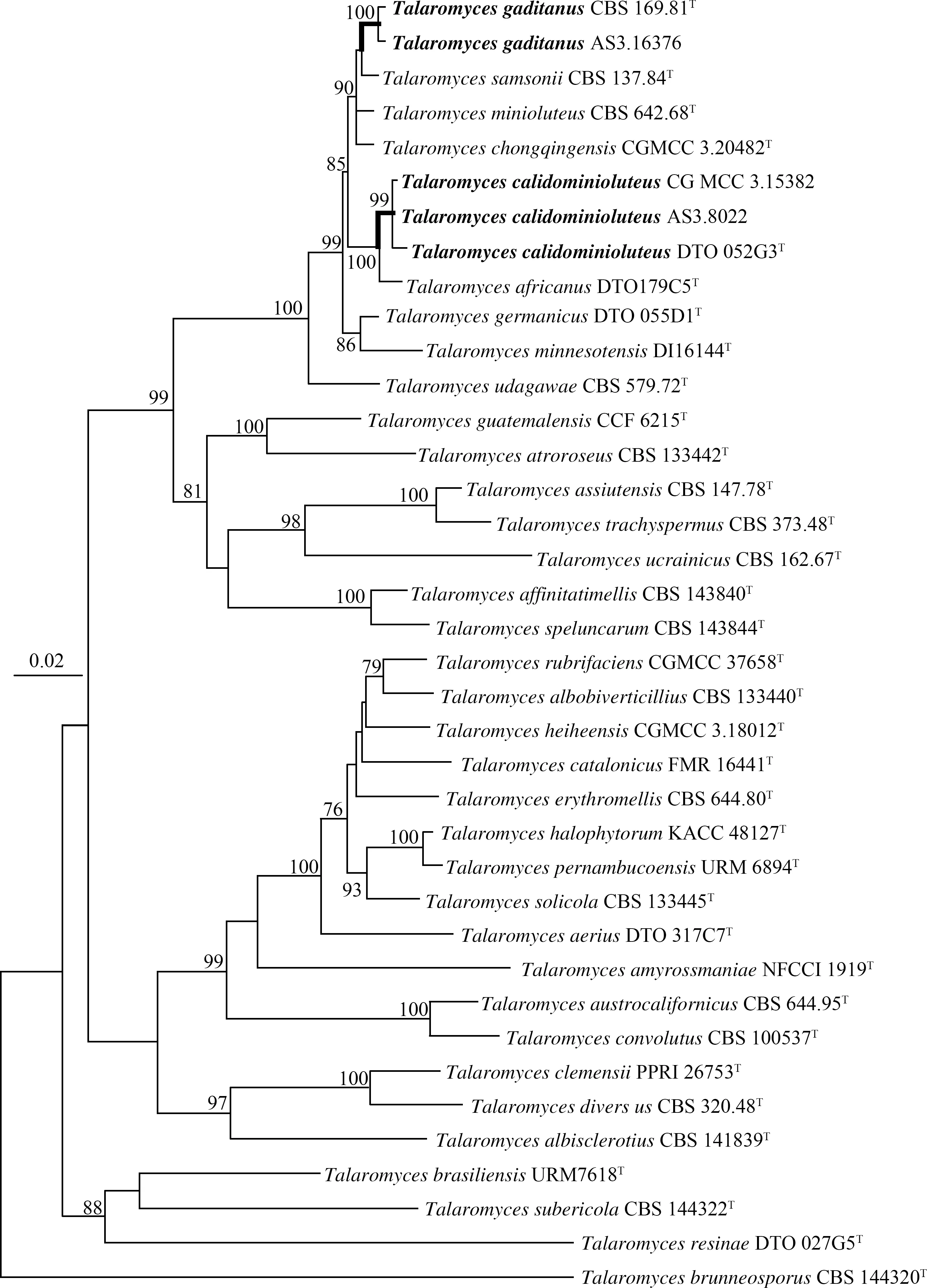
注:自展法(bootstrap)评估值≥70%的分支标记在分支节点处,T 表示模式菌株,粗体表示新记录种。—:标尺为 0.02每核苷酸替代率。
3.2 新记录种描述
热微黄篮状菌,如图2。

注:(a,b)在CYA和MEA上25 ℃培养7天的菌落;(c~e)分生孢子梗;(f)分生孢子;标尺为10 μm。
TalaromycescalidominioluteusHoubraken &Pyrri, J. Fungi 7: 993, 2021[5]。
在查氏酵母膏琼脂(CYA)上25 ℃培养7天,形成直径16~20 mm的菌落,稍厚,菌落表面平坦或稍带沟纹,中央凸起,菌落边缘整齐;呈绒状菌落质地;产大量分生孢子,颜色呈深灰绿色,近于安多佛绿色至艾绿色Andover Green to Artemisia Green(R. Pl. XLVII);菌丝体呈白色至硫磺黄色Sulphur Yellow(R. Pl. V);不产或产微量无色渗出液;产适量可溶性色素,黄褐色至橙皮黄色Orange Buff(R. Pl. III);菌落背面橙赤褐色至煅赭褐色Orange Rufous to Burnt Sienna(R. Pl. II)。
在麦芽精琼脂(MEA)上25 ℃培养7天,形成直径13~23 mm的菌落,稍厚,菌落表面平坦,边缘整齐;呈绒状菌落质地;产大量分生孢子,颜色呈安多佛绿色至艾绿色Andover Green to Artemisia Green(R. Pl. XLVII);菌丝体呈白色至硫磺黄色Sulphur Yellow(R. Pl. V);不产渗出液及可溶性色素;菌落背面呈旱金莲皮黄色Capucine Buff(R. Pl. III)。在CYA上37 ℃培养7天,未萌发。
从表面菌丝产生分生孢子梗,分生孢子梗茎100~200 μm × 2.5~3.5 μm,壁光滑;帚状枝双轮生,排列较紧密,偶见1~2个副枝;梗基每轮3~10个,10~16 μm × 2.5~3.5 μm;瓶梗披针形,每轮3~8个,10~13 μm × 2~3 μm;分生孢子呈椭球形至柠檬形,3~4 μm × 2~2.5 μm,壁光滑。
分布和基物:安徽黄山土壤(AS3.8022);新疆阜康梧桐沟土壤(CGMCC3.15382)。
卡迪斯篮状菌,如图3。

注:(a,b)在CYA和MEA上25 ℃ 培养7天的菌落;(c~e) 分生孢子梗;(f) 分生孢子,标尺为10 μm。
Talaromycesgaditanus(C. Ramírez and A.T. Martínez) Houbraken and Soccio, J. Fungi 7: 993, 2021[5]。
在查氏酵母膏琼脂(CYA)上25 ℃培养7天,形成直径11~12 mm的菌落,较薄,菌落表面不平坦,边缘整齐;呈绒状菌落质地;产稀疏分生孢子,颜色呈玉石绿色Jade Green(R. Pl. XXXI);菌丝体呈白色夹杂淡红色;不产渗出液;产生适量可溶性色素,呈猩红色Scarlet(R. Pl. I);菌落背面呈牛血红色Ox-blood Red(R. Pl. I)。
在麦芽精琼脂(MEA)上25 ℃培养7天,形成直径22~23 mm的菌落,较厚,表面具较多辐射状皱纹,边缘呈流苏状;呈短絮状菌落质地;分生孢子无或稀疏,分布于中央,颜色呈玉石绿色Jade Green(R. Pl. XXXI);产绿黄色菌丝体Green-Yellow(R. Pl. V);不产渗出液及可溶性色素;菌落背面呈生赤者褐色Raw Sienna (R. Pl. III)。
在CYA上37 ℃培养7天,未萌发。
从表面菌丝产生分生孢子梗,分生孢子梗茎100~200 μm × 2.5~3.5 μm,壁光滑;产生双轮生帚状枝的产孢结构;梗基每轮4~8个,排列紧密,10~13 μm × 2.5~3.5 μm;瓶梗呈披针形,每轮4~8个,排列紧密,9~13 μm × 2~3 μm;产生柠檬形分生孢子,2.5~4 μm × 2~3 μm,壁光滑。
分布和基物:西藏日喀则定结县土壤(DJ6-12=AS3.163 76)。
4 讨论
本文报道的这两个新记录种属于微黄篮状菌群(T.minioluteusspecies group),该群目前包括8个种,即非洲篮状菌(T.africanusHoubraken, Pyrri &Visagie)、热微黄篮状菌、重庆篮状菌(T.chongqingensisX.C. Wang &W.Y. Zhuang)、卡迪斯篮状菌、日耳曼篮状菌(T.germanicusHoubraken &Pyrri)、微黄篮状菌(T.minioluteus(Dierckx) Samson, N. Yilmaz, Frisvad &Seifert)、明尼苏达篮状菌(T.minnesotensisGuevara-Suarez, Cano &Dania García)和萨姆森篮状菌(T.samsonii(Quintan.) Houbraken &Pyrri)。热微黄篮状菌在形态学和系统发育学上均与非洲篮状菌关系最近,卡迪斯篮状菌在系统发育学上与重庆篮状菌、微黄篮状菌、萨姆森篮状菌关系较近[5],我们的研究也显示同样的结果(图 1)。
热微黄篮状菌此前只发现于荷兰、伊朗、泰国和尼日利亚,GenBank目前只有11个菌株的序列[5]。在菌落特征上,我国的两个菌株AS3.8022和CGMCC 3.15382在CYA上25 ℃时比模式菌株CBS 147313(DTO 052-G3)生长慢(16~20 mm vs. 20~30 mm),在MEA上,模式菌株产生橙褐色(orange-brown)渗出液,而我国菌株不产渗出液。其它菌落特征,如菌落质地、分生孢子产量和颜色以及菌丝体颜色均与模式菌株类似。在显微特征上,我国菌株与模式菌株在帚状枝及各其个部分的形态和维度与模式菌株几乎没有差别。我国这两个菌株四个遗传标记序列完全相同,它们与模式菌株的BenA序列无差别(ON569410和OQ992535 vs. OK338786),CaM序列有7个碱基差别(OQ626763和OQ992536 vs. OK338817),Rpb2序列只差2个碱基(OQ626765和OQ992537 vs. OK338837),ITS序列只有1个碱基的差异(OQ608443和OQ981605 vs. OK339612)。基于BenA-CaM-Rpb2-ITS组合序列的发育树显示这两个菌株与模式菌株同在一个分支且bootstrap支持率为99%(图 1)。
卡迪斯篮状菌此前只发现于西班牙、荷兰、丹麦和美国,GenBank目前只有7个菌株的序列[5]。我国菌株AS3.16376与模式菌株CBS 169.81(DTO 228-B8)在CYA菌落形态上差别较大,我国菌株生长局限,产稀疏的分生孢子,菌丝体白色夹杂淡红色,产较多红色可溶性色素,菌落背面呈牛血红色;而模式菌株则生长适度,产较多分生孢子,菌丝体呈浅黄色,不产可溶性色素,菌落背面呈褐色[5]。这可能由于不同菌株利用硝态氮的能力不同,而且不同氮源对真菌生长和次级代谢具有很大影响[26]。但它们在MEA上的菌落特征非常相近,均形成絮状绿黄色菌丝体和稀疏的分生孢子,不产渗出液和可溶性色素,背面呈褐色。我国菌株与模式菌株的显微结构各部分的形态和尺度几乎无差别。它们的BenA序列只有2个碱基差异(ON569411 vs. OK338775),CaM序列有5个碱基差别(OQ626764 vs.OK338802),Rpb2序列有5个碱基的差异(ON569397 vs.OK338827),ITS序列只有1个碱基差别(OQ608444 vs.MH861318)。根据BenA-CaM-Rpb2-ITS组合序列的发育树显示AS3.16376与模式菌株同在一个分支且bootstrap支持率为100%(图1)。
目前人类食用色素主要来源于植物、动物材料的提取物,如花青素、类胡萝卜素、甜菜苷、姜黄素和胭脂红酸等。这些色素原料的种植和养殖消耗大量自然资源、人力和能源,并产生大量废弃物和二氧化碳,若采用微生物发酵的方法生产则会大幅降低成本并减少废弃物和二氧化碳排放,如工业上用三孢布拉霉(BlakesleatrisporaThaxt.)生产β-胡萝卜素,红发夫酵母(PhaffiarhodozymaM.W. Mill., Yoney. &Soneda)生产虾青素,紫色红曲和红色红曲(MonascuspurpureusWent和M.ruberTiegh.)生产红曲色素等[27]。红曲色素属于嗜氮酮类色素,该类色素是一类非常具有开发前景的天然色素。除了红曲属(MonascusTiegh.)外,已报道还有8属真菌可以产生嗜氮酮类色素,其中篮状菌属和青霉属(PenicilliumLink)是产生嗜氮酮类色素最具潜力的两个属[28]。已有报道,利用暗玫瑰篮状菌发酵生产一种嗜氮酮类色素,即暗玫瑰素S(atrorosin S),产量可达0.9 g/L,而且成本低、纯度高、无任何真菌毒素[29, 30]。除了本文提到的这四个产色素的物种外,篮状菌至少还有21个种产生嗜氮酮类色素[31]。我国幅员辽阔,气候类型复杂多变,自然环境多种多样,随着研究技术的进步,如传统分类学技术结合环境基因组学(environmental metagenomics),将会有更多的篮状菌新种和新记录种被发现,为真菌资源的研究、开发提供物质基础。
