输卵管特异性表达艾塞那肽的转基因鸡制备
2023-11-27张自富秦清明麻冰洁陈思睿赵云焕
张自富,胡 静,赵 瑜,秦清明,麻冰洁,赵 聘,陈思睿,赵云焕
(1.信阳农林学院 动物科技学院,河南 信阳 464000; 2.中国农业大学 动物科技学院 畜禽育种国家工程实验室,北京 100193)
近年来制备转基因动物作为生物反应器生产药物蛋白已经取得了许多突破性进展,开创出了诱人、广阔的应用前景[1-2]。从发展趋势来看,在不久的将来必定会成为生物工程技术研究领域最活跃、最具有实践应用价值的技术。最初,哺乳动物的乳腺反应器被认为是一个最有希望和前途的生物反应器之一,可是家畜世代间隔长、成本高,特别是乳汁中乳蛋白和乳脂肪的生化复杂性给重组蛋白的纯化带来许多意想不到的困难[3-4]。与哺乳动物相比,禽类具有体格小、成本低、世代周期短、繁殖力高、卵中天然存在蛋白酶抑制剂、良好的无菌环境、好储存、易提纯等优点,特别是卵中表达的重组蛋白形成的三维结构糖基化更接近于人类蛋白质[5]。所以,禽类输卵管生物反应器将逐步成为转基因动物和生物制药研究领域中最具活力的热点,并很可能成为未来最具有竞争力的新兴高技术产业之一。
但是,由于禽类独特的生殖、生理特点和胚胎发育的复杂性,致使在哺乳动物中已经广泛应用的转基因技术并不适用于禽类[6]。到目前为止,研究报道较多的是利用逆转录病毒载体法制备出了转基因鸡,尤其是属于逆转录病毒科中的慢病毒,具有容纳外源目的基因片段大、可感染非分裂期细胞、整合到细胞染色体上并能长期稳定表达、不易发生基因沉默、免疫反应弱、安全性高等优点,已逐渐成为转基因研究中应用广泛的载体工具之一,也被公认为制备转基因禽类最有效和最成功的方法之一[7-9]。近年来,已有利用转基因鸡输卵管生物反应器生产重组蛋白的研究报道,包括β-内酰胺酶[10]、人干扰素α-2b[11]、人单克隆抗体[12]、单链Fv-Fc融合蛋白[13]、治疗性蛋白[14]、人溶菌酶[15]、人防御素4[16]等。但是,以上报道均是将慢病毒注射到发育第Ⅹ期的胚盘下腔,先生产出性系嵌合体,再生产出转基因个体。制备转基因家禽的整个技术流程繁杂,要求条件很高[17]。另外,也有报道通过分离早期鸡胚血液或性腺中的原始生殖细胞(primordial germ cells,PGCs)生产转基因鸡,但是PGCs的分离、培养、传代等关键技术还一直未能获得完全突破[18-20]。
艾塞那肽(exenatide)是从墨西哥巨蜥蜴毒液中分离出来的一种含有39个氨基酸的多肽序列,相对分子质量4.186 kDa,分子式:C184H282N50O60S,等电点pH4.86。与胰高血糖素样肽(glucagon-like peptide1,GLP-1)具有53%的同源性,与GLP-1同作用于G-蛋白偶联受体,并具有更高的亲和力[21]。艾塞那肽是首个获准上市的肠促胰岛素类似物抗糖尿病药物,也是目前为止公认最好的治疗型糖尿病的首选药物。在治疗Ⅱ型糖尿病方面,具有可促进胰岛素分泌,保护β细胞功能,改善外周胰岛素敏感性,减轻体重,保护肝脏功能,半衰期长的优点[22]。2012年美国食品药品监督管理局(FDA)批准上市,商品名为百泌达(Byetta)。
本试验构建了一个鸡卵清蛋白基因特异性启动子调控表达艾塞那肽的慢病毒表达载体,包装出高滴度的慢病毒,利用实验室早期建立的生产转基因鸡新技术平台——血管显微注射法[23],简便、高效的生产出输卵管特异性表达艾塞那肽的转基因鸡。该新型技术平台的成功建立,为利用鸡输卵管生物反应器天然、高效合成并分泌蛋白的能力,在鸡蛋中生产一些具有重要价值的药用蛋白,具有广阔的应用前景和经济发展潜力。
1 材料与方法
1.1 材料三质粒慢病毒表达载体系统pCSⅡ-EF-MCS-IRES2-Venus、pCAG-HIVgp和pVSV-G-Rsv-Rev为本实验室所有;人胚肾293T细胞,快速型人胚肾293T细胞,Ultra Rapid Lentiviral Titer Kit 购自Invitrogen公司;血液及精液基因组提取试剂盒、RNase A酶购自天根生物科技有限公司,DIG High Prime DNA Labeling and Detection Starter KitⅡ购自罗氏公司;PCR引物合成上海英骏生物技术有限公司,限制性内切酶EcoRⅠ、PstⅠ和HindⅢ购自NEB公司。实验仪器设备均为信阳农林学院中心实验室所有。
1.2 载体构建参照GenBank中墨西哥巨蜥蜴艾塞那肽基因的cDNA序列,进行密码子优化后化学合成cDNA(117 bp)序列,连接入T载体;在白来航鸡的基因组中,分别扩增雌激素反应元件(ERE,675 bp)和卵清蛋白基因(ovalbumin gene,OVA,ID:396058)启动子序列(包括启动子序列、第一外显子序列、第一内含子序列和第二外显子一部分序列)(2 785 bp)两种片段[14],连接入T载体中;依次酶切加入各种元件,构建于表达载体pCSⅡ-EF-MCS中,将构建好的表达质粒载体pCSⅡ-ERE-OV-EXE进行酶切测序鉴定;脂质体转染293T细胞和鸡胚成纤维细胞,初步验证艾塞那肽基因转录激活功能。

图1 慢病毒载体pCSⅡ-ERE-OV-EXE结构示意图
1.3 慢病毒包装、滴度测定将包装质粒pCAG-HIVgp、包膜蛋白质粒pCMV-VSV-G-RSV-Rev和表达载体质粒pCSⅡ-ERE-OV-EXE按1∶1∶2的比例应用磷酸钙法转染汇合率约为70%的293T细胞。在温度37℃、3%的CO2培养箱中培养16 h,吸除细胞上清液,加入7.5 mL含有10 μmol/L Forskolin的完全培养基,在37℃、10%的CO2培养箱中孵育48 h,收集上清液4℃保存。收集的上清液用0.45 μm滤膜过滤,滤液50 000 r/min,温度20℃离心2 h,弃上清,沉淀中加入500 μL HBSS,充分溶解后转移至0.5 mL的超滤管中,14 000 r/min离心30 min,用HBSS清洗2次后,分装-70℃保存备用。参照Ultra Rapid Lentiviral Titer Kit 试剂盒说明测定病毒滴度。
1.4 血管显微注射慢病毒将BJ-40细玻管,规格为外径100 μm,内径80 μm,长度10 cm,在拉针仪拉针后用断针仪熔断,外径为20~30 μm,然后在磨针仪上30度角斜面,快速磨针;在显微镜400倍下观察针尖的完整性;将合格的玻璃针浸泡在75%乙醇中,用抽吸装置清洗内壁5次,在无水乙醇中清洗5次,置于超净台中晾干紫外照射过夜待用。
新鲜白来航鸡种蛋取回后,先用0.1%的新洁尔灭溶液清洗,除去表面污迹,然后用70%酒精喷洒消毒,待蛋壳表面晾干后,放进孵化器里进行孵化,孵化温度为37.5℃,相对湿度为55%~65%,90°角,2 h间隔自动翻蛋,大约孵化时间52~55 h,将发育至14~15期的鸡胚取出,用酒精棉擦拭表面消毒,上下轻轻晃动使胚胎脱离内层壳膜;用牙科钻在赤道附近打出个直径4 mm左右的小孔,仔细剔除蛋壳膜,在体式显微镜30倍下用显微注射仪将1 μL 1×109TU/mL慢病毒溶液缓慢注射到鸡胚卵黄外周血管中,液体石蜡封堵注射口,用parafilm封闭蛋壳开口,标记后继续孵化至出雏。

图2 鸡胚卵黄外周静脉血管显微注射慢病毒试验操作演示图
1.5 PCR检测对发育至性成熟期G0代公鸡精液基因组及G1后代血液基因组提取后PCR检测。参照慢病毒载体pCSⅡ-ERE-OV-EXE中EXE序列信息,利用Primer 5.0软件设计引物,进行PCR扩增。引物上游:5′-CATGCACATGAGAGGTGGATATAG-3′;引物下游:5′-GGTGTACATGATCAGCATGCTCTA-3′;扩增长度为465 bp的包含EXE基因片段。PCR扩增体系25 μL,基因组DNA 2 μL,上游引物(10 μmol/L)1.5 μL,下游引物(10 μmol/L)1.5 μL,PCR预混液12.5 μL,ddH2O 7.5 μL。PCR 反应程序:94℃预变性5 min;94℃ 30 s变性,62℃ 45 s 退火,72℃ 45 s延伸,共25个循环;72℃延伸5 min。取PCR产物5 μL,1%琼脂糖凝胶电泳检测。根据三磷酸甘油醛脱氢酶(GAPDH)基因序列设计特异性引物进行PCR扩增,扩增片段长度为248 bp作为参照。
1.6 Southern blot分析对PCR检测阳性G1代个体及野生型个体,提取份血液DNA 10~20 μg,37℃水浴条件下,一份DNA用EcoRⅠ和PstⅠ双酶切消化过夜,另一份HindⅢ酶单切消化过夜,分别用2%琼脂糖凝胶电泳分离后转移到尼龙膜上。根据质粒载体pCSⅡ-ERE-OV-EXE序列,随机引物法标记探针,PCR扩增出641 bp DNA 片段,作为Southern blot的探针。地高锌核酸探针标记Southern blot按罗氏公司DIG High Prime DNA Labeling and Detection Starter KitⅡ说明进行操作。
1.8 组织免疫化学检测取G2代母鸡输卵管组织在PBS配制的4%多聚甲醛中固定2 h,然后用PBS洗涤20 min,4℃下30%蔗糖溶液中培养过夜。组织包埋于石蜡中,10 m厚度切片。将切片固定后封闭液中封闭2 h。小鼠抗体1∶100的比例稀释,并在4℃下孵育过夜。免疫荧光二抗以1∶400稀释并在室温下孵育2 h。使用激光共聚焦显微镜拍照分析。野生型鸡输卵管组织切片作为阴性对照。
1.9 艾塞那肽蛋白提取及定量将来自G2代转基因母鸡和野生型各30枚蛋收集蛋清,与6倍体积冰冻的浓度为50 mmol/L醋酸钠缓冲液(pH5.0)在4℃下混合2 h,去除大部分的卵黏蛋白。将所得混合物分装后储存在-20℃供进一步分析。使用ELISA试剂盒测定蛋清中人艾塞那肽浓度,每个样品做2个重复,取2个重复均值作为1次测量值,每个样品至少测定3次,然后根据吸光值、稀倍数和标准曲线计算出每个样品的艾塞那肽浓度,再计算浓度均值和标准差。
2 结果
2.1 G0代公鸡精液、G1代血液DNA的PCR及Southern blot检测验操作72枚白来航鸡种蛋,鸡胚发育至第14~15期(孵化52~55 h),于卵黄外周静脉血管显微注射1 μL病毒滴度为1×109TU/mL慢病毒,孵化出雏56只,孵化率77.8%(56/72)。至性成熟阶段,采集到16只公鸡精液提取DNA后进行PCR检测,其中11只公鸡阳性,阳性率68.7%(11/16)(图3)。挑选5只阳性信号强的公鸡单笼饲养,与3~5只野生型白来航母鸡配种,收集种蛋,标记后进行孵化。对G1代进行血液DNA检测,在60只G1代中检测出5只阳性转基因鸡(编号:66,78,209,288,289)(图4A),转基因效率为8.3%(5/60)。为了进一步验证,对G1代5只阳性个体进行了Southern blot 检测,经PstⅠ和EcoRⅠ双酶切杂交试验结果显示均为转基因鸡后代(图4 C),经HindⅢ单酶切杂交实验结果显示外源基因单拷贝插入,且有不同的插入位点,符合孟德尔遗传(图4 B)。对G1代转基因鸡扩繁生产G2代。
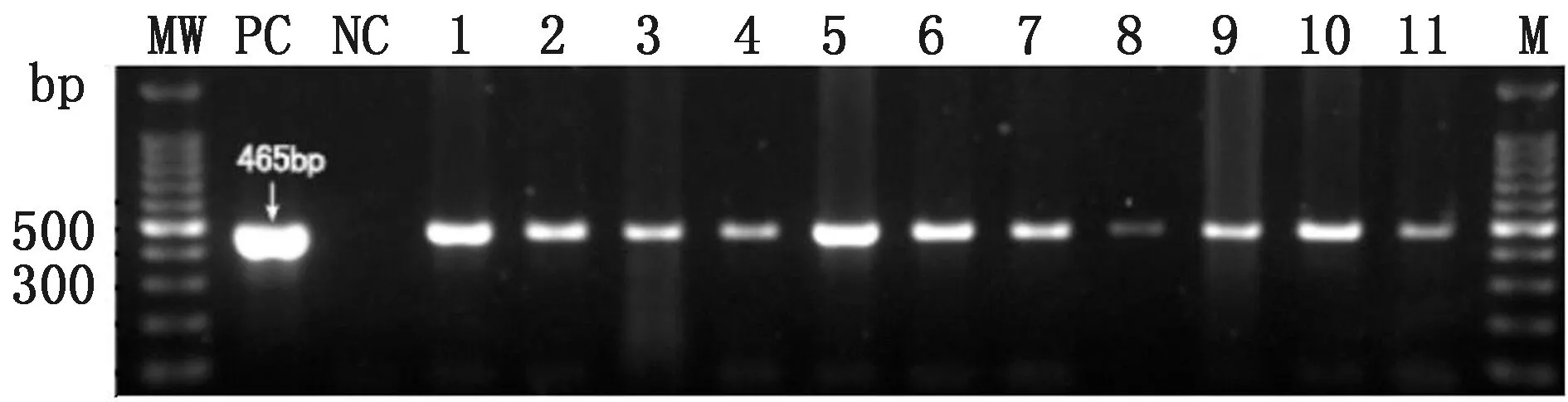
1~11.阳性个体;M.DL1000 DNA Marker;PC.阳性对照;NC.阴性对照

A.PCR检测(68,76,209,288,289.为G1代中的5只阳性个体;GAPDH基因扩增作为内参;M.DL10 kb DNA Marker;PC.阳性对照;NC.阴性对照);B.血液基因组DNA的Southern blot检测,血液基因组DNA(10~20 μg)经HindⅢ单酶切后用引物做探针杂交;C.血液基因组DNA经PstⅠ和EcoRⅠ双酶切后杂交结果(PC,80 pg的pCSⅡ-ERE-OV-EXE质粒;NC,未注射慢病毒鸡血液基因组DNA)
2.2 G2代转基因鸡卵清蛋白中艾塞那肽的检测为了进一步检测转入外源基因是否出现基因沉默现象,本试验对转基因鸡后代蛋清中的艾塞那肽的含量进行测定。本试验对G2代阳性母鸡(编号:209,288,289),待发育至性成熟期产蛋后,连续收集30个鸡蛋,根据ELISA试剂盒说明书,对蛋清中的艾塞那肽进行测定,野生型白来航作对照。结果:只G2代转基因母鸡(编号:209,288,289)蛋清中艾塞那肽含量为分别为:(39.19±1.32),(42.78±2.10),(53.61±2.54) mg/L,平均为45.19 mg/L,野生型白来航鸡未检测出(图5)。
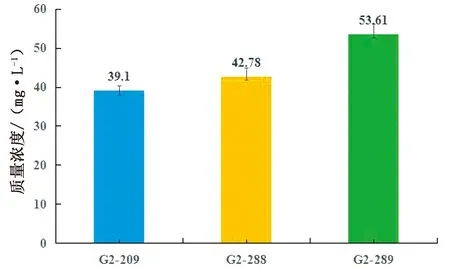
图5 G2代转基因鸡蛋清中艾塞那肽质量浓度测定
通过ELISA方法来测定3只G2代转基因母鸡和野生型母鸡蛋清中艾塞那肽的表达量。试剂盒检测范围是0~1 000 ng/L。G2代转基因母鸡:G2-209,G2-288,G2-289;野生型白来航母鸡未检出。
2.3 G2代母鸡输卵管上皮免疫组织化学检测为了进一步验证外源基因(艾塞那肽)在卵清蛋白基因特异性启动子调控下仅在输卵管上皮特异性表达,对G2代转基因母鸡输卵管组织进行了免疫组织化学检测,野生型白来航鸡作为对照。结果显示,在G2代转基因母鸡输卵管上皮组织中有较强的红色抗体信号,对照组无阳性信号,进一步证实我们不仅成功制备了表达艾塞那肽的转基因鸡,且外源基因(艾塞那肽)仅在输卵管上皮组织表达,具有组织表达特异性(图6)。
3 讨论
3.1 鸡卵清蛋白特异性启动子的表达机制本试验构建了一个基于复制缺陷型慢病毒载体,该载体由鸡卵清蛋白基因特异性启动子调控表达外源基因(艾塞那肽),并在启动子上游添加元件来增强表达。通过实验室早期建立的鸡胚血管显微注射技术平台,拟期望简便、高效、稳定获得转基因鸡后代,并证明外源基因(艾塞那肽)仅在输卵管上皮组织特异地表达,既尽量减少对宿主的毒性作用,又能便于收集、分离和纯化,还能保持外源蛋白的生物活性。
鸡蛋蛋清是由输卵管上皮细胞中的腺细胞分泌的,卵清蛋白基因编码超过1/2以上的蛋清蛋白,其中卵清蛋白占54%,约为2.2 g,输卵管上皮单个腺细胞中卵清蛋白mRNA拷贝数多达105个[24-25]。在试验中,在白来航鸡基因组中扩增卵清蛋白5′端启动子调控序列,主要包括类固醇激素依赖调控元件(steroid dependent regulatury element,SDRE)和NRE(negative regulatury element)两个调控元件,SDRE位于基因上游-892~-780区,可与雌激素和糖皮质激素结合,产生相应的应答反应,促进卵清蛋白基因的转录;NRE位于基因上游-308~-88,该元件具有双重作用,在雌激素作用下会增强卵清蛋白基因的表达,反之抑制卵清蛋白基因的表达[26];另外扩增出包括OVA第1外显子、第1内含子和第2外显子开始部分,长度为2 785 bp鸡卵清蛋白启动子调控序列,既能保证外源基因的表达,又能保证表达的组织特异性[12,14]。为了进一步增加外源基因的表达,在OVA 启动子上游插入了一个雌激素应答原件(ERE,675 bp)来进一步促进目的基因的转录[14-16]。艾塞那肽是一种含有39个氨基酸的多肽序列, cDNA序列(117 bp),连接在OVA启动子上游5′端,总共长度约3.6 kb,符合选择的复制缺陷型慢病毒系统要求,未超出其有效载荷,成功包装出高滴度的慢病毒。对获得的转基因鸡后代进行免疫组织化学检测,结果证明了艾塞那肽蛋白仅特异地在输卵管上皮组织管状腺细胞内表达,即卵清蛋白合成区域,其他上皮组织细胞未见,具有表达特异性,符合试验设计预期,也与其他研究者报道一致[14-16]。虽然本试验成功获得表达外源目的基因的转基因鸡,但是从卵清蛋白中检测的目的蛋白含量与其他研究报道相比,具有一定的差异性。在试验中测得G2代转基因母鸡蛋清中艾塞那肽含量平均为45.19 mg/L,与LILLICO等[14]和CAO等[15]报道结果接近,比LIU等[16]报道的高出多倍。构建同样的表达载体及元件,在转基因鸡后代中目的蛋白的表达却出现较大差异,推测可能是慢病毒载体的随机插入造成目的蛋白的表达差异[27],也可能是对转基因后代中检测数据方法不一致造成的,如有的检测G1代,有的检测G2代,对转基因鸡后代检测统计数目偏小也可能造成人为误差;另外也有可能是表达载体不同引起的,如EIAV相对于HIV,同属于慢病毒,对宿主造成的毒性较小,且携带的外源基因序列更大[14]。
3.2 转基因鸡制备效率近年来,利用转基因鸡输卵管生物反应器生产药用蛋白已取得了很多可喜的成果,其中胚盘下腔显微注射慢病毒法和PGCs体外转染法是公认比较成功的方法。ZHU等[12]利用构建的卵清蛋白特异性启动子的慢病毒载体,通过胚盘下腔显微注射慢病毒法首次制备出表达人源化融合性单克隆抗体的嵌合体鸡,并且在蛋清中表达的单克隆抗体产量及生物活性都令人感到振奋,但未能获得性系传递的转基因后代。LILLICO等[14]将携带有卵清蛋白特异性启动子调控序列分别表达miR24和hINFβ1a两种慢病毒载体(EIAV),通过同样的方法成功制备出转基因鸡后代,而且两者都能检测到输卵管组织特异性表达具有完全生物活性的药用蛋白及人源化抗体,且能稳定遗传给后代。KWONT等[28]通过同样的方法成功制备在卵清蛋白中特异性表达人干扰素的转基因鹌鹑。BON KOO等[29]利用逆转录病毒载体胚盘下腔显微注射成功制备了特异性表达人促红细胞生成素的转基因鸡。在国内,有研究者通过同样的方法成功制备在卵清蛋白中特异性表达重组人防御素4和人溶菌酶两种药用蛋白的转基因鸡[15-16]。以上报道是将病毒载体注射到发育第Ⅹ期的胚盘下腔,通过感染囊胚期40 000~60 000个细胞中的几个PGCs,先生产出性系嵌合体。首先需要在鸡胚孵化过程中进行繁杂的倒三期培养体系[17];其次,必须包装出高滴度的慢病毒;第三,要求特定的试验设备,同时要求显微注射操作者必须精准、熟练,且经过严格训练。另外,利用PGCs体外转染法制备转基因鸡被认为是一种有效的方法[18-20],但是,由于家禽PGCs培养的特殊性(需要滋养层细胞,培养血清中需要添加多种特殊的抑制细胞分化因子),加上PGCs的分离、纯化、培养、传代、体外转染、筛选等一系列技术环节周期长,繁琐且费时费力,而且还不能确保转染后的PGCs注射到同期发育胚胎后,能否迁移至受体鸡胚的生殖原基进一步分化形成配子(精子或卵子),所以还一直未能做到真正的推广应用。
本试验构建了一个鸡卵清蛋白基因特异性启动子调控表达艾塞那肽的慢病毒载体,尝试把显微注射法、慢病毒载体法两种转基因技术与早期鸡胚PGCs迁移规律的生殖生理特点结合起来,选择鸡胚发育至14~15期,血液中PGCs向生殖原基迁移高峰期,将高滴度的慢病毒载体注入血管中,随血液循环而感染其中的PGCs,最终获得了可表达外源基因(艾塞那肽)的转基因鸡。与经典的生产转基因家禽方法相比,不仅省去复杂的倒三期培养体系及PGCs的分离、纯化、培养、建系、转染、筛选后再注回同期受体胚胎等一系列繁杂程序操作,而且节约了大量的人力、物力、财力,转基因鸡的制备综合效率(G0代孵化率,G1代阳性率等)整整提高了上百倍。本研究组建立的简便、高效、稳定生产转基因鸡的创新技术体系,在卵清蛋白特异性启动子调控作用下,利用鸡输卵管天然、高效合成并分泌蛋白的能力,在鸡蛋中生产一些具有重要价值的药用蛋白,具有广阔的应用前景和经济发展潜力。
