盐酸小檗碱对芍药苷的经皮促透规律及促透机制研究
2023-11-27尧章洪郑其祥管咏梅陈丽华朱卫丰刘丽丽
邹 佳,尧章洪,郑其祥,管咏梅,陈丽华,朱卫丰*,刘丽丽, 2*
盐酸小檗碱对芍药苷的经皮促透规律及促透机制研究
邹 佳1, 3,尧章洪1,郑其祥4,管咏梅1,陈丽华1,朱卫丰1*,刘丽丽1, 2*
1. 江西中医药大学,现代中药制剂教育部重点实验室,江西 南昌 330004 2. 江西中医药大学药学院,江西 南昌 330004 3. 江西科技学院,江西 南昌 330098 4. 江西中医药大学19级中药科研实践班,江西 南昌 330004
考察盐酸小檗碱对芍药苷体外经皮渗透行为的影响,筛选最佳促透条件并探索促透机制。采用改良Franz扩散池法,选择适宜的供给液及接收液,探索盐酸小檗碱促进芍药苷经皮渗透的最佳促透条件及促透规律;利用扫描电子显微镜、激光扫描共聚焦显微镜、分子模拟探究促透机制。选择20%乙醇-pH 7.4磷酸盐缓冲液(PBS)为接收液,盐酸小檗碱-芍药苷在pH 5.0的介质条件下透皮效果最佳,且在此条件下,高、中、低质量浓度的芍药苷与盐酸小檗碱配伍后,芍药苷的24 h累积透过量(24)分别增加了78.03%、44.73%、35.63%,其中高质量浓度配伍组中芍药苷的24与芍药苷单独给药组相比具有显著性差异(<0.05),芍药苷透皮速率显著增加,促透比为1.74。促透机制研究结果显示,盐酸小檗碱可能使角质层整齐紧密堆积排列的叠瓦式结构松动,表面的褶皱明显增多加深;盐酸小檗碱可促进水溶性成分荧光素钠和脂溶性成分尼罗红在皮肤中的渗透,相应皮肤渗透量及渗透深度均有所增加。盐酸小檗碱可竞争性地与角质层脂质的头部结合,使芍药苷摆脱皮肤脂质氢键网络的束缚,进而促进芍药苷的经皮吸收。芍药苷-盐酸小檗碱透皮的最佳pH值为5.0,盐酸小檗碱可促进芍药苷的经皮吸收,且具有浓度依赖性,促透机制可能为盐酸小檗碱通过调控角质层紧密连接易化皮肤转运阻力、影响皮肤通透性及竞争性与角质层脂质的极性头部结合进而促进芍药苷经皮渗透。
芍药苷;盐酸小檗碱;组分配伍;促透规律;促渗机制
外治专著《理瀹骈文》[1]中黄连/黄柏、赤芍/白芍常配伍使用,多用于治疗阴虚、湿热及一切无名肿毒之症。黄连/黄柏的主要质控和有效成分为小檗碱,小檗碱是一种季铵型生物碱,具有抗菌、抗炎等作用[2],临床常用其盐酸盐[3],即盐酸小檗碱,外用可治疗新生儿脓痱子[4]、修复糖尿病感染造成的创面[5]等。赤芍/白芍的主要质控和有效成分为芍药苷,芍药苷是一种蒎烷单萜苦味苷,具有镇静抗炎、免疫调节的作用[6],对多种炎症性皮肤病和自身免疫性皮肤病等具有良好的治疗效果,不仅能有效缓解症状,还能减少激素或免疫抑制剂的剂量[7-8]。然目前未见相关经皮给药制剂上市。盐酸小檗碱及芍药苷经皮给药制剂开发具有广阔前景。
文献报道盐酸小檗碱可促进芍药苷的经皮吸收,然促透规律及机制不明[9]。皮肤表面和给药系统的pH值均可影响有机弱酸、有机弱碱类药物的解离程度,影响其溶解和分配性能,进而影响药物的经皮渗透性[10]。因此,本实验考察了不同pH值条件下芍药苷-盐酸小檗碱的体外经皮渗透行为,确定芍药苷-盐酸小檗碱透皮吸收的最佳pH值,进而研究盐酸小檗碱与不同质量浓度芍药苷配伍对芍药苷体外经皮吸收行为的影响,探究其促透规律,并在此基础上开展促渗机制研究,以期为含盐酸小檗碱及芍药苷相关外用制剂的开发奠定基础。
1 仪器和材料
1.1 仪器
Agilent 1260型高效液相色谱仪,美国安捷伦科技有限公司;TP-6型药物透皮扩散试验仪,天津市正通科技有限公司,配套改良Franz扩散池,=1.13 cm2,=15 mL;BT25S型电子天平,德国Sartorius公司;THZ-300C恒温培养摇床,上海一恒科学仪器有限公司;EPED型超纯水器,南京易普易达科技发展有限公司;PHS-3C型pH计,上海仪电科学仪器股份有限公司;DZF-6050型真空干燥箱,上海新苗医疗器械制造有限公司;FEI Quanta 250型扫描电子显微镜(scanning electron microscope,SEM),美国FEI公司;SP5型激光共聚焦显微镜(laser confocal microscope,CLSM),德国Leica公司。
1.2 试剂
芍药苷(批号20030203,质量分数98%)、盐酸小檗碱(批号20111102,质量分数98%),成都普菲德生物技术有限公司;乙腈,HPLC级,湖北弗顿科学技术有限公司;磷酸、甲醇、无水乙醇,AR级,西陇科学股份有限公司;2.5%戊二醛,北京索莱宝科技有限公司;乙酸异戊酯、丙酮,国药集团化学试剂有限公司;氮酮,上海罗恩化学技术有限公司;尼罗红、荧光素钠,北京索莱宝科技有限公司。
1.3 动物
SPF级,健康昆明种小鼠,雄性,体质量(20±2)g,购自湖南斯莱克景达实验动物有限公司,动物许可证编号为SCXK(湘)2019-0004。本实验相关动物实验遵循江西中医药大学有关实验动物管理和使用的规定,均符合3R原则。
2 方法与结果
2.1 溶液的配制
2.1.1 对照品溶液的制备 取芍药苷、盐酸小檗碱对照品适量,精密称定,置于10 mL棕色量瓶中,加甲醇溶解,定容至刻度,得质量浓度分别为芍药苷0.978 mg/mL和盐酸小檗碱0.938 mg/mL的混合对照品储备液。
2.1.2 供试品溶液的制备
(1)不同pH值介质条件下的芍药苷-盐酸小檗碱混合溶液的制备:按照《中国药典》2020年版四部通则下的方法制备pH值分别为4.0、5.0、6.8、7.4、8.0的磷酸盐缓冲液(PBS)[11],向PBS中加入一定量的芍药苷和过饱和的盐酸小檗碱,配制成芍药苷-盐酸小檗碱的过饱和水溶液。
(2)盐酸小檗碱-芍药苷不同配比混合溶液的制备:精密称取适量芍药苷溶解在最佳pH值的PBS中,用玻棒持续搅拌,制备成含芍药苷分别为10、20、30 mg/mL的溶液。另称取适量芍药苷和盐酸小檗碱,用最佳pH值的PBS配成不同质量浓度的芍药苷(10、20、30 mg/mL)-盐酸小檗碱(1.5 mg/mL)配伍溶液。将配好的溶液放在37 ℃、120 r/min的恒温摇床中放置过夜,即得。
2.2 体外分析方法的建立及方法学考察
2.2.1 色谱条件 菲罗门C18色谱柱(250 mm×4.6 mm,5 µm);流动相为乙腈-0.15%磷酸水溶液,梯度洗脱:0~12 min,16%乙腈;12~15 min,16%~25%乙腈;15~30 min,25%乙腈;体积流量为1.0 mL/min;柱温为35 ℃;检测波长为230 nm;进样体积为10 µL。
2.2.2 专属性试验 空白接收液、对照品溶液、供试品溶液及含药鼠皮提取液的HPLC谱图如图1所示,由图可知,小鼠皮肤和基质溶剂对芍药苷、盐酸小檗碱的测定无干扰,该测定方法专属性良好。
2.2.3 线性关系考察 依次稀释芍药苷-盐酸小檗碱混合对照品储备液,按“2.2.1”项下色谱条件进样测定,以所得到的芍药苷、盐酸小檗碱色谱图峰面积积分值()与其质量浓度()进行线性回归,得到回归方程:芍药苷=11.08-71.20,=0.999 7、盐酸小檗碱=20.77-76.80,=0.999 0,结果表明芍药苷在9.78~489.00 μg/mL、盐酸小檗碱在0.938~375.200 μg/mL与其峰面积呈良好的线性关系。
2.2.4 精密度试验 取高、中、低3个质量浓度(芍药苷97.8 μg/mL-盐酸小檗碱93.8 μg/mL、芍药苷48.9 μg/mL-盐酸小檗碱46.9 μg/mL、芍药苷24.45 μg/mL-盐酸小檗碱23.45 μg/mL)的芍药苷-盐酸小檗碱混合对照品溶液,按“2.2.1”项下所示色谱条件进样10 µL,连续进样6次,测定芍药苷和盐酸小檗碱峰面积,计算其RSD。结果芍药苷高、中、低质量浓度峰面积值的RSD分别为0.29%、0.75%、1.71%;盐酸小檗碱高、中、低质量浓度峰面积值的RSD分别为0.05%、0.08%、1.15%。
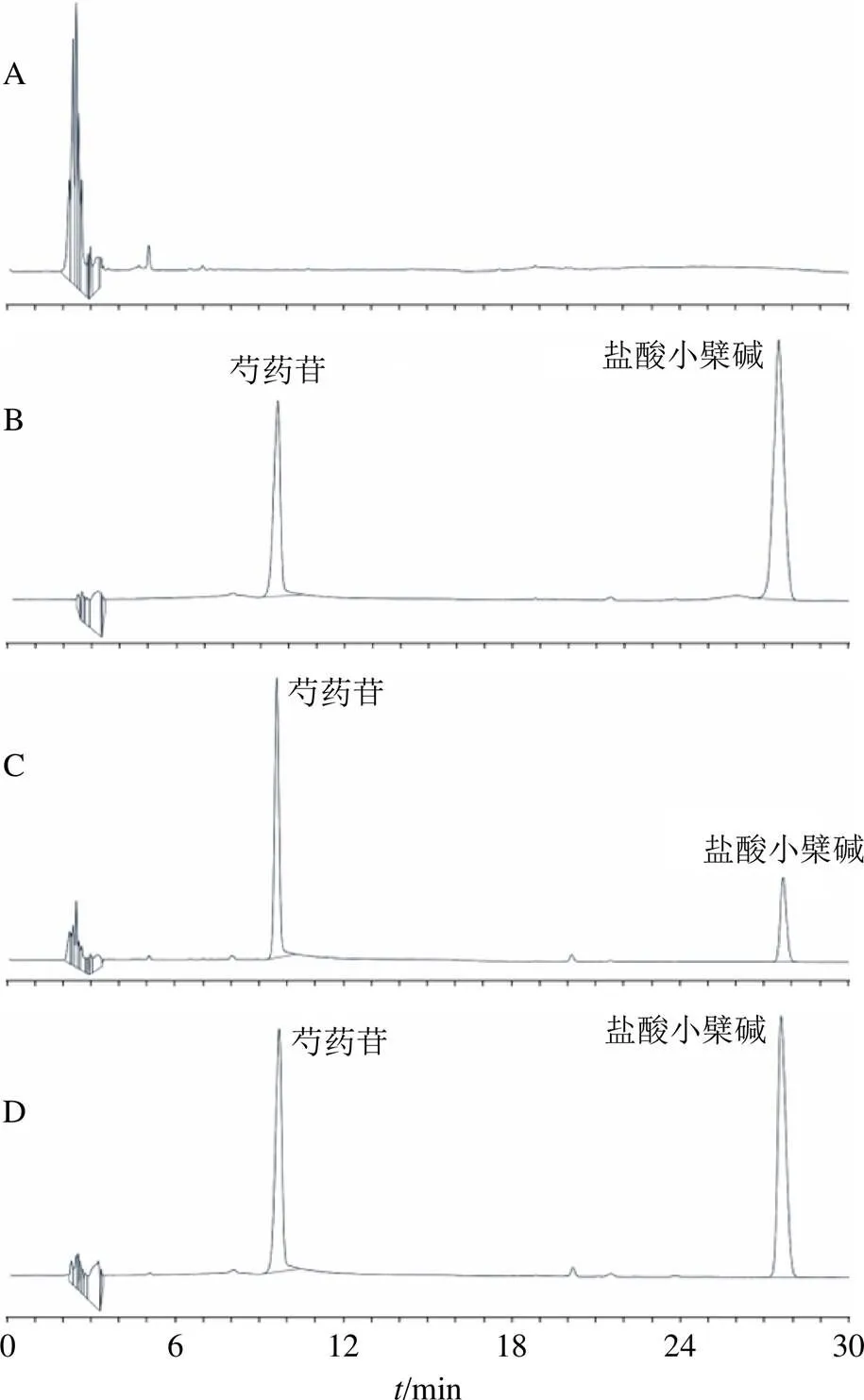
图1 空白接收液(A)、对照品溶液(B)、供试品溶液(C)和含药鼠皮提取液(D)的HPLC图
2.2.5 重复性试验 平行制备供试品溶液6份,按“2.2.1”项下方法测定,计算得芍药苷、盐酸小檗碱质量浓度的RSD分别为0.49%、1.98%,结果表明供试品溶液重复性良好。
2.2.6 稳定性试验 取同一个供试品溶液分别于0、2、4、8、12、24 h进样测定,记录峰面积,结果芍药苷、盐酸小檗碱峰面积的RSD分别为0.38%、0.18%,结果表明供试品溶液在24 h内相对稳定。
2.2.7 加样回收率试验 取空白皮肤接收液,加入高、中、低3个质量浓度的芍药苷、盐酸小檗碱对照品溶液,配成高、中、低3个质量浓度的供试品溶液,每个质量浓度供试品溶液3份,共9个供试品溶液,按“2.2.1”项下色谱条件测定芍药苷和盐酸小檗碱的质量浓度,计算回收率,结果芍药苷低、中、高3个质量浓度的加样回收率分别为99.56%、103.25%、104.38%,RSD分别为3.71%、1.89%、1.24%,盐酸小檗碱的加样回收率分别为101.60%、103.64%、99.52%,RSD分别为1.69%、1.47%、1.19%,均<5%,符合测定要求。
2.3 鼠皮的制备
雄性昆明种小鼠安乐死后,剔去腹部的毛发,确保角质层完好,用动物手术弯剪迅速将动物腹部皮肤剥离,用脱脂棉蘸取生理盐水擦去脂肪组织和结缔组织,塑封包装后于−20 ℃冷冻保存,1周内使用。
2.4 体外经皮渗透实验
2.4.1 接收介质的选择 因盐酸小檗碱水溶性差,故考察了其在10%乙醇-PBS、10%乙醇-生理盐水及20%乙醇-PBS、20%乙醇-生理盐水中的饱和溶解度,由表1可知,盐酸小檗碱在20%乙醇-PBS中溶解度最好,且满足漏槽条件,因此选用20%乙醇- PBS作为透皮接收液。
2.4.2 体外透皮试验装置及条件 使用有效扩散面积为1.13 cm2的改良型Franz立式扩散池进行渗透研究。将“2.3”项下准备的鼠皮固定在扩散池之间,表皮面向供给池,真皮层面向接收池,弹簧夹固定,用接收液平衡30 min后准确移取1 mL供给液,注入供给池,在接收池中加入15 mL接收液。温度保持在(37.0±0.5)℃,搅拌速度400 r/min。分别于2、4、6、8、10、12、24 h共7个时间点进行取样,每次取样体积为1 mL,取样后立即补充同温等量空白接收液,以维持漏槽条件。经0.22 μm微孔滤膜滤过,HPLC测定芍药苷、盐酸小檗碱含量。
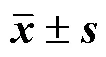
表1 盐酸小檗碱在各接收介质中的溶解度(, n = 3)
2.4.3 皮肤滞留量(s)测定 实验结束后,取下皮肤,用生理盐水洗净皮肤表面的药物,剪下给药部分,剪碎,加1 mL甲醇,涡旋5 min,超声30 min,10 000 r/min离心10 min(离心半径4.5 cm),取上清液用0.22 μm微孔滤膜滤过,HPLC测定芍药苷、盐酸小檗碱的含量。
2.4.4 数据分析与处理[12-13]药物的累积透过量(Q)的计算公式如下:
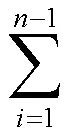
为接收液总体积,C为第次取样时接收液中药物的质量浓度,C为第次取样时接收液中药物的质量浓度,V为取样体积,为有效扩散面积
以药物的24 h累积透过量(24)对取样时间作曲线,并对曲线中的直线部分进行线性回归,求出的直线斜率即为稳态透皮速率(s)。
药物的皮肤滞留量(s)的计算公式如下:
s=/
药物的促透比(ER)的计算公式如下:
ER=s(含促透剂)/s(不含促透剂)
2.4.5 介质pH值对芍药苷-盐酸小檗碱体外透皮吸收的影响 结果见图2和表2。芍药苷在pH 5.0的介质中24最大,与芍药苷在pH 8.0介质中的24相比,具有极显著性差异(<0.01)。盐酸小檗碱在不同pH值介质中24排列:pH 5.0>pH 6.8>pH 8.0>pH 7.4>pH 4.0。故选择pH 5.0作为芍药苷-盐酸小檗碱透皮吸收的最佳pH值。
2.4.6 盐酸小檗碱对不同质量浓度的芍药苷体外透皮吸收的影响 盐酸小檗碱对不同质量浓度的芍药苷均显示一定的促透效应且具有浓度相关性。高质量浓度配伍组中芍药苷的24与其单独给药组相比具有显著性差异(<0.05),配伍后芍药苷透皮速率为单独给药组的1.74倍,表明盐酸小檗碱可促进芍药苷更快透过角质层。此外,芍药苷与盐酸小檗碱配伍后,芍药苷的皮肤滞留量均有所增加,促进了芍药苷的皮肤贮库效应形成,有利于其持续释放,具体结果见图3和表3。
2.5 盐酸小檗碱对芍药苷的促透机制研究
2.5.1 SEM观察不同处理的小鼠皮肤 按“2.3”项下方法制备新鲜完整鼠皮,剪取1 cm2大小皮肤,分别浸入pH 5.0的PBS溶液、3%氮酮溶液、芍药苷-盐酸小檗碱配伍溶液(根据前面得到的高质量浓度配伍组促透效应好,继而根据这个质量浓度进行促透机制的研究,所以其质量浓度为盐酸小檗碱1.5 mg/mL-芍药苷30 mg/mL),在室温下密封浸泡12 h后,置于2.5%戊二醛溶液中避光固定,4 h后用pH 7.0的PBS液清洗,用1%锇酸避光固定2 h,用pH 7.0的PBS液清洗,滤纸吸干,冷冻干燥后喷金,SEM下观察[14]。观察结果如图4所示,正常皮肤组小鼠皮肤表面较为光滑平整,纹理清晰致密,最外层的角质层细胞呈叠瓦式结构有规律地,整齐紧密地堆积排列。溶剂处理后的小鼠皮肤表面褶皱打开,光滑程度下降,出现部分小小的间隙。氮酮组完整皮肤表面有大量的褶皱出现,皮肤表面光滑度严重下降,角质细胞间隙明显增宽,皮表裂隙清晰可见,有部分表皮鳞片向上翻起,角质层大面积脱落现象。芍药苷-盐酸小檗碱配伍组皮肤变现出与氮酮组类似的变化,角质层有规律的整齐紧密堆积排列的叠瓦式结构有一定程度的松动,形成了部分小小的间裂隙,而且其表面的褶皱明显增多加深。
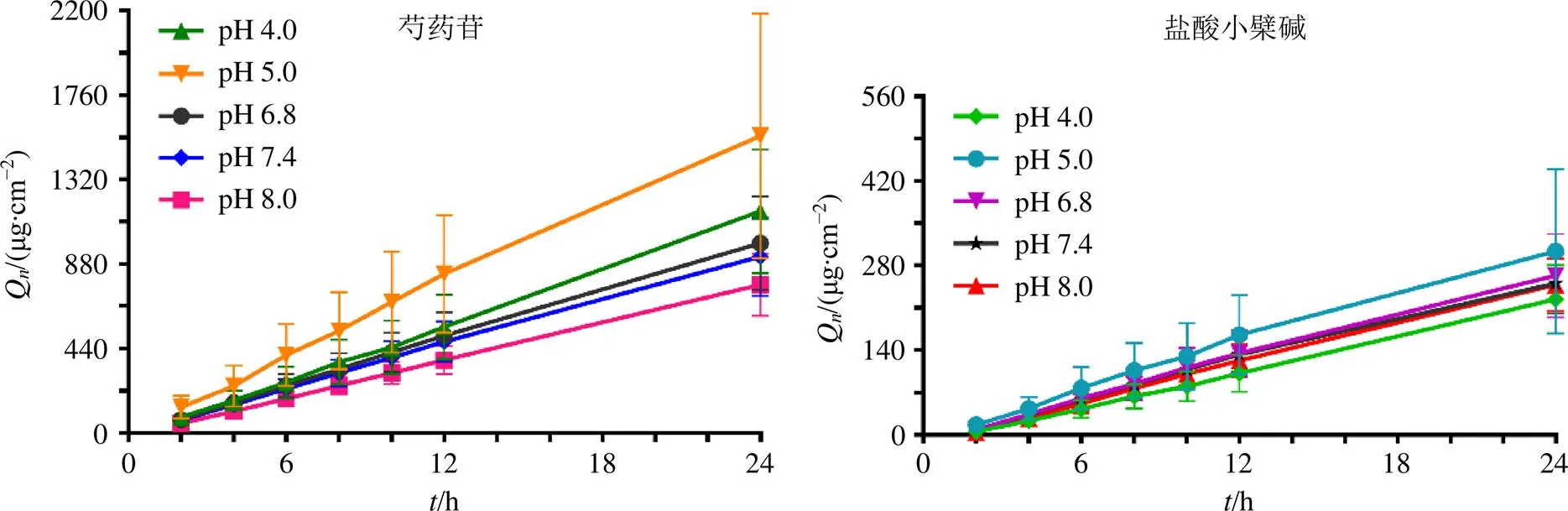
图2 芍药苷和盐酸小檗碱在不同pH值介质中的Qn(, n = 6)
与pH 8.0 PBS比较:*<0.05 与pH 4.0 PBS比较:#<0.05
*< 0.05pH 8.0 PBS#< 0.05pH 4.0 PBS
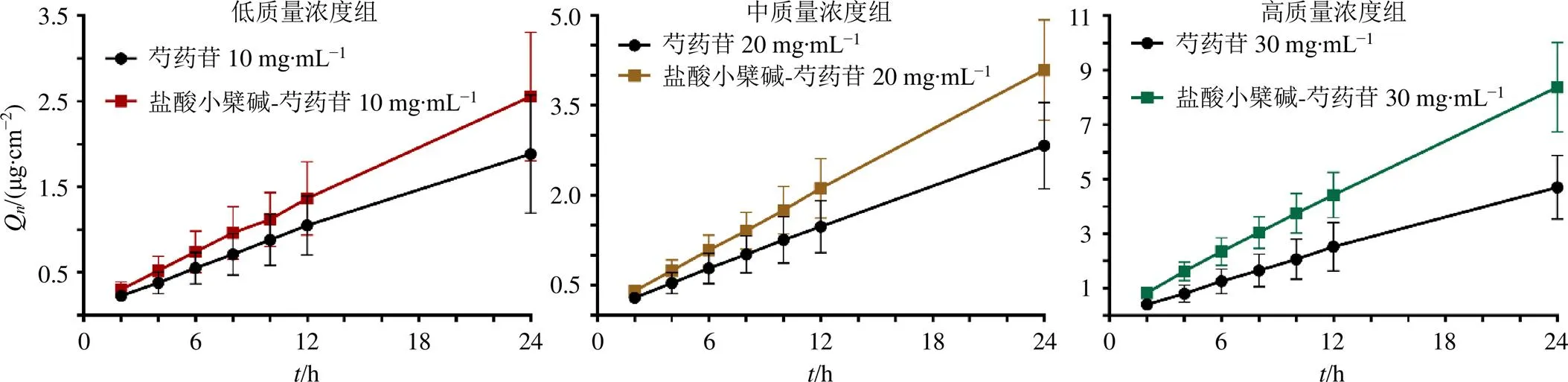
图3 盐酸小檗碱(1.5 mg∙mL−1)与不同质量浓度芍药苷配伍前后芍药苷Qn变化(, n = 6)
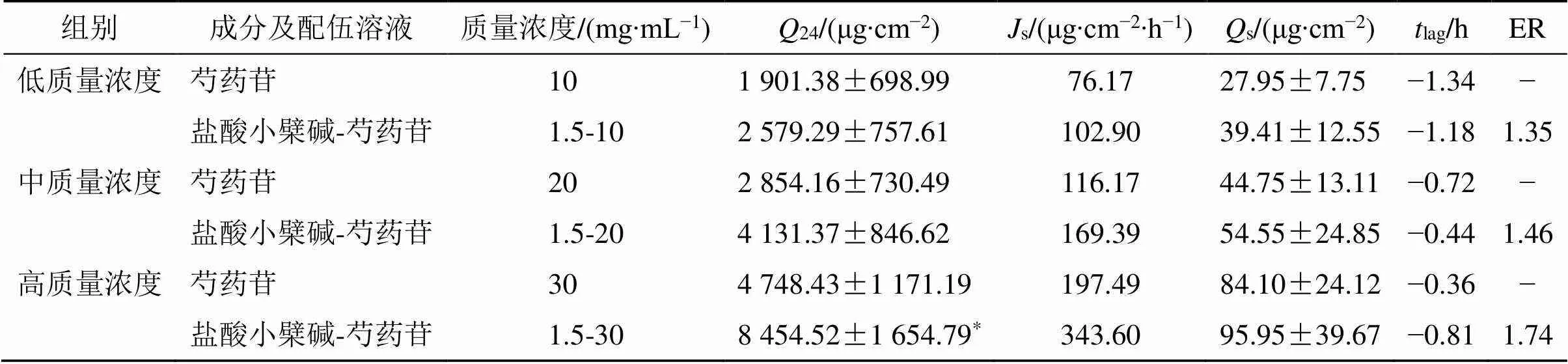
表3 盐酸小檗碱与芍药苷配伍前后芍药苷渗透动力学参数
与芍药苷比较:*<0.05
*< 0.05paeoniflorin
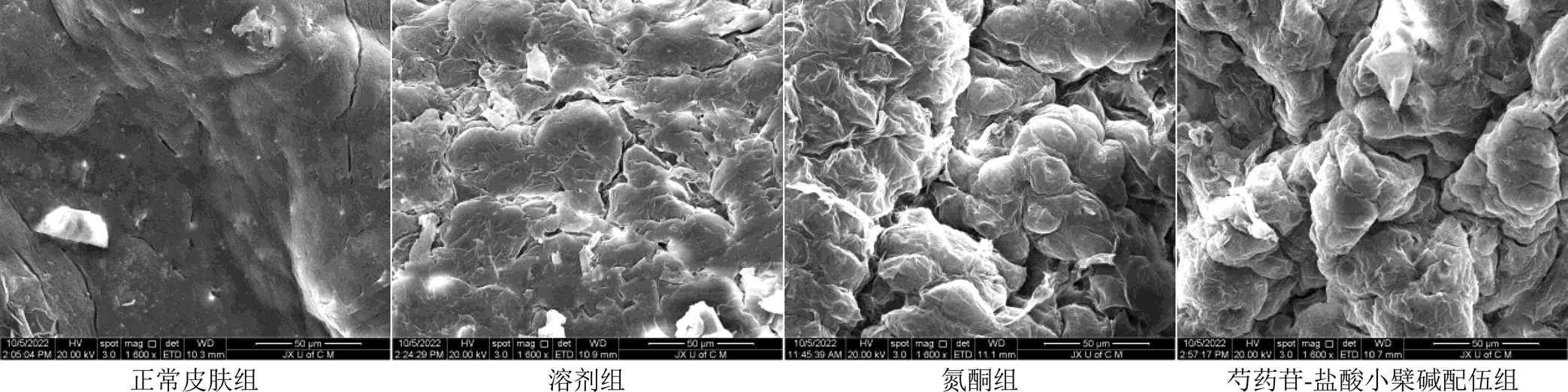
图4 经不同处理的小鼠皮肤SEM图(放大倍数×1600)
2.5.2 CLSM技术观察不同处理的小鼠皮肤对荧光素钠的通透性 运用CLSM技术分别考察盐酸小檗碱对0.05%荧光素钠溶液(亲水性染料)和饱和尼罗红溶液(亲脂性染料)[15]的皮肤渗透量及渗透深度的影响,以期间接反馈盐酸小檗碱对皮肤渗透性的影响以及荧光物质在角质细胞和脂质中的分布程度,推测相关促渗作用机制。
将全层小鼠腹部皮肤固定于TP-6改良型Franz扩散池上,表皮层朝向供给池。供给液分为4组,分别为含芍药苷的0.05%荧光素钠水溶液、含芍药苷-盐酸小檗碱的0.05%荧光素钠水溶液、含芍药苷的饱和尼罗红水溶液、含芍药苷-盐酸小檗碱的饱和尼罗红水溶液,按“2.4.2”项下的体外透皮实验方法处理,经皮渗透1 h后,取出皮肤样本,用PBS洗净表面的残留染料,于共聚焦皿上展开,使用共聚焦激光扫描显微镜进行成像。荧光素钠及尼罗红的激发波长分别设定为542、488 nm。
实验结果如图5、6所示,芍药苷单独给药组中荧光素钠在小鼠皮肤中的荧光强度较低。而配伍组能显著提升荧光素钠在皮肤中的渗透深度及渗透强度。说明配伍促进荧光素钠在皮肤上渗透量及渗透深度。芍药苷单独给药组中尼罗红在小鼠皮肤中的渗透深度及荧光强度均较低。配伍后,尼罗红的在小鼠皮肤中的渗透深度增大,荧光强度更强。说明盐酸小檗碱与芍药苷配伍后,促进尼罗红在皮肤中的渗透量及渗透深度。
2.5.3 计算机模拟分子对接 使用Autodock vina软件分别将盐酸小檗碱及芍药苷与皮肤角质层的代表性脂质成分神经酰胺1、神经酰胺3、神经酰胺6、神经酰胺7进行分子对接,将盐酸小檗碱及芍药苷分子进行加氢与定义扭转键的预处理,定义为配体,神经酰胺进行去水加氢的预处理,定义为受体,将配体与受体执行对接,并将输出的对接结果导入PyMOL软件进行可视化绘图。
将盐酸小檗碱及芍药苷与代表性脂质成分进行对接,结果显示,两者均可与神经酰胺1、3、6、7的极性头部以氢键形式结合,并计算形成氢键的复合物之间的对接能(a),a可在一定程度上反映出分子间相互作用的强度,其值为负表示分子间存在显著的相互作用,并且作用越强负值则越大[16-17],具体结果如图7、8所示。以上结果显示,芍药苷和盐酸小檗碱均能和神经酰胺1、3、6、7的极性头部以氢键形式结合,而盐酸小檗碱与神经酰胺的a皆大于芍药苷与其a,说明盐酸小檗碱与神经酰胺的亲和力要强于芍药苷与神经神经酰胺之间的亲和力,可产生“竞争性氢键效应”,使芍药苷能够摆脱皮肤脂质氢键网络的束缚,更多地被游离出来,实现促透效应。
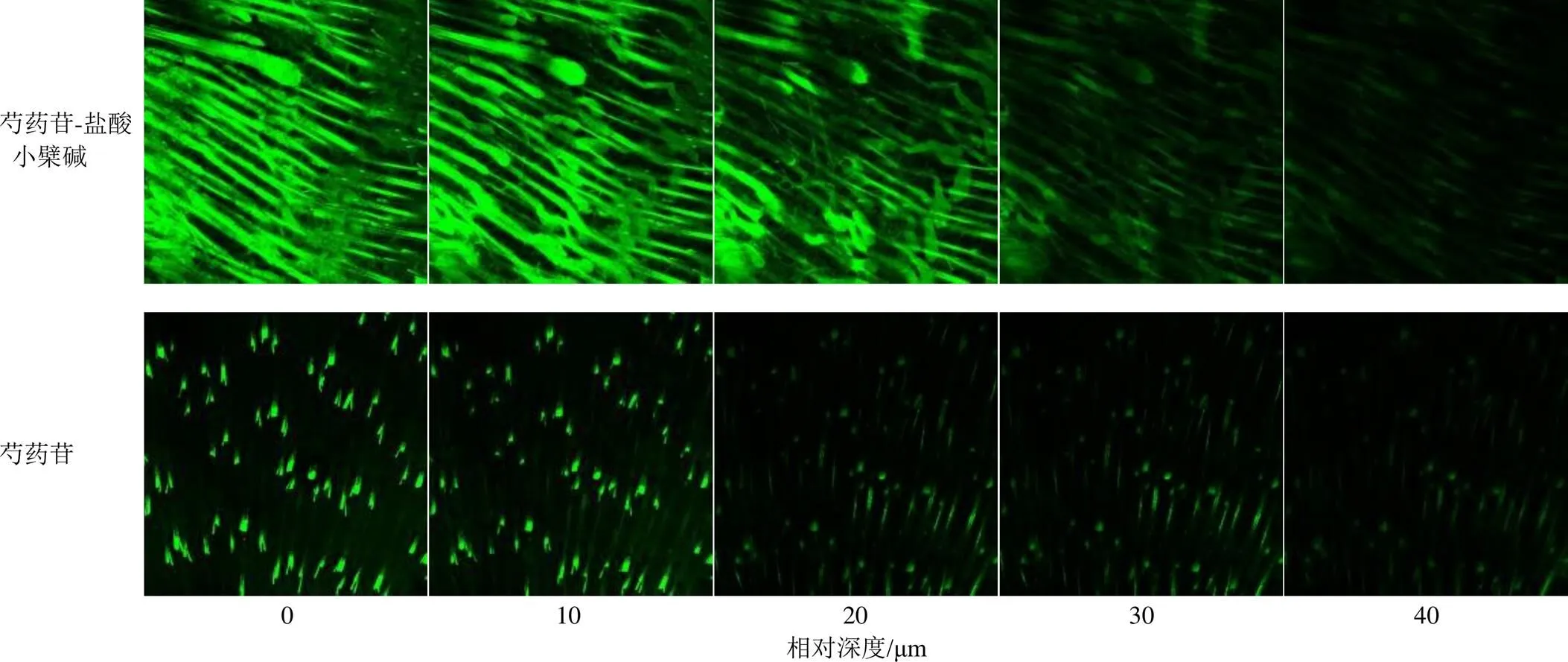
图5 经不同处理的小鼠皮肤对荧光素钠的通透性

图6 经不同处理的小鼠皮肤对尼罗红的通透性
3 讨论
本实验考察了黄连/黄柏、赤芍/白芍中的主要有效成分小檗碱、芍药苷在不同pH值条件和配伍比例下经皮吸收行为的变化规律。盐酸小檗碱及芍药苷均在pH 5.0的介质中透皮吸收效果最佳。此外,课题组前期还探讨了两者在pH 10.8条件下的透皮吸收情况,发现盐酸小檗碱在pH 10.8的条件下透皮吸收最好,其次是pH 5.0,这可能与其在pH>10的碱性溶液中以不大稳定的氮杂缩醛的形式存在,极性大大降低,油水分配系数增大有关[18]。值得注意的是实验过程中发现芍药苷在碱性条件下不稳定,且随着pH值的升高,水解反应加速[19],芍药苷中的苯甲酸酯键键能很低,在pH 10.8强碱性条件下易断裂生成去苯芍药苷和苯甲酸[20]。通过SEM观察到pH 10.8的介质对皮肤角质层产生了较为明显的破坏作用,可能产生皮肤刺激性等问题。综合考虑芍药苷和盐酸小檗碱在不同pH值下的稳定性、透皮性能及皮肤刺激性等问题,最终确定pH 5.0为最佳pH值。

图8 芍药苷与神经酰胺的分子对接结果
在确定最佳pH值之后,进一步考察了芍药苷-盐酸小檗碱不同配伍比例下对芍药苷经皮吸收行为的影响,研究发现芍药苷与盐酸小檗碱配伍后,芍药苷累计透过量和皮肤滞留量均有所增加,其中高浓度配伍组较芍药苷单独给药组之间的透皮吸收存在极显著差异(<0.01),确证了盐酸小檗碱对芍药苷的促渗效应,在此基础上,进一步探讨其促渗机制。相关促透机制可能一方面与配伍可使皮肤表面的光滑度下降,角质细胞间隙明显增大,皮表裂隙清晰可见,角质细胞叠瓦式结构松动,配伍可通过调控角质层紧密连接,进而易化皮肤转运阻力而产生促渗效应。另一方面,配伍能显著增加荧光素钠及尼罗红的渗透强度及深度,推测配伍可通过调控皮肤通透性从而产生促渗效应。
在此基础上,进一步开展分子对接模拟研究,选择了皮肤角质层脂质的主要成分:神经酰胺1、3、6、7、胆固醇、游离脂肪酸C24、C26,将盐酸小檗碱及芍药苷与上述成分进行分子对接,结果显示盐酸小檗碱及芍药苷均未与胆固醇、游离脂肪酸C24、C26形成分子间氢键,但两者均可与神经酰胺1、3、6、7以氢键形式结合,盐酸小檗碱与神经酰胺结合的亲和力大于芍药苷与神经酰胺的亲和力,推测可形成竞争性氢键效应,使更多的芍药苷摆脱皮肤脂质氢键网络的束缚,使芍药苷游离出来进而促进芍药苷的经皮吸收。本研究从药物与皮肤相互作用的角度研究盐酸小檗碱对芍药苷的促透规律及机制,为芍药苷经皮给药制剂的开发提供新视角,为含黄连/黄柏、赤芍/白芍中药外用制剂组方提供理论指导,同时为新型潜在中药经皮促透剂的开发充实基础。然在促渗机制研究部分还不够全面深入,如配伍前后改变药物在角质层的分配[21]、对角质层内角蛋白和脂质的分子结构及成分含量的影响[22-23]等仍需进一步的探索。
利益冲突 所有作者均声明不存在利益冲突
[1] 清·吴尚先著. 孙洪生校注. 理瀹骈文 [M]. 北京: 中国医药科技出版社, 2011: 39-155.
[2] 陈美琳, 李芝奇, 范琦琦, 等. 小檗碱药理作用及其相关作用机制研究进展 [J]. 中草药, 2022, 53(18): 5861-5872.
[3] 林青薇, 李沛波, 吴灏, 等. 盐酸小檗碱的心血管药理活性研究进展 [J]. 药学研究, 2022, 41(2): 117-121.
[4] 李江兰, 朱咏君. 盐酸小檗碱外涂治疗新生儿脓痱子疗效观察 [J]. 中国现代医学杂志, 2010, 20(13): 2067.
[5] 马骥. 盐酸小檗碱外用对糖尿病创面愈合的作用及机制研究 [D]. 南京: 南京中医药大学, 2021.
[6] 张育贵, 张淑娟, 边甜甜, 等. 芍药苷药理作用研究新进展 [J]. 中草药, 2019, 50(15): 3735-3740.
[7] 孔雪, 史冬梅. 芍药苷在皮肤科的应用及机制探讨 [J]. 中国中西医结合皮肤性病学杂志, 2018, 17(5): 473-476.
[8] 吴和霏, 章方玲, 邓昕雨, 等. 芍药苷通过调控肠道菌群改善α-异硫氰酸酯诱导胆汁淤积大鼠的作用机制研究 [J]. 中草药, 2022, 53(22): 7091-7101.
[9] 李芸, 魏舒畅, 刘永琦, 等. 不同生物碱透皮吸收促进剂对芍药苷透皮吸收的影响 [J]. 北京中医药大学学报, 2014, 37(6): 410-413.
[10] Vávrová K, Lorencová K, Klimentová J,. Transdermal and dermal delivery of adefovir: Effects of pH and permeation enhancers [J]., 2008, 69(2): 597-604.
[11] 中国药典[S]. 四部. 2020: 425.
[12] 金晨, 陈家乐, 徐玲霞, 等. 马钱子总碱脂质液晶纳米粒的制备和体外评价研究 [J]. 中草药, 2018, 49(22): 5305-5312.
[13] 杨清云, 刘敏臣, 羊健, 等. 闹羊花素III体外经皮渗透特性研究 [J]. 中国药学杂志, 2022, 57(20): 1750-1755.
[14] 杨华生, 黎晓丽, 吴维刚, 等. 在体皮肤微透析分析制川乌-白芍配伍对芍药苷局部药代动力学的影响 [J]. 中国实验方剂学杂志, 2017, 23(9): 80-84.
[15] Zheng L Y, Zhao Z Y, Yang Y,. Novel skin permeation enhancers based on amino acid ester ionic liquid: Design and permeation mechanism [J]., 2020, 576: 119031.
[16] Li Y, Wang C Y, Wang J,. Permeation-enhancing effects and mechanisms of-acylterpineol on isosorbide dinitrate: Mechanistic insights based on ATR-FTIR spectroscopy, molecular modeling, and CLSM images [J]., 2019, 26(1): 107-119.
[17] 陈阳. 不饱和薄荷醇类似物脂肪酸酯类两亲性经皮吸收促进剂促透活性研究 [D]. 沈阳: 沈阳药科大学, 2014.
[18] 陆秀玲, 胡雄彬, 向小四, 等. pH值对盐酸小檗碱表观油水分配系数的影响 [J]. 中南药学, 2011, 9(10): 748-751.
[19] 罗娟, 呼延玲, 刘晓玲. 溶液pH对芍药苷稳定性的影响 [J]. 中国药业, 2011, 20(2): 26-27.
[20] 梁红宝, 关永霞, 马素燕, 等. 芍药苷碱水解工艺及产物抗炎活性研究 [J]. 食品与药品, 2017, 19(2): 121-123.
[21] Nan L Y, Liu C, Li Q Y,. Investigation of the enhancement effect of the natural transdermal permeation enhancers fromL. var.N. Busch.: Mechanistic insight based on interaction among drug, enhancers and skin [J]., 2018, 124: 105-113.
[22] 王晶, 张金伟, 张艺蓉, 等. 丁香酚酯及肉桂醇酯对氟比洛芬透皮吸收的影响 [J]. 世界科学技术—中医药现代化, 2023, 25(5): 1796-1802.
[23] 管咏梅, 王舒慧, 胡育森, 等. 雷公藤甲素二元醇质体凝胶的皮肤药动学研究 [J]. 中草药, 2022, 53(3): 720-725.
Transdermal permeation law and permeation mechanism of paeoniflorin by berberine hydrochloride
ZOU Jia1, 3, YAO Zhang-hong1, ZHENG Qi-xiang4, GUAN Yong-mei1, CHEN Li-hua1, ZHU Wei-feng1, LIU Li-li1, 2
1. Key Laboratory of Modern Preparation of Traditional Chinese Medicine, Ministry of Education, Jiangxi University of Chinese Medicine,Nanchang 330004, China 2. School of Pharmacy,Jiangxi University of Chinese Medicine, Nanchang 330004, China 3. Jiangxi University of Technology, Nanchang 330098, China 4. Class 19 Chinese Medicine Research Practice Class, Jiangxi University of Chinese Medicine, Nanchang 330004, China
To investigate the effect of berberine hydrochloride on transdermal permeation behavior of paeoniflorin, screen the best penetration promoting conditions and explore the penetration promoting mechanism.A modified Franz diffusion cell method was used to select suitable supply and receiving solutions to explore the optimal permeation-promoting conditions and rules for berberine hydrochloride to promote transdermal permeation of paeoniflorin; Scanning electron microscopy, confocal laser scanning microscopy and molecular simulation were used to investigate the mechanism of permeation promotion.The 20% ethanol-pH 7.4 phosphate buffer solution (PBS) was selected as the receiving solution, and the best transdermal effect of berberine hydrochloride - paeoniflorin was achieved under the media condition of pH 5.0, and the 24 h cumulative permeation (24) of paeoniflorin was increased by 78.03%, 44.73%, and 35.63% in the high, medium and low concentrations of paeoniflorin paired with berberine hydrochloride under this condition, respectively. The24of paeoniflorin in the high concentration combination group was significantly different (< 0.05) compared with the paeoniflorin alone administration group, and the transdermal rate of paeoniflorin increased significantly with a pro-permeation ratio of 1.74. The results of the study onpermeation promoting mechanism showed that berberine hydrochloride could loosen the stacked tile structure of the neat and tightly stacked arrangement of the stratum corneum, and the surface folds were significantly increased and deepened; Berberine hydrochloride could promote the permeation of the water-soluble component sodium fluorescein and lipid-soluble nile red in the skin, and the amount and depth of skin permeation were increased. Berberine hydrochloride can competitively bind to the head of stratum corneum lipids, freeing paeoniflorin from the hydrogen bonding network with skin lipids, and thus promoting the transdermal absorption of paeoniflorin.The optimal pH of paeoniflorin-berberine hydrochloride transdermal permeation is 5.0. Berberine hydrochloride can promote the transdermal absorption of paeoniflorin with concentration dependence, and the mechanism of promoting permeation may be that berberine hydrochloride promotes the transdermal permeation of paeoniflorin by modulating the tight junctions of stratum corneum to ease skin transport resistance, affecting skin permeability and competitively binding to the polar head of stratum corneum lipids.
paeoniflorin; berberine hydrochloride; component compatibility; transdermal permeation law; penetration promoting mechanism
R283.6
A
0253 - 2670(2023)22 - 7412 - 09
10.7501/j.issn.0253-2670.2023.22.017
2023-06-16
江西省教育厅科技计划重点项目(GJJ201201);江西高校省级示范研究生导师创新团队(中药资源开发与利用研究生导师创新团队);国家中医药管理局高水平中医药重点学科建设项目(中药药剂学)
邹 佳,在读硕士研究生,主要从事中药经皮给药研究。Tel: 18720189041 E-mail: ZJ1103@126.com
通信作者:朱卫丰,教授,博士生导师,主要从事中药经皮给药新剂型与新技术研究。E-mail: zwf0322@126.com
刘丽丽,副教授,硕士生导师,主要从事中药经皮给药研究。E-mail: liulili1985@163.com
[责任编辑 郑礼胜]