受精种蛋理化指标与光谱信息的响应关系
2023-11-26宋科潘磊庆杨崇龙石永宏屠康张伟
宋科,潘磊庆,杨崇龙,石永宏,屠康*,张伟
(1.南京农业大学食品科学技术学院,江苏 南京 210095;2.湖北九三零农牧有限公司,湖北 孝感 432699;3.宁夏九三零生态农牧有限公司,宁夏 银川 750205;4.南京晓庄学院食品科技学院,江苏 南京 211171)
在家禽领域中,种蛋是否受精与经济效益密切相关。据相关资料统计,在工业化养鸡产业中,种蛋受精率在90%左右[1],这说明仍然有大量种蛋不能孵化。在孵化过程中,如果不及时剔除未受精种蛋,不仅会增加孵化成本,降低产量,同时未受精种蛋的孵化很容易滋生细菌感染受精种蛋,从而影响种蛋孵化率[2-3]。传统的受精种蛋判别方法为光照法[4-5],这种方法耗时耗力,容易受到主观因素影响,且很难在孵化早期(1~5 d)实现检测[6-7]。因此,需要寻找一种快速、高效率、准确的种蛋受精判别方法。
在已有的研究中,光谱检测方法被广泛应用。种蛋在孵化过程中,胚胎逐渐发育,内部物质会发生一系列物理化学变化,而未受精种蛋几乎没有变化,这些差异同样能够反映在光谱值差异上,成为光谱法检测种蛋受精的基础[8-10]。张伏等[11]基于可见/近红外光谱技术,建立不同位置、不同预处理方法的PCA-SVM(主成分分析-支持向量机,principle component analysis-support vector machine)种蛋受精判别模型,结果表明,在第5 天,经过Savitzkg-Golay(S-G)平滑和变量标准化(normalization)预处理方法处理后的赤道侧位置判别率达到最高,为91.71%。相比于近红外光谱技术,高光谱技术具有“图谱合一”的特点,而且高光谱技术还能获取种蛋整体的信息,而不是局部信息,获得的光谱信息更加全面[12-14]。Park等[15]通过线扫描高光谱技术获取种蛋图像,使用主成分分析筛选560 nm波段图像纹理特征实现受精种蛋的判别,最终判别率达到99%。但以上研究均是以光谱或图像信息差异为基础实现种蛋受精的判别,对于种蛋发育过程中,哪些理化指标的变化会引起光谱或图像信息差异以及各种理化指标与光谱信息之间的响应关系却鲜有研究。因此,本研究以海兰灰种鸡蛋为研究对象,采集400~1 000 nm波长范围的种蛋大头部位高光谱图像,同时测定种蛋孵化过程中各理化指标(如蛋白质、脂肪等)的变化,分析受精与未受精种蛋孵化前期理化指标变化的差异,确定有显著性差异的理化指标;探究各理化指标与光谱信息的响应关系,筛选特征波段,建立种蛋受精的判别模型,为高光谱技术无损检测种蛋受精提供新的数据信息。
1 材料与方法
1.1 材料与仪器
海兰灰白壳种鸡蛋购于湖北九三零农牧有限公司。
试剂:浓硫酸、五水合硫酸铜、硫酸钾、氢氧化钠、硼酸、石油醚、乙醚,均为分析纯。
仪器:万盛WSGD-6型微电脑全自动孵化机购自南京万盛孵化设备有限公司;CR-13型便携式色差计购自日本柯尼卡美能达公司;精密pH计购自梅特勒-托利多国际贸易有限公司;SZF-06A脂肪测定仪购自上海昕锐仪器仪表有限公司;KjeltecTM8400凯氏定氮仪购自丹麦福斯分析仪器公司;可见-近红外高光谱成像系统(配ImSpector V10E成像光谱仪)购自芬兰Specim公司;ICLB1620CCD摄像机购自美国Imperx公司;IT3900ER卤素光源(150 W)购自美国Illumination Technologies公司。高光谱采集系统实物图如图1所示。

图1 高光谱采集系统实物图Fig.1 Physical diagram of hyperspectral acquisition system ①工业相机Industrial camera;②成像光谱仪Imaging spectrometer;③镜头Lens;④移动平台Moving platform;⑤卤素光源Halogen light source;⑥样品Sample.
1.2 方法
1.2.1 样本的处理试验前,挑选220枚大小一致[(60±5)g]、蛋壳无裂痕及壳色相近的种蛋并清洗干净,其中受精种蛋与未受精种蛋各110枚,使用75%乙醇消毒晾干后放入孵化箱中进行孵化,孵化温度为37.8 ℃,相对湿度为60%,每2 h自动翻转1次。在孵化0~4 d,每天挑选10枚受精蛋与10枚未受精蛋采集种蛋大头部位高光谱透射图像。采集完图像后去壳,将其内含物混匀测定理化指标。剩余的120枚种蛋(60枚受精种蛋,60枚未受精种蛋)同样采集0~4 d高光谱图像,每天采集1次,其数据用于后续建模分析。
1.2.2 蛋白质含量的测定参考《食品中蛋白质的测定:GB 5009.5—2016》,采用自动凯氏定氮仪法进行蛋白质含量测定,每个样品重复3次。
1.2.3 脂肪含量的测定参考《食品中脂肪的测定:GB 5009.6—2016》,采用索氏抽提法进行脂肪含量的测定,每个样品重复3次。
1.2.4 水分含量的测定参考《食品中水分的测定:GB 5009.3—2016》,采用直接干燥法进行水分含量的测定,每个样品重复3次。
1.2.5 pH值的测定用pH计测量混匀蛋液的pH值,每个样品重复测量3次,取平均值。
1.2.6 颜色参数的测定使用色差仪测量0~4 d受精与未受精种蛋混匀后蛋液的L*、a*、b*值,每个样品测量3次,取其平均值。
1.2.7 高光谱图像采集及校正利用线扫描方式采集种蛋高光谱透射图像。种蛋钝端大头朝上、锐端小头朝下放置,光源位于其正下方,光谱相机位于样品正上方,距离种蛋大头30 cm。采集图像之前,提前打开仪器及其光源预热30 min,将光源发热对采集图像的影响降到最低。每个样品采集时间约为30 s,采集完图像后立即将样品放回孵化箱中继续孵化。另外为了保证采集的高光谱图像质量,试验前需要对曝光时间、平台移动速度、光源强度等参数进行优化。经过调试,最终确定图像分辨率为440*804,光谱分辨率为2.8 nm,曝光时间为72 ms,采集速度为1.5 mm·s-1,光源颜色为黄色,色温范围为1 500~3 500 K,光源强度为90 W。
高光谱图像采集过程中会产生一些噪声、暗流等,为了消除这些对图像质量的影响,在每天试验前对图像进行一次黑白板校正处理。获取全白和全黑透射图像后,根据如下公式得到相对透射图像:
R=(R0-B)/(W-B)。
式中:R为校正后的高光谱图像;R0为原始图像;B为全黑透射图像;W为全白透射图像。
1.2.8 光谱信息提取以种蛋大头部位为分析对象,选择689 nm波长下的光谱灰度图像,因为在此波长下,其背景和样本的光谱透射值相差最大[16-18],进一步去除背景和二值化阈值分割,最后得到相对透射值用于后续建模分析。
1.2.9 模型建立与评估通过分析理化指标与光谱波段的透射率之间的相关性,筛选出特征波段,建立400~1 000 nm全波段范围种蛋受精的偏最小二乘判别分析(partial least squares-discriminant analysis,PLS-DA)和支持向量机(support vector machine,SVM)判别模型以及特征波段范围的受精判别模型,最后通过模型建模集和预测集正确率对模型进行评估。
1.3 数据处理
使用Excel 2016软件整理数据;使用SPSS 18.0软件进行显著性分析、相关性分析;使用Word 2016软件制作表格;使用Origin 2018软件绘图;高光谱数据提取,后续建模使用MatlabR2010b软件分析。
2 结果与分析
2.1 0~4 d受精与未受精种蛋蛋白质和脂肪含量变化
如图2-A所示:在孵化0~4 d,未受精种蛋蛋白质含量几乎没有变化,均为11.50%左右。而受精种蛋随着孵化时间的增加,蛋白质含量不断增加,在3 d后其含量显著提升,4 d时含量达到最高。在孵化0~2 d,受精种蛋与未受精种蛋蛋白质含量没有明显差异,在孵化3~4 d,受精种蛋蛋白质含量显著高于未受精种蛋。可能是因为在孵化过程中,受精种蛋胚胎逐渐发育,伴随一些组织器官的生成,导致其蛋白质含量不断增加;而未受精种蛋没有胚胎发育,其蛋白质含量基本不变。
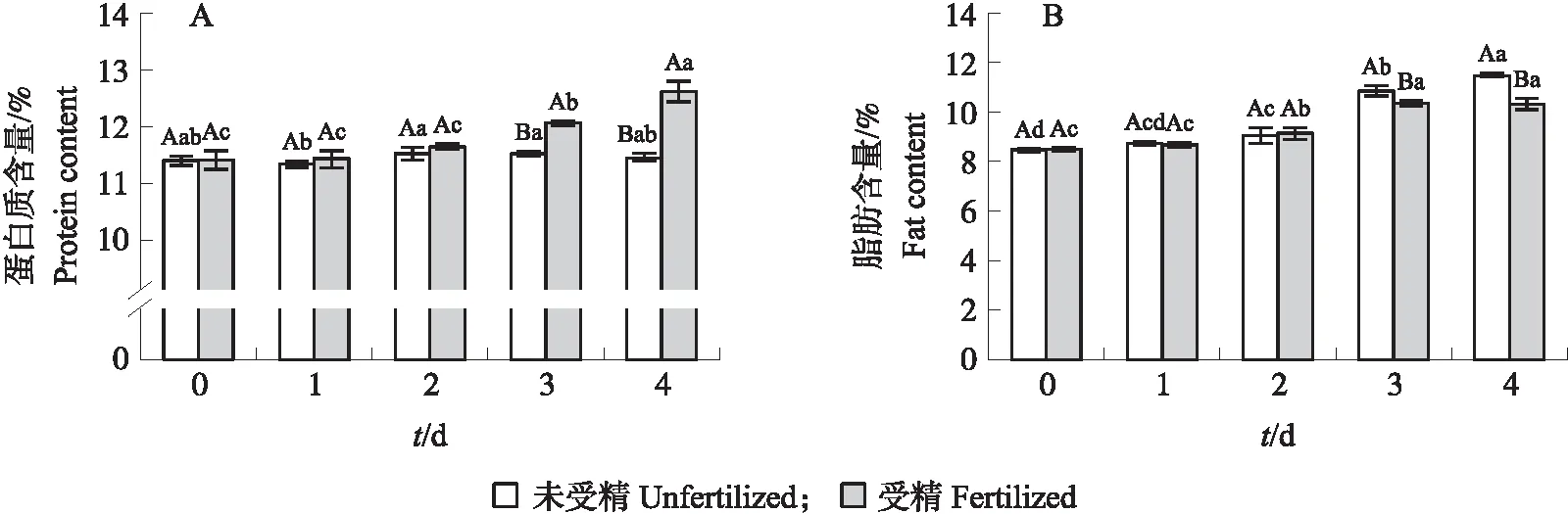
图2 0~4 d受精与未受精种蛋蛋白质(A)和脂肪(B)含量变化Fig.2 Changes in protein(A)and fat(B)contents of fertilized and unfertilized eggs from 0 to 4 d 不同大写字母表示同一天受精与未受精种蛋显著差异;不同小写字母表示0~4 d受精与未受精种蛋组间显著差异(P<0.05)。下同。Different capital letters indicate significant differences between fertilized and unfertilized breeding eggs on the same day;different lowercase letters indicate significant differences between fertilized and unfertilized breeding egg groups from 0 to 4 d(P<0.05). The same as follows.
从图2-B可见:孵化0~4 d,未受精种蛋脂肪含量呈不断上升趋势;而受精种蛋脂肪含量在0~1 d无明显变化,2~3 d明显上升,3~4 d无明显变化。在孵化0~2 d,受精与未受精种蛋脂肪含量无明显差异;在孵化3~4 d,未受精种蛋脂肪含量明显高于受精种蛋。这种趋势可能是由于孵化过程中,在孵化温度下,种蛋内部水分含量减少的缘故,导致种蛋内脂肪含量的整体比例呈现上升趋势;但由于受精种蛋胚胎的发育,其部分脂肪会转化为胚体发育所需物质,因此脂肪含量在孵化3~4 d低于未受精种蛋。
2.2 0~4 d受精与未受精种蛋水分含量的变化
如图3所示:受精与未受精种蛋在入孵前的水分含量最高,随着孵化时间的增加,其水分含量逐渐降低,在4 d时达到最低。在孵化0~4 d,受精种蛋与未受精种蛋水分含量并无明显差异。在孵化过程中,其孵化温度为37.8 ℃,温度较高,种蛋(受精或未受精组)内水分会逐渐挥发,导致其水分含量降低。
2.3 0~4 d受精与未受精种蛋pH值的变化
由图4可见:孵化0~2 d,受精蛋与未受精蛋pH值随着孵化时间延长而缓慢上升,而在孵化2~4 d,未受精种蛋pH值继续上升,在4 d时达到最高;受精种蛋pH值开始下降,在4 d时最低。相比较受精与未受精种蛋0~4 d 的pH值,在0~1 d,两者差异不明显;在2~4 d,未受精种蛋pH值明显大于受精种蛋。
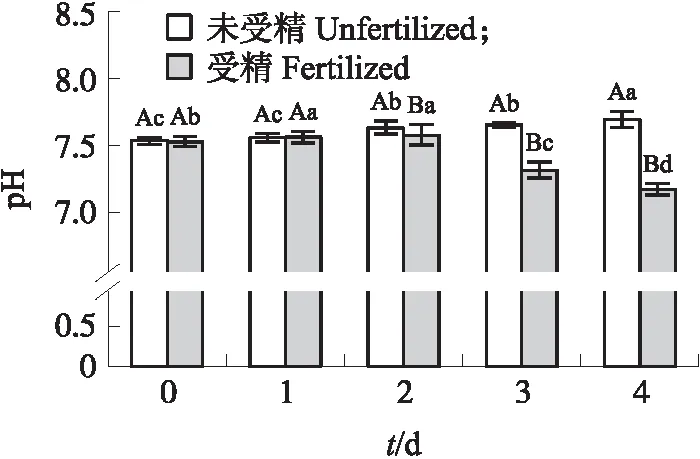
图4 0~4 d受精与未受精种蛋pH值变化Fig.4 Change in pH value of fertilized and unfertilized breeder eggs from 0 to 4 d
2.4 0~4 d受精与未受精种蛋颜色参数的变化
由图5可见:在孵化0~4 d,未受精和受精种蛋L*值都没有发生明显变化。b*值在0 d时最高,1~3 d没有明显变化,在4 d时最低,且两者之间没有明显差异。受精种蛋a*值在孵化0~1 d没有明显变化,在2~4 d开始逐渐上升;而未受精种蛋a*值在0~4 d没有明显变化,在2~4 d明显低于受精种蛋。

图5 0~4 d受精与未受精种蛋L*、a*、b*值变化Fig.5 Variation of L*,a* and b* values of fertilized and unfertilized breeder eggs from 0 to 4 d
如图6所示:受精种蛋在0~1 d发育较为缓慢,没有表现出明显的胎相;而在孵化2 d时,胚胎开始形成一圈肉眼可见的由血丝构成的网状结构;到3~4 d,网状结构逐渐扩大,胚胎血丝增多,并且可以看到明显的胚胎雏形。
2.5 受精与未受精种蛋理化指标与光谱信息的响应关系分析
由图7可见:在400~1 000 nm范围内,受精与未受精种蛋的平均相对透射率的总体趋势是相似的。在孵化0~4 d,未受精种蛋的光谱值没有明显变化。种蛋随着孵化时间的延长,受精种蛋胚胎发育,导致其透光性降低,光谱波段的透射率呈逐渐下降趋势,在4 d时达到最低。
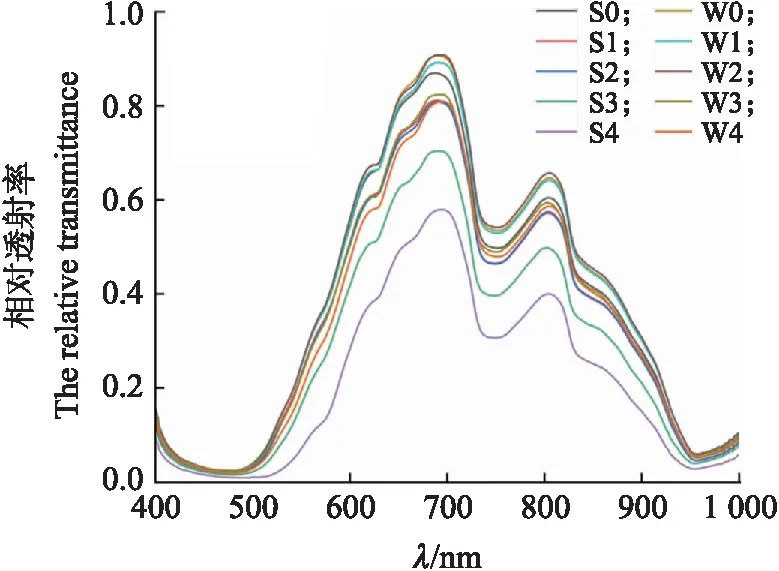
图7 0~4 d受精(S)和未受精(W)种蛋平均相对透射光谱Fig.7 Average relative transmission spectra of fertilized(S)and unfertilized(W)breeder eggs from 0 to 4 d S0表示受精种蛋0 d(S1—S4表示1~4 d)的平均相对透射光谱,W0表示未受精种蛋0 d(W1—W4表示1~4 d)的平均相对透射光谱。S0 represents the average relative transmission spectra of fertilized breeder eggs at 0 d(S1-S4 indicate 1-4 d)and W0 represents the average relative transmission spectra of unfertilized breeder eggs at 0 d(W1-W4 indicate 1-4 d).
通过上述结论可知,受精和未受精种蛋在孵化0~4 d,蛋白质、脂肪、pH值和a*值这4种理化指标存在明显差异,为了探究受精种蛋理化指标与光谱波段的透射率之间的响应关系,筛选特征波段,分别将以上4种理化指标与其光谱波段的透射率做进一步相关性分析。
图8所示为0~4 d受精种蛋4种理化指标和其光谱波段的透射率的相关性分析。在孵化0~4 d,受精种蛋蛋白质、脂肪含量和a*值呈逐渐上升趋势;pH值0~2 d缓慢上升,2~4 d开始下降。因此,蛋白质、脂肪和a*值这3种理化指标与光谱波段的透射率呈负相关关系;pH值理化指标与光谱波段的透射率呈正相关关系。为了挑选出最能代表受精种蛋光谱信息的特征波段,根据相关系数绝对值大小,每个理化指标分别筛选出5、10、15和20个特征波段,最后共分别筛选出20、40、60和80个特征波段用作后续建模分析。
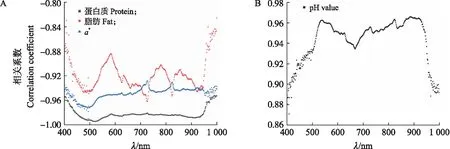
图8 蛋白质、脂肪和a*值(A)以及pH值(B)与光谱波段透射率相关系数Fig.8 Correlation coefficients between protein,fat,a*values(A)and pH values(B)with spectral band transmittance 图中每一点表示在孵化0~4 d受精种蛋某理化指标与其光谱在此波段下透射率的相关系数。Each point in the graph indicates the correlation coefficient between a physical and chemical index of fertilized eggs at 0-4 d of incubation and the transmittance of their spectra at this band.
2.6 模型建立与评估
将剩余120枚种蛋(60枚受精种蛋,60枚未受精种蛋)按照2∶1比例分为建模集与预测集。建模集中受精与未受精种蛋各40枚,预测集中受精与未受精种蛋各20枚。通过分析蛋白质、脂肪、a*值和pH值这4种理化指标与光谱信息的响应关系,分别筛选出20、40、60和80个特征波段,建立0~4 d全波段范围的PLS-DA和SVM受精判别模型以及特征波段范围的受精判别模型。
由表1和表2可知:在孵化0~4 d,随着孵化时间延长,种蛋受精判别模型准确率呈现上升趋势,在0~1 d,模型准确率较低,这主要是因为前期受精种蛋发育较为缓慢,蛋白质、脂肪等理化指标也并没有明显的变化,与未受精种蛋没有明显差异,导致其与未受精种蛋的光谱信息差异不大,准确率较低。从2 d开始,受精种蛋胚胎开始形成血细胞,种蛋内部理化指标发生一列物理化学变化,物质开始互相转换,蛋白质、脂肪含量显著上升等,并且与未受精种蛋有显著性差异,与之响应的光谱值也会存在一定差异,导致模型判别率逐渐上升, 在4 d时基于PLS-DA模型的建模预测集准确率最高,达到了100.00%。因此后续继续基于PLS-DA算法建立特征波段范围的受精判别模型,相比于全波段建模,特征波段数为20和40时建模预测集准确率较低,波段数为60和80时建模预测集准确率达到最高,为97.50%,准确率下降了2.50%,这可能是因为种蛋胚胎发育过程中,发生一系列物质转换代谢,除了上述4种理化指标与未受精种蛋有明显差异,还包括其他的理化指标变化,如氨基酸代谢、胆固醇代谢等,导致上述特征波段代表的受精种蛋信息有所缺失,进一步导致准确率下降。因此基于60个特征波段建模的预测效果最佳,其特征波段分别为:蛋白质:511~531 nm;脂肪:713~716 nm、719~730 nm、822~825 nm;a*值:464 nm、471 nm、479 nm、483~494 nm、497~500 nm;pH值:881~896 nm、900~902 nm、904 nm、918 nm。
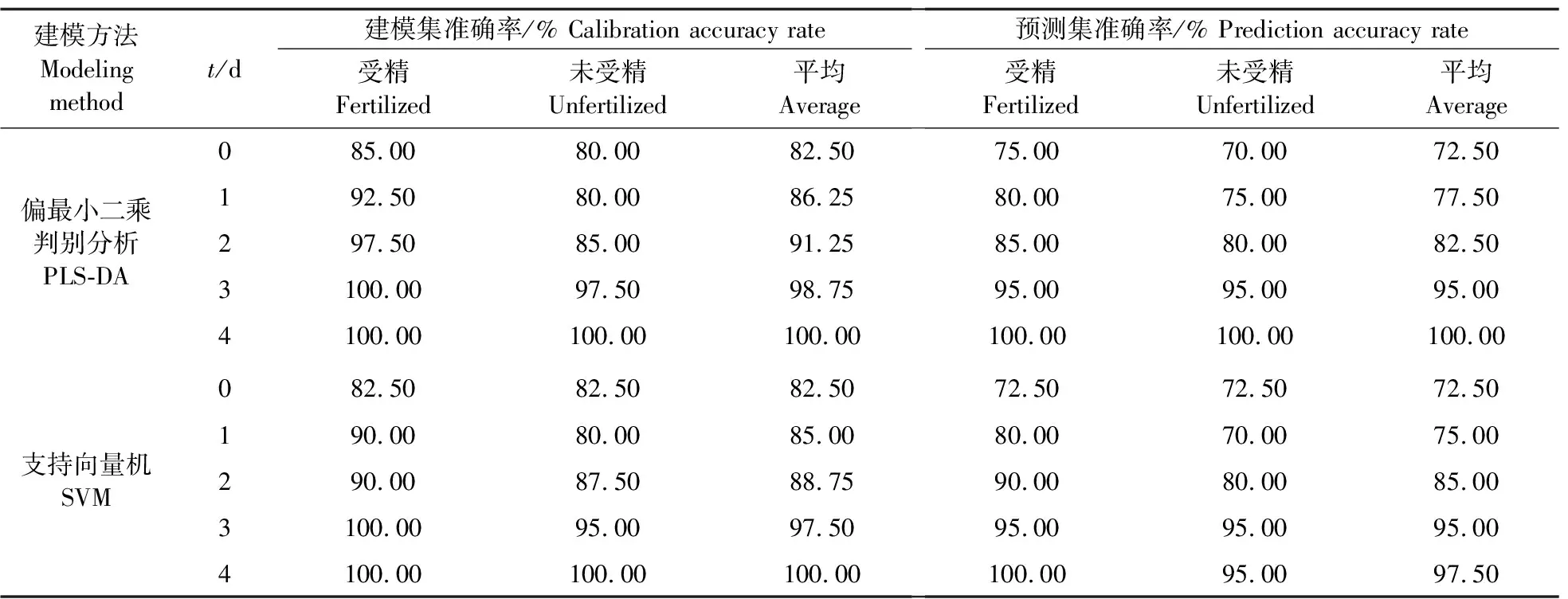
表1 0~4 d全波段范围的受精种蛋判别模型Table 1 Discriminant model of fertilized breeder eggs in the full band range from 0 to 4 d
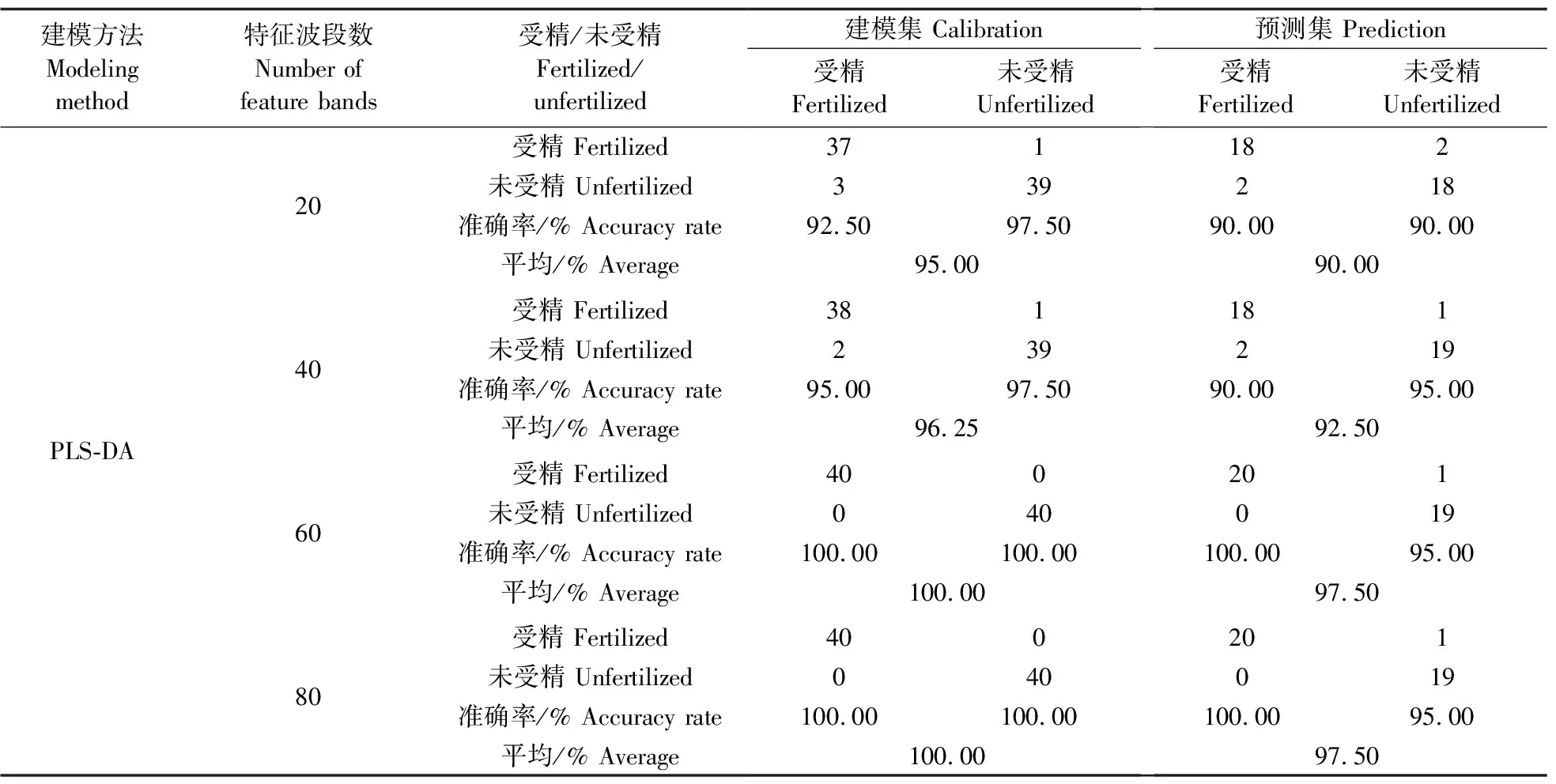
表2 4 d时特征波段范围的PLS-DA受精种蛋判别模型Table 2 Discriminant model of PLS-DA fertilized breeder eggs in the characteristic band range at 4 day
3 讨论与结论
种蛋胚胎的发育主要分成3个阶段。第1阶段:形成胚胎雏形,绒毛膜囊和尿囊;第2阶段:胚胎发育完成阶段;第3阶段:孵化准备阶段,即雏鸡准备出壳[19-20]。在孵化0~4 d,胚胎主要处于第1阶段,即发育准备阶段。发育前期,胚胎会发生一系列理化指标变化,如水分、pH值、蛋白质、脂肪等。在孵化温度下,种蛋内部的水分含量会逐渐减少[21]。祝志慧等[22]对0~4 d白莱航受精与未受精种蛋pH值变化趋势展开研究,发现在孵化2~4 d,受精种蛋pH值与未受精种蛋存在显著性差异,这与本研究结果一致。蛋白质作为胚胎发育所必需的营养物质,为后期胚胎发育更好地吸收营养等,在发育前期蛋白质含量会逐渐增加,其主要作用为:作为胚体器官组织的组成成分,如心脏、血液等,a*值越大,表示越红,在孵化2 d时,胚胎心脏开始跳动,逐渐形成红细胞,生成血管[23-24]。随着孵化时间的延长,其血液会逐渐增多,导致a*值逐渐上升;分解生成一系列发育所需要的氨基酸,如具有多种营养生理功能的谷氨酸[25-26];作为一种屏障,防止发育过程中的微生物污染,具有免疫防御作用,让胚体能够正常生长[27]。张丽静等[28]的研究发现,鸡胚发育过程中,在孵化0~5 d,其蛋白质含量、总氨基酸含量和游离氨基酸含量均呈现上升趋势,本研究结果与之相一致。同样,脂肪也是胚胎前期发育的重要营养物质,随着胚胎发育,胚体内脂肪会逐渐消耗,进行一系列物质转换,如生成蛋白质、氨基酸及碳水化合物等一系列胚胎生长发育所需要营养物质。另外,脂肪也是胚体发育的能量主要来源之一,不断为胚体所吸收,保证胚胎的正常发育[29-30]。高光谱技术具有同时检测样品内外信息的优点,理化指标的变化可以通过光谱透射率的差异一一体现,这是高光谱技术实现种蛋受精判别的基础。刘美辰等[31]基于高光谱技术建立牛奶中蛋白质含量的SVM预测模型,最终结果显示建立的模型预测集决定系数R2为0.999 6,均方根误差RMSE为0.001 1。付丹丹等[32]采集鸡蛋高光谱透射图像,建立鸡蛋新鲜度、pH值和黏度的多元线性回归(multiple linear regression,MLR)模型,结果显示,建立的鸡蛋新鲜度、pH值和黏度的相关系数R2分别为0.94、0.95、0.95,RMSE分别为6.37、0.17、149,达到较好效果。这进一步说明了光谱信息可以反映种蛋理化指标变化的可行性。
本研究基于高光谱技术(400~1 000 nm)对种蛋孵化前期理化指标与光谱信息的响应关系展开了探究,采用海兰灰白壳种蛋,透射采集模式,卤素光源颜色为黄色,色温较低,种蛋蛋壳颜色对光谱信息采集影响较小,且色温越低,光源穿透能力越强,因此光谱信息能够很好地反映种蛋内部的信息。在试验前期,首先测定受精与未受精种蛋孵化0~4 d蛋白质、脂肪、水分含量以及pH值、颜色参数的变化,同时采集其高光谱图像,发现在孵化0~4 d,受精种蛋蛋白质、脂肪、a*值与pH值这4种理化指标与未受精种蛋存在显著差异;其次,对受精种蛋理化指标与光谱波段的透射率进行相关性分析,发现蛋白质、脂肪和a*值与各光谱波段的透射率呈负相关关系,pH值与各光谱波段的透射率呈正相关关系,分别筛选出20、40、60和80个特征波段;最后,建立0~4 d全波段范围的PLS-DA及SVM受精判别模型,发现4 d时基于PLS-DA模型的预测集准确率达到最高,为100.00%。这表明PLS-DA比SVM更适合受精种蛋的无损检测,分析原因是SVM对参数和核函数的选定且对噪声变量敏感,模型预测的性能易受到影响[33],而PLS-DA主要目的为寻找关联程度最大的自变量和因变量组合,能够更好解释因变量的变异信息[34]。相比于全波段建模,基于60个特征波段建模预测集准确率达到最高,为97.50%,显然比全波段建模下降了2.50%,但特征波段只有60个波段,占全波段14.29%,大大减少了模型的运算量,简化了模型;且其预测集误判数只有1个,说明与各理化指标相关的特征波段能够很好地代替全波段光谱信息,达到准确判别种蛋受精的效果。与张扶等[11]结果相比,准确率提高了5.79%,且判别时间提前了1 d,说明基于高光谱技术建立的与理化指标相关的特征波段范围的PLS-DA模型具有一定优越性,且光谱信息能够很好地反映理化指标的变化。与Park等[15]的结果相比,准确率下降,可能是由于本研究测定的理化指标并不完全,与之响应的能够代表受精种蛋的特征波段信息有所缺失,导致准确率下降。
综上所述,本研究为高光谱技术检测种蛋受精提供了更多的品种数据信息,后续可以进一步测定种蛋孵化过程中更多理化指标,筛选出最具代表性的受精种蛋信息的特征波段,提高模型准确率。
