乳酰-N-新四糖的生物合成菌株构建及发酵条件研究
2023-11-26骆叶姣胡苗苗李梦丽张涛
骆叶姣,胡苗苗,李梦丽,张涛
(食品科学与技术国家重点实验室,江南大学,江苏 无锡,214122)
人乳寡糖(human milk oligosaccharides,HMOs)由于对婴幼儿具有独特营养功能而被广泛研究,是人乳中仅次于乳糖和脂肪的第三大固形物含量物质[1],成熟乳中人乳寡糖含量约为10~15 g/L,人初乳中人乳寡糖含量约为20~24 g/L[2]。目前2′-岩藻糖基乳糖以及乳酰-N-新四糖(lacto-N-neotetraose,LNnT)等多种人乳寡糖作为营养强化剂被应用于商业化生产的婴幼儿配方奶粉中[3]。
LNnT是人乳寡糖中含量相对较高的成分之一[4],属于非岩藻糖基化的中性母乳寡糖,具有免疫调节[5]、肠细胞反应调节剂[6]和促进细胞成熟[7-9]等生理功能。
目前,LNnT的生产主要包括化学合成[10-11]、酶法合成和微生物发酵法[12]3种方法,酶法合成往往需要添加昂贵的前体物质,但生物合成法可利用廉价可再生底物,具有清洁、绿色、高效等特征,因此具有更为广阔的应用前景[13]。
通过绿色生物过程利用廉价生物质生产高附加值产品是实现碳中和及环境友好经济的重要途径。随着代谢工程和合成生物学的发展,绿色、高效、安全型底盘微生物的开发成为解决HMOs规模化生产和应用的关键。当前,乳酰-N-新四糖生产菌株常见于大肠杆菌[14],报道较少且产量偏低。
本研究旨在利用合成生物学手段,在通过CRISPR-Cas9系统[15]敲除β-半乳糖苷酶基因lacZ[16]和UDP-N-乙酰氨基葡萄糖-2-差向异构酶基因wecB消除竞争抑制途径,减少底物乳糖和相关前体尿苷二磷酸-N-乙酰基葡萄糖胺的损失,弱化分支途径,使更多的碳流向乳酰-N-新四糖合成通路,有利于乳酰-N-新四糖的高效生物合成的基础之上,通过模块化LNnT通路关键基因的构建与组合[17],过表达关键基因尿苷二磷酸葡萄糖-4-差向异构酶基因galE、谷氨酰胺-果糖-6-磷酸氨基转移酶基因glmS、β-1,4-半乳糖基转移酶基因NmlgtB以及β-1,3-N-乙酰氨基葡萄糖氨基转移酶基因lgtA,上调从头合成途径的关键酶等策略实现产乳酰-N-新四糖的工程菌的构建和乳酰-N-新四糖的高效合成(如图1所示)。

图1 LNnT从头合成途径图Fig.1 Route diagram of LNnT de novo synthesis
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
实验所需基因lgtA和NmlgtB来源于大肠杆菌K12,glmS和galE来源于脑膜炎奈瑟球菌(Neisseriaceaemeningitidis),宿主BL21(DE3)ΔlacZΔwecB为本实验室保存菌株。
DNA产物、质粒的测序工作交予金唯智生物技术(苏州)有限公司完成。pCOLADuet-1、pACYCDuet-1、pCDFDuet-1、pETDuet-1,购自上海百风生物科技有限公司;载体pCas9、pTargetF,Addgene。
1.1.2 主要试剂及仪器
PrimeSTAR Max DNA Polymerase、QuickCut Enzyme,TaKaRa(大连)生物有限公司;一步克隆酶,南京诺唯赞生物科技有限公司;酵母提取物、Rapid Bacterial Genomic DNA Isolation Kit、Ultra-Competent Cell Preps Kit、琼脂粉、胰蛋白胨,生工生物工程(上海)股份有限公司;标准品LNnT,Carbosynth (Berkshire, UK);葡萄糖、柠檬酸及其他常用试剂均为国产分析纯。
Waters e2695高效液相色谱,美国Waters公司;高速落地离心机、电转仪,德国Eppendorf有限公司。
1.1.3 培养基
LB(Luria-Bertani)培养基(g/L):酵母提取物5,胰蛋白胨10,NaCl 10(固体培养基额外添加琼脂粉15~20 g/L)。
DM发酵培养基:甘油20 g/L,KH2PO413.5 g/L,酵母提取物10 g/L,柠檬酸1.7 g/L,(NH4)2HPO44.0 g/L,MgSO4·7H2O 1.4 g/L,微量金属溶液10 mL/L(柠檬酸三铁10 g/L,MgSO4·7H2O 2.25 g/L,CuSO4·5H2O 1.0 g/L, MnSO4·H2O 0.35 g/L,硼砂0.23 g/L,钼酸铵0.11 g/L,CaCl2.2H2O 2.0 g/L),pH 6.8。
根据菌株抗性在培养基中添加相应抗生素,后文无特殊说明均为以下质量浓度:氨苄青霉素(100 mg/L)、硫酸链霉素(50 mg/L)、链霉素(50 mg/L)、氯霉素(50 mg/L)、壮观霉素(50 mg/L)。
1.2 实验方法
1.2.1 重组质粒构建
游离表达lgtA、glmS、galE、NmlgtB。利用引物galE-F/galER和glmS-F/glmS-R(引物序列见表1,下同),获得galE和glmS基因片段,通过一步克隆酶连接到载体pACYDuet-1的相应酶切位点之间(BamH I/SaiI和BgiII/xho,下同),最终获得质粒pACY-glmS-galE。质粒pET-lgtA-NmlgtB构建方法同上。
将上述构建的重组质粒均转入大肠杆菌BL21(DE3)ΔlacZΔwecB,摇瓶发酵并定时取样,利用HPLC定量测定LNnT含量。
1.2.2 组合优化
以质粒pACY-glmS-galE为模板,利用引物glmS-galE-F/glmS-galE-R(引物序列见表2,下同)扩增出glmS-galE基因片段,构建方法参照1.2.1节,获得质粒pET-glmS-galE、pCDF-glmS-galE和pRSF-glmS-gal(相应酶切位点为BgiII/xhoI)。
以质粒pET-lgtA-NmlgtB为模板,利用引物lgtA-NmlgtB-F/lgtA-NmlgtB-R(引物序列见表2)扩增出lgtA-NmlgtB基因片段,构建方法同上,获得质粒pAC-lgtA-NmlgtB、pCDF-lgtA-NmlgtB和pRSF-lgtA-NmlgtB(相应酶切位点为BgiII/xhoI)。
将上述获得的质粒表达glmS-galE基因片段的质粒(pCDF-glmS-galE、pACY-glmS-galE、pRSF-glmS-galE、pET-glmS-galE)和表达lgtA-NmlgtB基因片段的质粒(pAC-lgtA-NmlgtB、pCDF-lgtA-NmlgtB、pRSF-lgtA-NmlgtB、pET-glmS-galE)进行组合,并转入构建的EL0大肠杆菌BL21(DE3)ΔlacZΔwecB,得到了12个不同的菌株,分别表示为SA1~SA12(表2)。摇瓶发酵并定时取样,利用HPLC定量测定LNnT含量。
1.2.3 摇瓶优化
1.2.3.1 培养基种类对LNnT产量的影响[18-20]
M9培养基(原始对照组):20 g/L甘油,12.8 g/L NaHPO4·7H2O,3 g/L KH2PO4,2 g/L NH4Cl,0.5 g/L NaCl,0.25 g/L MgSO4·7H2O,14.7 g/L CaCl2·2H2O,10 g/L Triton X-100(0.1%,体积分数),1 mL/L·微量金属溶液(25 g/L FeCl3·6H2O,2 g/L CaCl2·2H2O,2 g/L ZnCl2,2 g/L Na2MoO4·2H2O,1.9 g/L CuSO4·5H2O,0.5 g/L Н3BO3),pH 6.8。
M9CA培养基:20 g/L 甘油,13.3 g/L M9CA盐(上海生工生物工程股份有限公司,具体组分为:2.0 g/L Casamino Acid;6.8 g/L Na2HPO4;3.0 g/L KH2PO4;1.0 g/L NH4Cl;0.5 g/L NaCl),1.4 g/L MgSO4,10 mg/L盐酸硫胺素。
MOPS培养基:10×MOPS母液(/L):1 mol/L MOPS溶液400 mL,pH 7.4;1 mol/L Tricine 40 mL,pH 7.4;0.01 mol/L FeSO410 mL;1.90 mol/L NH4Cl 50 mL;0.276 mol/L K2SO410 mL;5.0×10-4mol/L CaCl2l0 mL;0.528 mol/L MgCl210 mL;5.0 mol/L NaCl 100 mL;微量元素:3×10-6mol/L (NH4)6(MO)24,4×10-4mol/L H3BO2,3×10-5mol/L CoCl2,10-5mol/L CuSO4,8×10-5mol/L MnCl2,10-5mol/L ZnSO410 mL,无菌蒸馏水360 mL。
MOPS培养基:10×MOPS母液100 mL,0.132 mol K2HPO410 mL,NH4Cl 4 g,甘油20 g,去离子水890 mL。
分别选用M9培养基、M9CA培养基、MOPS培养基和DM培养基作为发酵培养基,通过摇瓶发酵探究不同发酵培养基对LNnT产量的影响。
1.2.3.2 诱导温度对LNnT产量的影响
选用不同的诱导温度(20、25、28、30、37 ℃),通过摇瓶发酵探究不同诱导温度下LNnT的产量变化情况。
1.2.3.3 诱导浓度对LNnT产量的影响
选用不同的诱导剂异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)添加量(0、0.2、0.3、0.4、0.5、0.6 mmol/L),使用DM培养基进行发酵培养,通过摇瓶发酵探究不同诱导剂IPTG添加量对LNnT产量的影响。
1.2.3.4 诱导时间对LNnT产量的影响
选用不同的诱导时间(2、4、6、7、8、9 h),通过摇瓶发酵探究不同诱导时间对LNnT产量的影响。
1.2.4 发酵培养及诱导表达
挑取LB平板上划线分离的单菌落接种于液体LB培养基中,37 ℃,200 r/min,过夜培养;种子液接种量为2%(体积分数),加入相应抗生素,37 ℃,200 r/min,OD600=0.6时诱导,IPTG浓度为0.4 mmol/L,将温度改为25 ℃,诱导48 h后取样。
1.2.5 分批补料发酵
发酵条件:种子液接种量为5%,初始乳糖质量浓度为10 g/L,发酵罐培养基初始甘油质量浓度为20 g/L,通气量2 vvm,转速800 r/min,培养温度37 ℃,发酵过程利用体积分数14%的NH4OH调节发酵罐pH为6.80。发酵过程中控制甘油浓度在较低水平以提高产物积累量,控制底物乳糖质量浓度在(10±0.5) g/L左右,发酵罐溶氧为(30±5)%。
1.2.6 检测方法
通过HPLC测定乳酰-N-新四糖的生成量。1 mL发酵液煮沸5 min,12 000 r/min高速离心5 min,通过0.22 μm 的膜过滤处理。
使用HPLC测定LNnT生成量所用检测器为示差折光检测器,色谱柱为Rezex ROA-organic acid (Phenomenex,USA),柱温50 ℃;流动相0.005 mol/L的H2SO4水溶液,流速0.6 mL/min;进样量10 μL。
1.2.7 数据处理
使用Origin 8.5软件绘制本文图像,使用SPSS 20.0软件对实验数据进行统计学处理。
2 结果与分析
2.1 模块组合优化
为了优化LNnT的合成途径,引入模块组合优化,通过不同拷贝数的质粒改变模块的代谢通量,将LNnT合成途径分为模块I(基因glmS和galE)与模块Ⅱ(lgtA和NmlgtB)。将携带基因glmS-galE和lgtA-NmlgtB的不同载体组合导入宿主BL21(DE3)ΔlacZΔwecB中,获得如表2所示的菌株SA1~SA12。对12个不同的菌株摇瓶发酵后的乳酰-N-新四糖的产量分别为1.168、0.423、0.693、0.187、0.645、0.452、0.365、0.420、0.463、0.105、0.243、0.105 g/L。其中含有重组质粒pET-glmS-galE和pRSF-lgtA-NmlgtB的工程菌SA1获得了1.168 g/L的最高产量(见图2)。
模块的表达量值由质粒拷贝数决定,质粒pRSFDuet-1、pETDuet-1、pCDFDuet-1、pACYCDuet-1的质粒拷贝数分别约为>100,~40,20~40,10~20[21]。
摇瓶培养后,全部菌株均具有产LNnT的能力,但产量差异较大。大多数菌株产生的LNnT低于0.5 g/L,但SA1、SA3和SA5在内的3个菌株分别产生了1.168、0.693、0.645 g/L的LNnT,所得菌株SA1含有pET-glmS-galE和pRSF-lgtA-NmlgtB,作为LNnT生物合成的最佳菌株,产量为1.168 g/L。因此,lgtA、NmlgtB、glmS和galE基因相对高水平的表达有助于LNnT在细胞中的高效代谢合成。
结果表明,结合的高拷贝数质粒,菌株SA1显示出各种模块表达对提高LNnT产量的协同效应(1.168 g/L),可能是因为过表达关键酶基因减轻了中间产物的积累,并促进了中间产物向目标产物的有效转化。
工程菌SA6与SA1相比,菌体生物量(OD600)从9.60上升到了12.56,增加了30.8%,这可能是由于产物合成途径的碳通量部分流向了细胞生长的方向。
2.2 摇瓶发酵优化结果
2.2.1 培养基种类对LNnT产量的影响
对于LNnT的摇瓶发酵生产来说,培养条件是较为重要的外部条件,因此对发酵条件进行优化是有必要的。选取M9培养基(原始对照组)、M9CA培养基、MOPS培养基和DM培养基4种培养基作为发酵培养基,研究选择最优菌株SA1的最适培养基组成。
结果如图3所示,DM培养基中LNnT产量更高,OD600相较于其他培养基更高,表明菌体生长可能更有助于LNnT的积累,可能是M9(原始对照组)、M9CA以及MOPS培养基中含有无机氮源NH4Cl,且浓度相对较高,有文献表示NH4Cl浓度过高可能会抑制细胞的生长从而降低产物积累[22],与本文实验结果一致。因此选用DM培养基作为工程菌株发酵培养基。

图3 不同培养基种类对LNnT生产的影响Fig.3 Effects of different kinds of culture media on LNnT production
2.2.2 诱导温度对LNnT产量的影响
由图4可知,随着诱导温度的增加,LNnT的产量也随之增加,表示在一定温度范围内,LNnT的产量随着温度的升高而增加,但当诱导温度>25 ℃时,随着温度的升高,工程菌株产LNnT的能力随着温度的升高反而降低,最佳诱导温度为25 ℃。酶促反应及细胞生长与温度变化有关,随着温度的上升,反应速度加快,呼吸强度增加,细胞生长繁殖加快。但随着温度的持续上升,酶的正确折叠受到影响,不利于LNnT的发酵生产[22]。
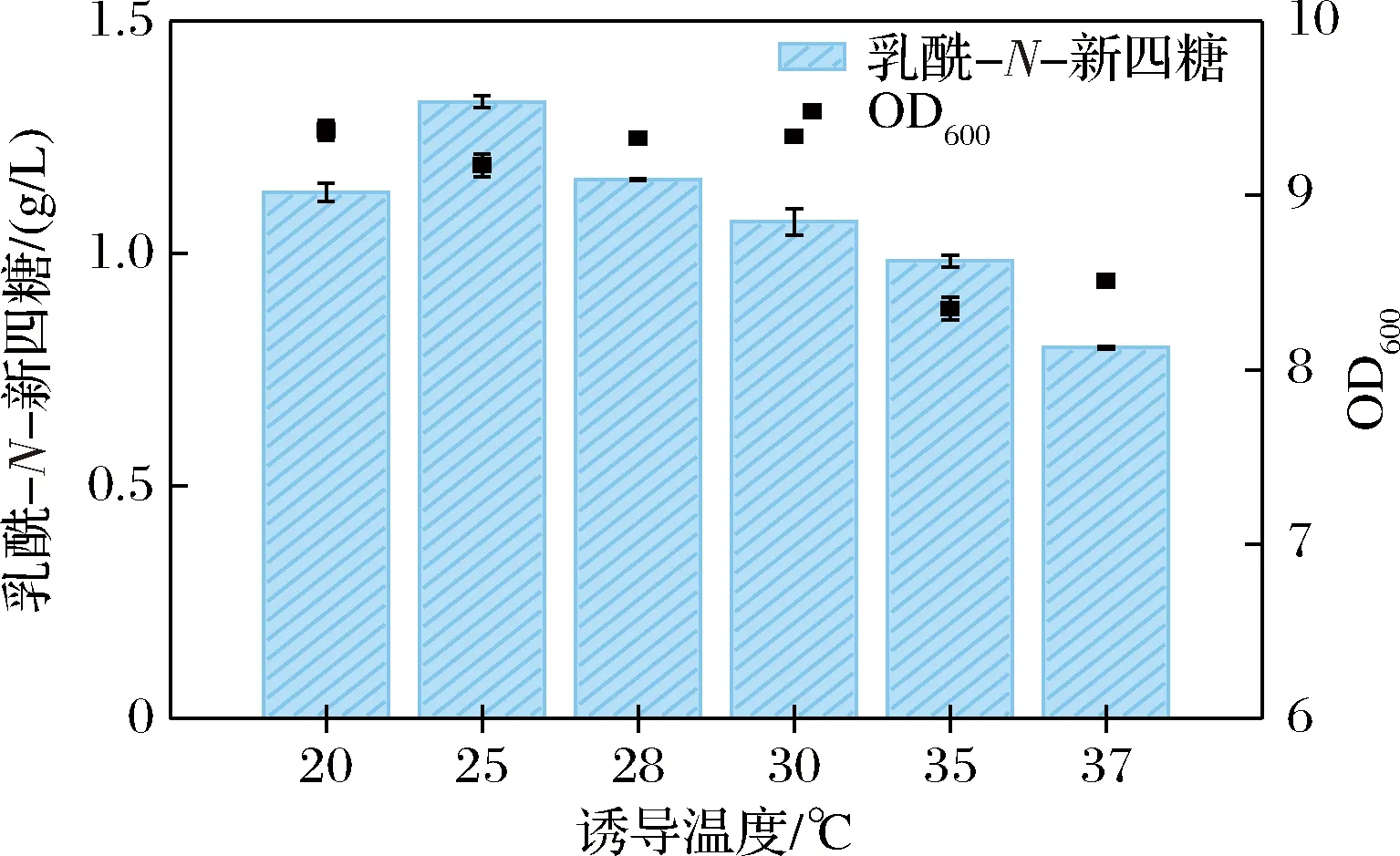
图4 不同诱导温度对LNnT生产的影响Fig.4 Effect of different induction temperatures on LNnT production
2.2.3 诱导浓度对LNnT产量的影响
由图5可知,LNnT产物积累随着诱导剂IPTG的浓度出现先增加后降低的趋势,最佳诱导浓度为0.2 mmol/L。有研究表明lgtA基因在异源表达时易形成包涵体[23],可能中等浓度的诱导剂有利于关键基因的可溶性过表达,从而促进LNnT的生产。

图5 不同诱导浓度对LNnT生产的影响Fig.5 Effects of different inducing concentrations on LNnT production
2.2.4 诱导时间对LNnT产量的影响
由图6可知,随着诱导时间的增加,LNnT产量随着诱导时间的增加而增加,当诱导时间为8 h时,LNnT产量达到最大值(2.50 g/L),之后产量降低。可能是因为当诱导时间过短时,细胞菌体量及酶的表达量较少,导致产物积累量减少,而当诱导时间超过8 h时,细胞菌体量过多,大量碳源被生长代谢消耗,从而减少LNnT产物的积累,故最佳诱导时间为8 h。

图6 不同诱导时间对LNnT生产的影响Fig.6 Effect of different induction time on LNnT production
2.3 补料分批发酵
由表3可知,DONG等[24]在枯草芽孢杆菌168中过表达lacY、lgtA和lgtB,通过引入模块化工程策略,平衡关键前体物质,在摇瓶发酵条件下,LNnT产量为1.95 g/L,补料分批发酵产量为4.52 g/L。此外,通过下调竞争途径关键基因的表达水平可以提高LNnT的产量,在摇瓶发酵条件下,LNnT产量为2.3 g/L,通过补料分批发酵,LNnT产量提高到5.41 g/L[25]。

表3 国内外产LNnT方法及产量相关报道详细信息Table 3 Reports on LNnT production methods and output at home and abroad
ZHANG等[26]通过在大肠杆菌K12中过表达lgtA、lgtB构建从头合成途径,通过过表达lacY提高LNnT产量,在摇瓶发酵条件下,LNnT产量为1.2 g/L。
ZHANG等[14]通过在大肠杆菌中过表达lgtA、galE、galT,并利用不同拷贝数质粒进行组合优化,对培养基条件进行优化后,在摇瓶发酵条件下,LNnT产量为1.25 g/L,补料分批发酵产量为12.1 g/L。
分批补料发酵过程如图7所示,培养11 h后菌体OD600达到20时进行诱导,加入IPTG使其终浓度为0.5 mmol/L,诱导温度为30 ℃,初始乳糖的质量浓度为10 g/L。为了维持菌体生长以及LNnT的合成,待初始甘油消耗完后流加800 g/L的甘油(含20 g/L的MgSO4·7H2O,0.2 g/L硫胺素)以补充碳源,通过pH反馈调节(设置流速为20 mL/h)使甘油在发酵体系中的浓度维持在较低浓度水平(甘油用于菌体生长和代谢,质量浓度约为0 g/L)至发酵结束。

图7 工程菌SA1补料分批发酵生物合成LNnTFig.7 Biosynthesis of LNnT by fed-batch fermentation of engineering strain SA1
待初始乳糖消耗完后手动补加300 g/L的乳糖并使其在发酵体系中的终质量浓度维持在(10±0.5) g/L左右,发酵过程中若乳糖消耗至<5 g/L时继续补加乳糖至发酵结束。18 h后逐渐产生LNnT。发酵65 h后LNnT收率达到最大值(14.25 g/L)是摇瓶发酵的5.7倍。
本研究通过在E.coliBL21(DE3)ΔlacZΔwecB中过表达lgtA、lgtB、galE、glmS,构建LNnT从头合成途径,通过调控代谢通路关键酶基因的拷贝数以及优化摇瓶发酵条件,以提高LNnT产量,在摇瓶发酵条件下,LNnT产量为2.5 g/L,通过补料分批发酵,LNnT产量提高到14.25 g/L(如图7所示),优于目前文献报道的产量(如表3所示)。
3 结论
本文以大肠杆菌BL21(DE3)ΔlacZΔwecB为出发菌株,通过调控中心碳代谢并弱化副产物途径、重构乳酰-N-新四糖合成途径、上调从头合成途径的关键酶、调控代谢通路基因的拷贝数以及摇瓶发酵条件优化等策略实现工程菌的构建和乳酰-N-新四糖的高效合成。本文得到的重组大肠杆菌可以利用乳糖高效合成乳酰-N-新四糖,摇瓶发酵产乳酰-N-新四糖胞外产量达2.50 g/L,补料分批发酵产量为14.25 g/L,是目前报道的最高LNnT产量。本研究为利用微生物工业化生产LNnT提供方法学研究思路,然而,发酵过程仍需添加抗生素,可能导致生产成本的增加以及生物安全问题,后续可考虑将关键酶基因整合至染色体,降低生产成本。
