高光谱荧光示踪无损检测瓜类作物嫁接苗愈合状态
2023-11-26谭佐军阿克拜尔江卡德尔雷红伟高子艺
谭佐军 ,蔡 霞 ,阿克拜尔江·卡德尔 ,余 帆 ,雷红伟 ,高子艺 ,杨 硕 ,黄 远 ,3,4※
(1. 华中农业大学理学院,武汉 430070;2. 果蔬园艺作物种质创新与利用全国重点实验室/华中农业大学园艺林学学院,武汉 430070;3. 华中农业大学深圳营养与健康研究所,武汉 430070;4. 中国农业科学院深圳农业基因组研究所和岭南现代农业科学与技术广东省实验室深圳分中心,深圳 518000;5. 咸宁市农业科学院,咸宁 437199)
0 引言
瓜类作物是一种重要的园艺和经济作物[1],在农民增收和满足中国快速增长的瓜果类产品需求方面发挥着巨大作用[2]。嫁接通常是瓜类作物用来解决连作障碍,减少土传病对瓜类作物生长发育的不良影响,提高其产量和果实品质的重要方式[3]。而嫁接苗愈合过程中,接穗和砧木间维管束的重新连通是砧穗间成功愈合的表现[4],目前瓜类嫁接中缺乏准确高效的活体检测维管束重连的方法,因此开发出判断嫁接维管束重连的早期无损鉴定技术显得尤为重要。
传统的嫁接苗愈合状态判断主要是通过有经验的农艺人员观察接穗真叶的生长来判断,耗费大量的人力物力,成本高[5]。实际上,接穗真叶出现往往是嫁接愈合后,无法实现尽早检测的目的。而在研究中应用较为广泛的荧光染色[6]、石蜡切片[7]、解剖分析[8]等方法工艺复杂、成本高、耗时耗力,并且不同的瓜类作物无法采用相同的检测方式。最重要的是,上述方法均为人工破坏式的方法,嫁接苗进行愈合检测后无法继续存活生长,所以难以实现产业化应用。因此,亟需探究出能快速准确并且能实现产业化应用的判别嫁接苗早期愈合状态的无损检测方式。随着传感器检测[9]、图像识别[10]、计算机图像处理[11]等的飞速发展,为了提高嫁接苗的生产效率以及经济效益,目前许多研究致力于将机器视觉技术应用于对嫁接苗的无损检测[12-13]。李长缨等[14]通过机器视觉对黄瓜的株高以及叶冠的投影进行识别分析,从而判断嫁接用苗黄瓜生长情况。但是此方法针对嫁接苗适用性较差,因为提取信息时需要区分砧木和接穗,图像分割难度大。苏颖欣等[15]利用机器视觉技术和机器学习方法对甜瓜嫁接苗的成活情况进行研究,但是该方法只是替代了人工观察接穗真叶的方法,而且仅从图像层面区分,愈合状态近似时准确率大大下降,同样存在无法检测更为准确的维管束重连时间。高光谱成像技术能够实时、非接触、高效地测量植物结构形态、生理生化[16]等多样化的表型,在高通量植物表型分析中表现出良好的潜力[17-18]。杨杰锴等[19]通过对甜瓜嫁接苗新长出真叶区域的高光谱图像进行分析,实现对甜瓜嫁接愈合情况的提前预测,然而该方法也是对接穗真叶进行检测。上述方法利用机器视觉检测嫁接苗的愈合虽然避免了人工以及破坏式检测的缺陷,但是嫁接愈合鉴定的准确率较低并且检测效率低。
碳点(CDs,carbon dots)是一种碳基零维纳米材料[20],能够从石墨、活性炭、碳纳米管以及有机小分子[21]等碳源中制得。CDs 具有尺寸小且稳定可调的荧光特性[22]、良好的生物相容性、无毒以及低成本[23]等优良特性,使其受到了研究者广泛的关注[24-25]。CDs 在植物体内一方面可以被合成为二氧化碳被代谢出体外,另一部分合成为有机物(糖、淀粉等)在植物体内积累,成为植物生长代谢的能源物质。因此,本文以氮硫掺杂碳点为荧光示踪材料,以西瓜砧木和接穗为研究对象,利用高光谱荧光成像方法,对西瓜嫁接苗愈合状态进行早期无损检测。
1 材料与方法
1.1 试验材料
西瓜是典型的瓜类作物,西瓜自嫁具有亲和性,其存活率较高,有利于本试验获取大量愈合存活状态的数据。因此,试验选取西瓜自嫁苗为研究材料,品种为早佳8 424,华中农业大学园林楼中培养。种子首先于0.2%的甲醛溶液中浸泡30 min,去离子水冲洗,搓洗去除种子上的残留物。消毒完成后,种子于50~55 ℃去离子水浸泡约6~8 h,用湿润的纱布将种子包裹好后于催芽箱内进行催芽,种子发芽1 cm 左右后进行播种。采用江西镇江的育苗专用基质进行育苗,在基质中加入1%代森锰锌进行消毒。采用50 孔盘穴培育种苗,将播种后的苗盘置于培养箱内进行培养,培养箱中采用的白光LED 灯照射,环境设施参数为光照强度300 μmol/m2·s,光照周期为:白天/黑暗=12 h/12 h,对应的昼夜温度为28 ℃/22 ℃,相对湿度为65%~75%。采用第一片真叶未展平的幼苗作为接穗(种苗发芽播种后 4 d);第一片真叶展平的幼苗作为砧木(种苗发芽播种后 6 d)。使用1% 代森锰锌对幼苗消毒处理后进行嫁接处理。嫁接采用单子叶贴接法进行嫁接,如图1,嫁接后将苗子放入华中农业大学园林楼培养箱中培养。
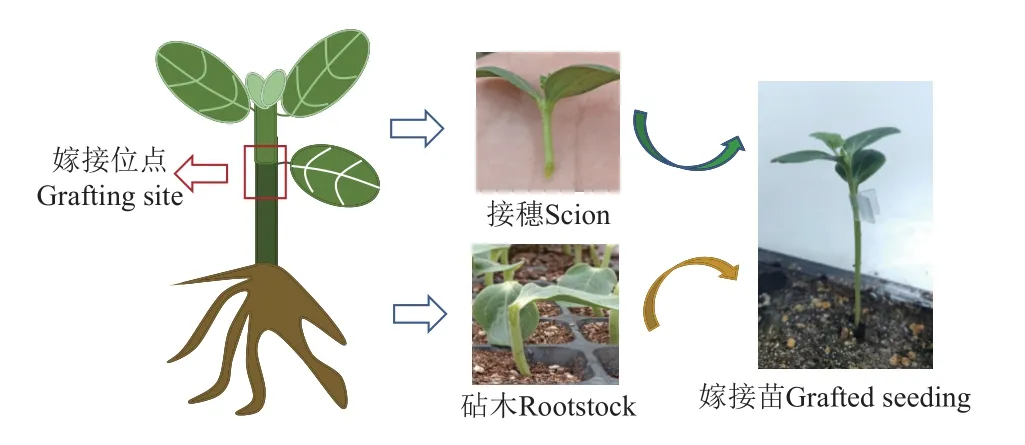
图1 西瓜嫁接苗嫁接过程Fig.1 Grafting process of watermelon grafts
1.2 氮硫掺杂碳点(N,S-CDs,nitrogen and sulfur doped carbon dots)的制备
将0.5 g 海藻酸钠和1 g 谷胱甘肽分别溶解于30 mL甲酰胺溶剂中。将上述混合液于超声清洗机中混合均匀,转移至内衬为聚四氟乙烯,釜体为304 优质不锈钢的反应釜中。拧紧后放入电热鼓风干燥箱内,于180 ℃反应8 h。将反应后的粗产物在10 000 r/min 的转速下进行离心,并使用0.22 μm 滤膜对离心后溶液的上清液进行过滤透析,然后冷冻干燥得到碳点粉末材料,操作流程如图2。
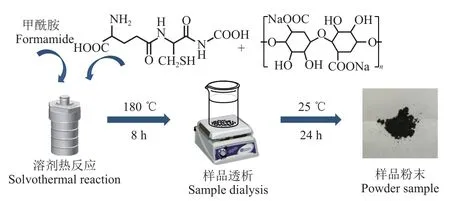
图2 氮硫掺杂碳点的制备流程图Fig.2 Preparation flow chart of N,S-CDs
1.3 碳点标记
对嫁接后1~8 d 的西瓜嫁接苗进行氮硫掺杂碳点染色标记。具体方法为:氮硫掺杂碳点配置为浓度1 000 mg/L 的水分散液,西瓜嫁接苗的培育穴盘完全浸泡于碳点水分散液中30 min 进行碳点标记,将标记成功的西瓜嫁接苗置于暗室中使用高光谱仪观察其标记后图像状态,由此分析其愈合情况,流程见图3。
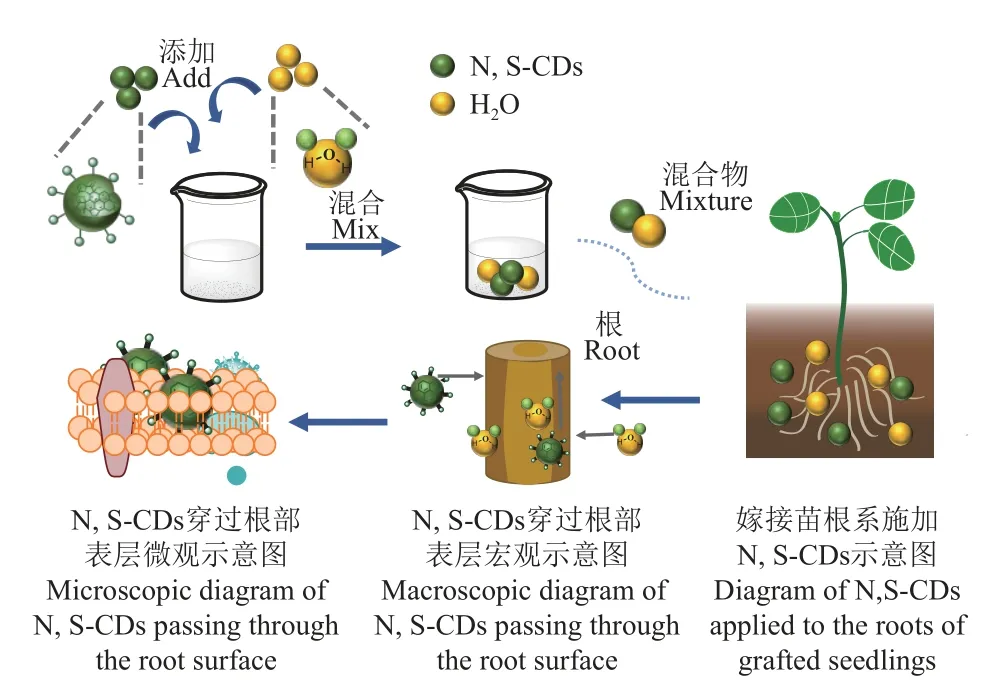
图3 氮硫掺杂碳点处理西瓜嫁接苗的流程图Fig.3 Flowchart of grafting watermelon seedlings treated with N,S-CDs
1.4 高光谱荧光图像采集
试验采用四川双利合谱GaiaField Pro 便携式高光谱成像系统,该光谱仪光谱范围为 400~1 000 nm,光谱分辨率为3.5 nm。试验在华中农业大学逸夫楼 A502 暗室中进行,光源采用15 W 的紫外灯,其中心波长为365 nm,带宽为10 nm。系统采样物距为30 cm,曝光时间设为25 ms,推扫速度设为 0.15 cm/s,试验装置如图4 所示。

图4 西瓜嫁接苗砧木和接穗光谱采样示意图Fig.4 Schematic diagram of spectral sampling of rootstock and scion of watermelon grafted seedlings
装置由计算机、高光谱成像系统、紫外光源、升降置物台组成。为了消除噪声和光照不均匀的影响,需要对获得的光谱图像按式(1)进行校正。
式中R是黑白校正后的嫁接苗图像,IR是原始光谱图像,ID是黑板图像;IW是白板图像。
2 结果与分析
2.1 氮硫掺杂碳点荧光发射光谱
如图5a 所示,在日光灯下碳点的水分散液为墨绿色,对N,S-CDs 的荧光发射进行检测,结果显示制备的N,S-CDs 在330~630 nm 激发下有明显的荧光发射,并且表现红蓝双发射特性。
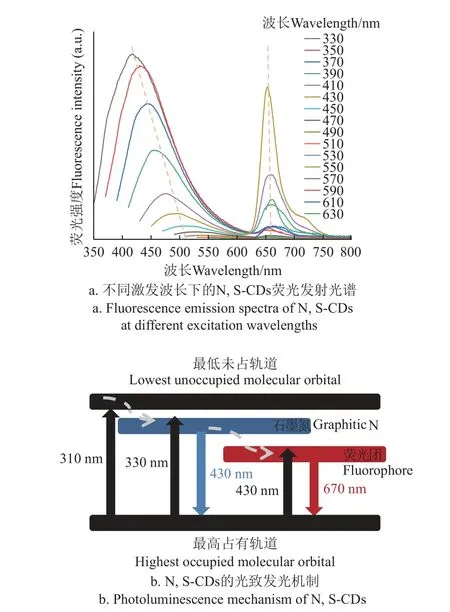
图5 N,S-CDs 荧光发射的特征Fig.5 Characteristics of fluorescence emission of N,S-CDs

图6 西瓜嫁接苗高光谱荧光染色主成分分析图像Fig.6 Principal component analysis of watermelon grafted seedling by hyperspectral fluorescence staining
如图5 可知该碳点在蓝光发射的最佳激发为330 nm,对应发射波长为430 nm,该碳点在红光发射的最佳激发为430 nm,对应发射波长为670 nm。这种独特的双发射特性是归因于大的sp2/sp3杂化域和氮/硫掺杂的表面状态[26-27],以及含硫荧光分子团[28]。它们在短波区的荧光发射带表现出与激发有关的行为,在激发波长为330~450 nm 时,荧光发射带表现出激发依赖性,从410 nm移动到505 nm;而以650 nm 为中心的发射则表现出与激发波长无关的行为。
N,S-CDs 表面有丰富的官能团,石墨氮、吡啶氮、C-S-C 等多种掺杂形式可以在N,S-CDs 中产生丰富的缺陷位点,同时谷胱甘肽和海藻酸钠含有丰富的氨基和羧基,在反应过程中容易脱水缩合成为含氮、硫的荧光分子团,因此造成此碳点的发射,光致发光机制如图5b。
2.2 愈合状态图像分析
为了将高光谱原始数据多维数据变换为低维样本矩阵,采用PCA 对西瓜嫁接苗高光谱进行特征提取,PCA 是通过矩阵变化,在测量空间寻找数据方差最大的正交向量,假设有P个样本X,样本均数为X1、X2、···、XP,样本标准差为S1、S2、···、SP,将样本矩阵进行标准化变换
前5 个主成分贡献率可达99%,在主成分图像中可见,即红方框标记处,嫁接后第3 天,嫁接苗尚未愈合时,碳点材料无法通过木质部运输到接穗部位,碳点在紫外光激发下有强烈的荧光,因此在主成分图像中的PC2 图像中可以看到砧木部位为白色,接穗部位为黑色;嫁接后第 7 天嫁接苗已经愈合,在主成分图像中的PC2图像中接穗和砧木茎秆均通体发亮。
图7 为西瓜嫁接苗高光谱碳点染色图像及光谱。嫁接苗未愈合时,接穗和砧木未连通,碳点材料无法通过木质部转运到接穗,在接穗部位无法观察到碳点的荧光;嫁接苗愈合后,接穗和砧木连通,碳点材料可以通过木质部转运到接穗,在接穗部位观察到荧光。在高光谱图像分析中,500 nm 左右为碳点的荧光发射峰,680 和740 nm 为植物自体荧光发射峰。砧木在愈合前后均可以检测到碳点材料,但接穗中只有在愈合后才能检测到碳点材料。

图7 不同愈合状态的嫁接苗的检测Fig.7 Detection of grafted seedlings with different healing states
2.3 愈合状态光谱分析
已知500 nm 左右为碳点的荧光发射峰,680 和740 nm 为植物自体荧光发射峰。
由图8 可知,在1~4 d 时,嫁接苗砧穗间尚未愈合,碳点材料无法运输到接穗部位,因此在接穗部位检测不出碳点材料的存在。在5~7 d 时,植物开始愈合,维管束功能恢复,碳点材料可以运输至接穗部位。由于愈合不完全,5 d 时,碳点运输速率较慢,30 min 内接穗上,只能检测出极少量的碳点。6~7 d 时,碳点通过愈合后的木质部转运至接穗后,由于愈合不完全,嫁接苗部分粘连,碳点通过渗透作用运输到接穗部分,但是导管与筛管还没有完全连接愈合,碳点无法通过向下转运,导致接穗茎部碳点的含量高于砧木茎部。第8 天,嫁接苗砧木与嫁接苗接穗部位的荧光强度相等,表明碳点在嫁苗中可以自由转运,说明砧穗间韧皮部和木质部已经连通,嫁接愈合完成。
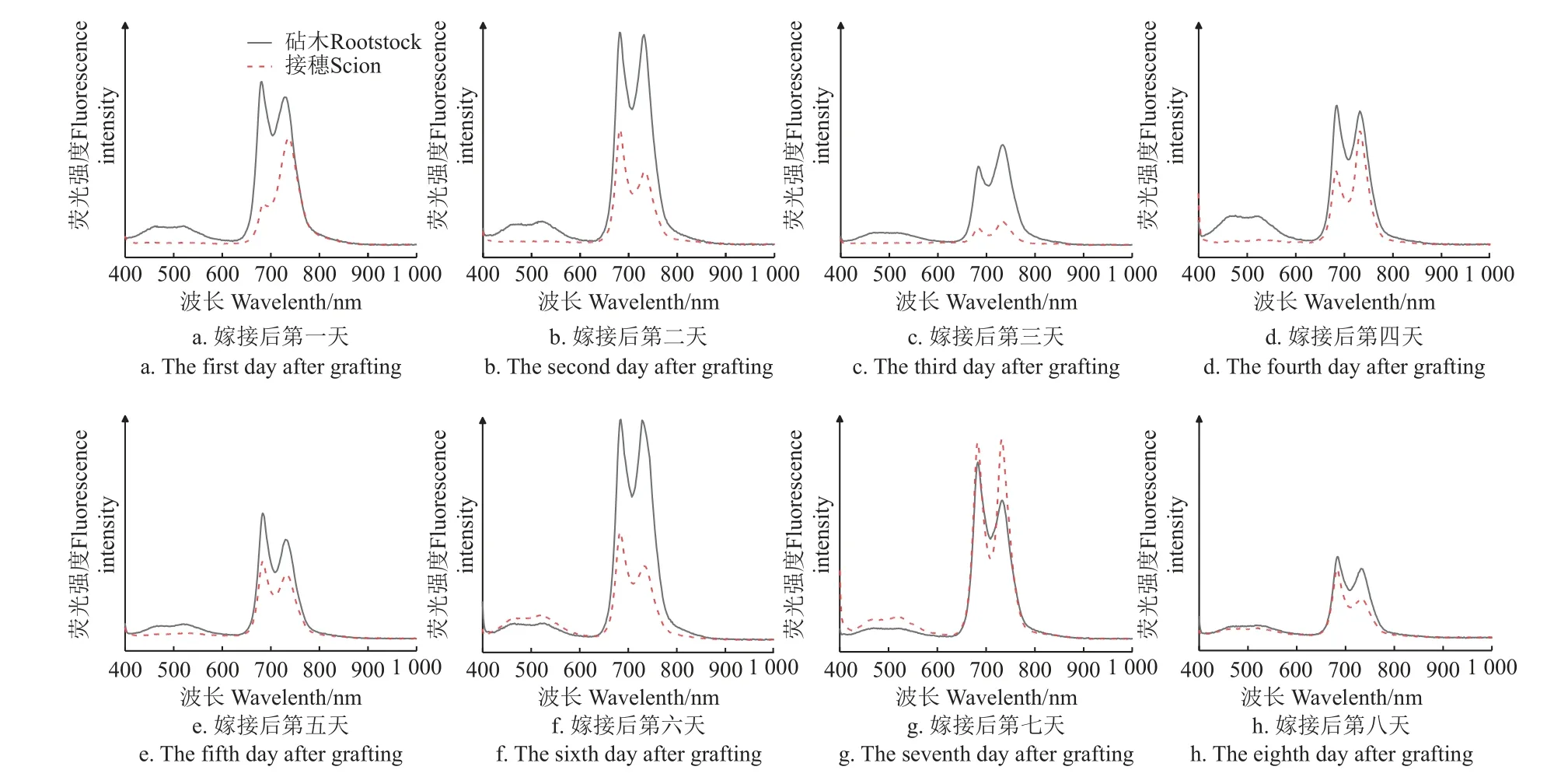
图8 嫁接后N,S-CDs 在西瓜嫁接苗中的转运情况Fig.8 Transfer of N,S-CDs in watermelon grafted seedlings after grafting
2.4 N,S-CDs 对西瓜嫁接苗愈合的影响
图9 a 可以明显发现,植物嫁接之后 12 d 内,随着时间的增加,经过碳点材料处理的西瓜嫁接苗接穗叶面积增长明显大于未经碳点材料处理的植株,表明N,S-CDs材料对嫁接后的西瓜真叶生长起到促进作用。
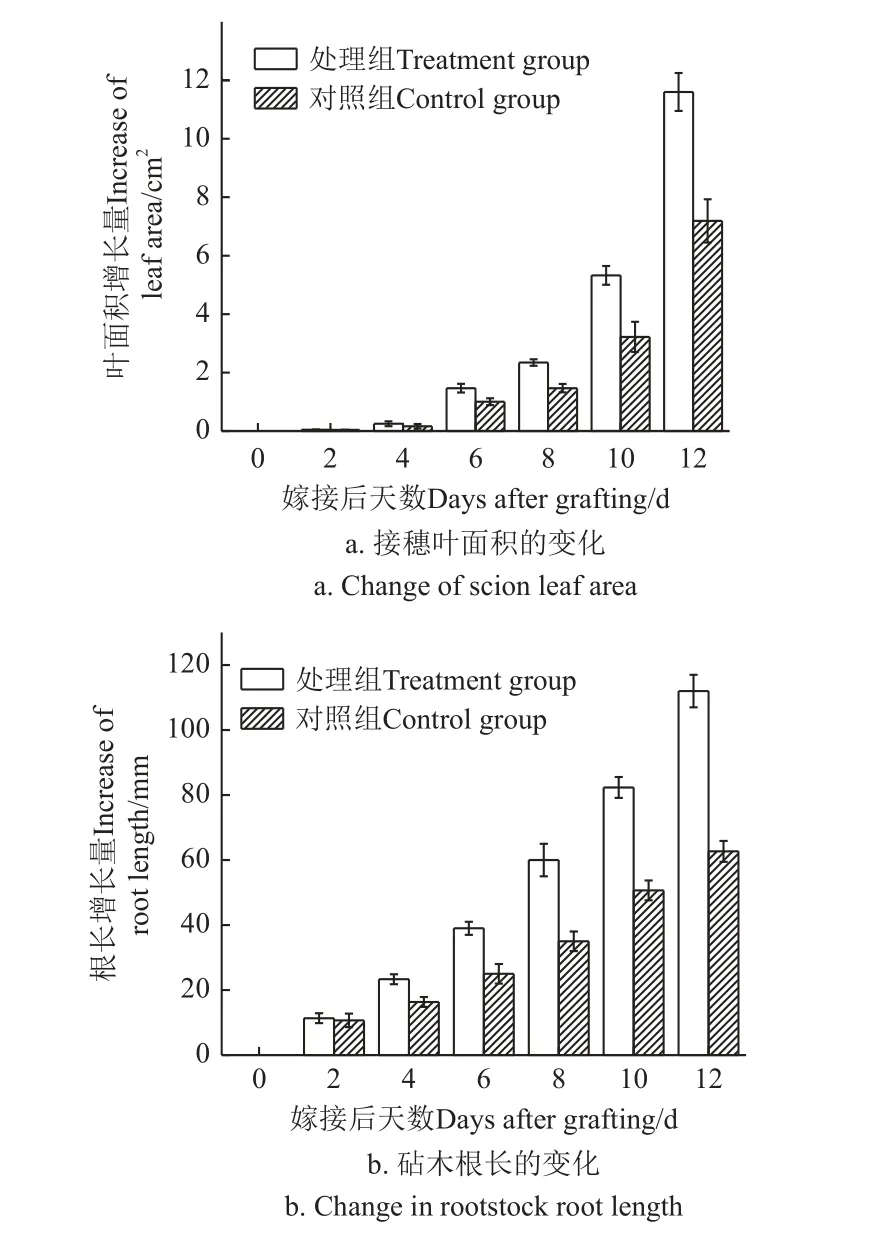
图9 嫁接后西瓜嫁接苗表型的变化Fig.9 Phenotypic changes of grafted watermelon seedlings
嫁接后第4 天时,处理组的接穗真叶面积增加量相较于对照组提升了 53.6%,说明嫁接后第4 天,CDs 水分散液处理后的嫁接苗愈合情况比对照组更好。处理组嫁接苗的接穗真叶叶面积 相较于处理组,第6 天提升了46.3%,第8 天提升了 59.8%,第10 天增加了 65.3%,第12 天增加了 61.4%。由此可以看出,在嫁接后第10 天的时候,处理组对嫁接苗叶面积增长促进作用最为显著。第3 天嫁接苗开始愈合,处理组的愈合情况优于对照组,所以水分矿物质通过愈合部木质部的运输到达接穗部位,促进叶面积增长。
图9b 可以看出,随着时间的增加,经过N,S-CDs水分散液处理的嫁接苗的根长较处理组增加的更快一些。通过N,S-CDs 处理后,嫁接苗根系的变化情况与处理后西瓜嫁接苗的真叶面积变化情况一致。随嫁接天数增加,处理组的西瓜嫁接苗根长比对照组增长更快,在嫁接后2、4、6、8、10 和12 d,处理组根长增长量相对对照组分别提升了 6.2%、42.9%、56.0%、71.4%、62.5%、78.7%。由此说明,N,S-CDs 可以促进嫁接苗根系的生长,有利于对营养物质以及水分的汲取[29]。
3 结论
本文以西瓜自嫁苗为研究对象,以N,S-CDs 为荧光示踪材料,利用高光谱成像仪采集嫁接苗荧光染色后不同愈合时期的光谱数据和不同波段下的图像信息,结合N,S-CDs 在嫁接苗中的转运情况进行了研究,主要结果如下:
1)N,S-CDs 具有稳定的荧光特性并且可以被嫁接苗吸收并转运。未愈合时,接穗和砧木未连通,碳点材料无法通过木质部转运到接穗,在接穗部位无法观察到碳点的荧光;嫁接苗愈合后,接穗和砧木连通,碳点材料可以通过木质部转运到接穗,在接穗部位观察到荧光。采用高光谱成像仪对愈合期西瓜自嫁苗的愈合情况进行监控,可以准确、快速、无损地判断瓜类作物早期的愈合状态。
2)通过N,S-CDs 处理发现嫁接苗能够促进嫁接苗根系以及接穗叶面积的增长,嫁接后第12 天,相较于对照组,处理组的根系增长量提升了78.7%,叶面积增长量提升了61.4%。
