离子色谱-脉冲积分安培法同时测定甘薯中10 种可溶性糖组分
2023-11-26石彩玲孙一鸣刘庆
石彩玲,田 侠,孙一鸣,刘庆
(青岛农业大学资源与环境学院 山东青岛 266109)
甘薯【Ipomoea batatas(L.)Lam.】含有 丰富的淀粉、可溶性糖、维生素和矿质元素等,是一种兼具营养和保健功能的农产品[1],可加工成薯片、薯条或经蒸、煮、烤后直接食用。甘薯中可溶性糖的组成及含量是影响其甜度、黏度、薯香味等食味指标的重要因子[2-3],常作为评价甘薯食味品质和加工性能的重要指标[4]。由于受测试方法所限,研究者仅对其中的葡萄糖、果糖、蔗糖等含量较高的糖分有较为详细的分析,而对含量相对较低的其它单糖或低聚糖并未关注[5-6],然而,这些糖组分对甘薯保健功能的发挥同样具有重要作用[7-8]。
目前可溶性糖含量的测定方法主要有分光光度法、毛细管电泳法、气相色谱法、液相色谱法、离子色谱法等[9-14]。比色法测定样品的可溶性总糖含量,无法对可溶性糖分的组成进行测定[15];毛细管电泳法则需要对糖类进行衍生后才能通过紫外吸收进行测定,由于糖类的紫外吸收一般较弱,因此该方法测定的精度没有保证[16];由于糖类的挥发性差,利用气相色谱法同样需经过衍生后才能实现色谱分离,操作步骤繁琐且精度不高[17];液相色谱法虽然不需衍生,但是常规的液相色谱一般选用蒸发光散射检测器或示差折光检测器检测,检出限高,对一些含量偏低的糖组分无法检出[13];离子色谱可利用其阴离子交换色谱柱对可溶性糖组分进行分离,无需衍生,并且离子色谱法还搭配了脉冲安培检测器进行检测,方法的灵敏度高,可实现对较低含量糖组分的定量检测[18]。然而,对甘薯来讲,由于其营养成分复杂,加之不同糖组分在提取液中的溶解性差别较大,导致测定过程中干扰较多,影响测试精度。
在总结前人经验及存在问题的基础上,针对甘薯块根中基质组成的特点,本文采用80%乙醇水溶液超声振荡提取其中可溶性糖组分,通过活化的RP 柱去除疏水有机物杂质,最后采用离子色谱-脉冲积分安培检测法(IC-PAD)对提取液中10种可溶性糖组分进行同时测定。
1 材料与方法
1.1 设备与材料
ICS-5000 离子色谱仪,美国Thermo Dionex公司;Carbo Pac PA20 色谱柱和保护柱,美国Thermo Dionex 公司;RP 前处理柱,美国Thermo Dionex 公司;Milli-Q 超纯水机,美国Millipore公司;电热恒温鼓风干燥箱,天津莱玻特瑞公司;冷冻干燥机,宁波新芝生物科技股份有限公司。
10 种糖(葡萄糖、果糖、蔗糖、麦芽糖、鼠李糖、阿拉伯糖、甘露糖、半乳糖、棉子糖和水苏糖)标准品,Sigma 公司。甘薯样品取自青岛农业大学现代农业高科技示范园(胶州)试验基地。
1.2 标准溶液配制
分别称取10 种糖标准品各100 mg 于三角瓶中,加适量水溶解后无损转移至100.0 mL 容量瓶并定容至刻度,配制成质量浓度为1 000 mg/L 的单一标准储备液。使用前根据需要用超纯水稀释配制成不同质量浓度的混合标准液。
1.3 仪器配置与色谱条件
Carbo Pac PA20(3 mm×150 mm)阴离子交换色谱柱和Carbo Pac PA20(3 mm×50 mm)保护柱,RP 前处理 柱。流动相:18.2 MΩ 超纯水、250 mmol/L NaOH、1.0 mol/L CH3COONa。样品进样体积10 μL,柱温30 ℃,ED5000 脉冲安培检测器,AS-AP 自动进样器,Au 工作电极,糖测定标准四电位波形。色谱柱梯度淋洗分离程序如表1。混合标准液各可溶性糖组分谱图见图1。
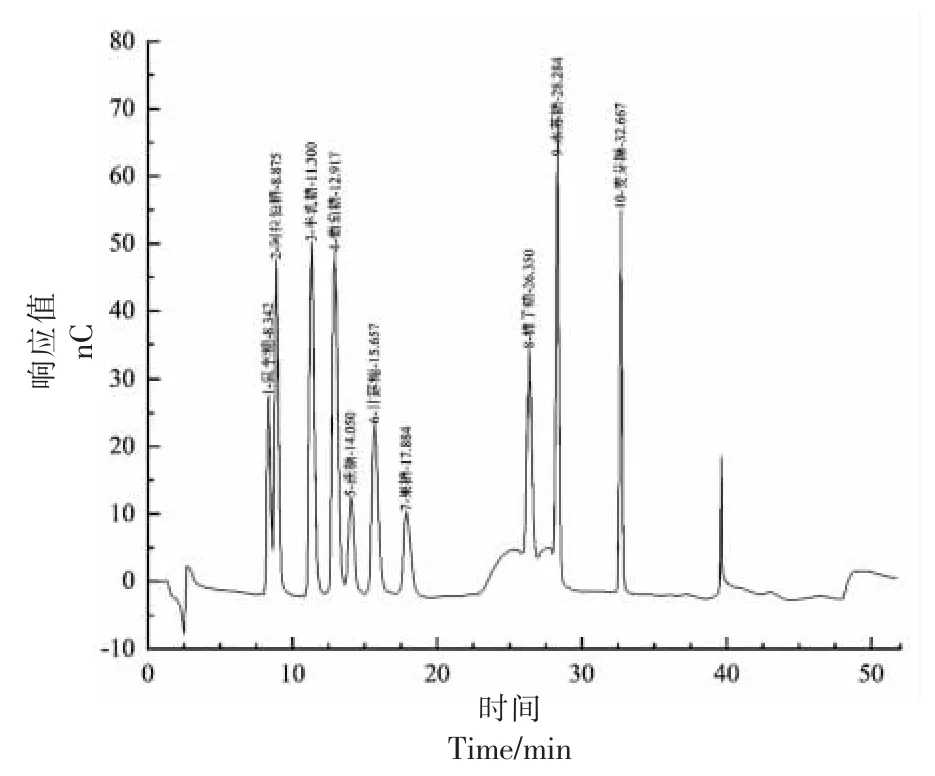
图1 10 种糖组分混合标准液谱图Fig.1 Spectrogram of mixed standard solution of 10 soluble sugar constituents
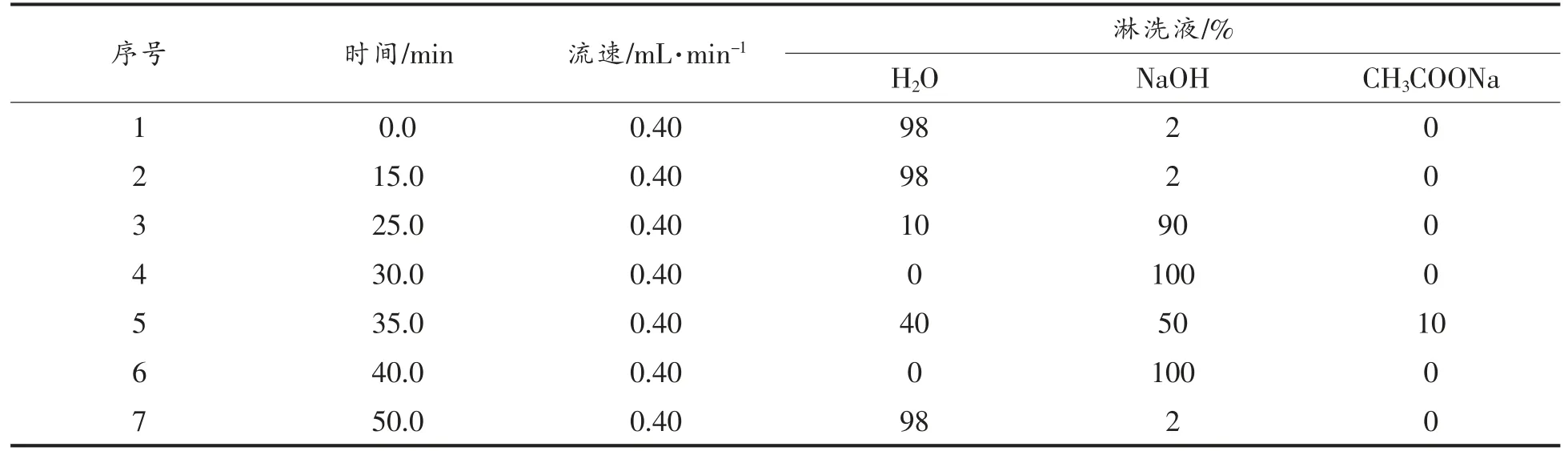
表1 离子色谱梯度淋洗分离程序Table 1 Gradient conditions of ion chromatography column
1.4 提取液制备
随机选择形状类似纺锤形、质量为400 g 左右薯块5 个,去皮切丝后,分别放入105 ℃鼓风烘箱和冷冻干燥机干燥至恒重,磨细过筛后备用。取不同干燥方式的样品各0.5 g(精确至0.0001 g),分别置于50 mL 离心管中,加入40 mL 80%的乙醇水溶液(乙醇∶水=8∶2),超声萃取60 min 后(超声时加自来水循环控制水温不超过15 ℃),再放入振荡器继续振荡提取2 h,放置澄清。取上清液2 mL 于冷冻离心机中10 000 r/min 冷冻离心5 min,取1 mL 上清液用超纯水稀释100 倍,取一定量的溶液过0.22 μm 滤膜及已活化的RP 柱,弃去前约0.5 mL 样品,收集后续样品上机测定其中葡萄糖、果糖、半乳糖、甘露糖、鼠李糖、阿拉伯糖、蔗糖、麦芽糖、棉子糖和水苏糖等不同组分含量。每个样品做3 次重复。
1.5 数据分析
用Excel 2010 进行数据整理和图表绘制。利用DPS14.0 软件进行统计分析,用Duncan 法进行平均数间的显著性检验,显著性水平取P<0.05。
2 结果与分析
2.1 样品前处理条件的优化
本试验中采用80%乙醇水溶液提取样品中的可溶性糖组分,主要因为甘薯中淀粉含量相对较高,若单纯用超纯水提取,容易造成样品中的其它基质成分溶解过多对测定干扰过大[19];同时,还可以减少提取过程中淀粉的水解。而采用超声+振荡提取则可提高提取效果,并且在超声过程中控制水温在15 ℃,主要是为防止超声过程易使温度升高,而温度的升高会增加淀粉酶的活性,加速样品中淀粉分解为可溶性糖[20],给试验结果带来误差。为此,本试验在超声提取过程中,通过接入循环水以控制水温,以降低淀粉酶活性,减少淀粉水解给试验带来的误差。采用超声+振荡方式进行提取,确保对样品中可溶性糖组分提取更加完全,增加测定结果的准确性。
2.2 色谱柱选择和淋洗条件优化
2.2.1 色谱柱选择 目前用于小分子可溶性糖分离的阴离子交换色谱柱有:CarboPac MA1、CarboPac PA1、CarboPac PA10 和CarboPac PA20。根据各色谱柱在分离不同糖组分时的特点,本试验选择使用CarboPac PA20 色谱柱对各糖组分进行分离。主要因为CarboPac PA20 色谱柱延续了CarboPac 型色谱柱的特点,采用无孔基球附聚双官能季铵功能基填料,柱容量较低,分离速度快,分离效果好[21]。而CarboPac MA1 色谱柱因柱容量偏大,对溶剂消耗量大,且各成分保留时间延长,在对可溶性糖各组分分离时效率低,而更适合于弱电离的糖醇类化合物的检测[17];CarboPac PA1色谱柱基质粒径较大,柱效低,且其在弱碱性条件下工作时,存在较为明显的溶解氧负峰干扰,降低了各糖组分检测的灵敏度[17];CarboPac PA10 色谱柱虽然克服了CarboPac PA1 存在的问题,在不同浓度的OH-1浓度下均具有较高的灵敏度,但其柱效仍低于CarboPac PA20[17]。
2.2.2 淋洗条件优化 糖类分子具有电化学活性,在OH-存在的条件下,它们会部分或全部以阴离子形式存在,可以在阴离子交换色谱柱上实现分离[22]。此时,淋洗液中的OH-有两个作用:一是作为淋洗离子,OH-浓度增大,糖在色谱柱上的保留时间缩短,二是提供糖解离所需的碱性环境,OH-浓度增大,糖分子的离子化程度提高,其在色谱柱上的保留时间延长。因此,糖分在色谱柱中的保留时间是上述两种作用共同影响的结果[23]。因此,本试验在对甘薯中10 种可溶性糖组分进行分离时,选用NaOH 和NaOAc 组合淋洗液进行梯度淋洗,在开始的前30 min 采用逐渐增加NaOH 溶液浓度、30~35 min 采用氢氧化钠和乙酸钠组合溶液进行梯度洗脱,不仅可以有效提高各糖组分的分离效果,同时可以提高响应的灵敏度。
2.3 色谱柱柱温和淋洗液流速
色谱柱温度主要通过影响柱内填料的活性,影响系统压力从而影响色谱峰的分离效果[24]。由于多数单糖和低聚糖均为具有极性带电物质,它们与色谱柱的作用力主要是库仑力[25],因此,温度对其分离效果影响不大。淋洗液流速主要通过改变各成分在分离柱中的保留时间,从而影响分离效果。流速越低保留时间越长,流速越高分离度越差[26]。根据以往经验,选择色谱柱温30 ℃,淋洗液流速0.4 mL/min,既保证色谱峰峰形,又能保证较好的分离效果。
2.4 标准曲线、精密度与检出限
配制了质量浓度为100 mg/L 的10 种糖组分的混合标准溶液,并分别稀释其浓度至0.02~20 mg/L 的10 个浓度的标准系列,利用以上选定的方法对混合标准液进行离子色谱分析,并利用10种糖的峰面积(y)与其相应的浓度(x)之间关系进行线性拟合,得到10 种糖分浓度与峰面积之间的线性方程,其线性相关系数在0.9904~0.9987 之间。然后,取1 mg/L 的混合标准液样品,利用以上选定的方法重复测定5 次,计算出平行样品间的相对标准偏差在0.57%~1.89%之间。然后,根据3倍信噪比分别计算出10 种糖的检出限为16.73~57.96 μg/L。以上所有测试结果见表2。从以上试验结果可以看出,本方法测定结果重现性好、精密度高,线性范围和检出限均满足样品检测需求。
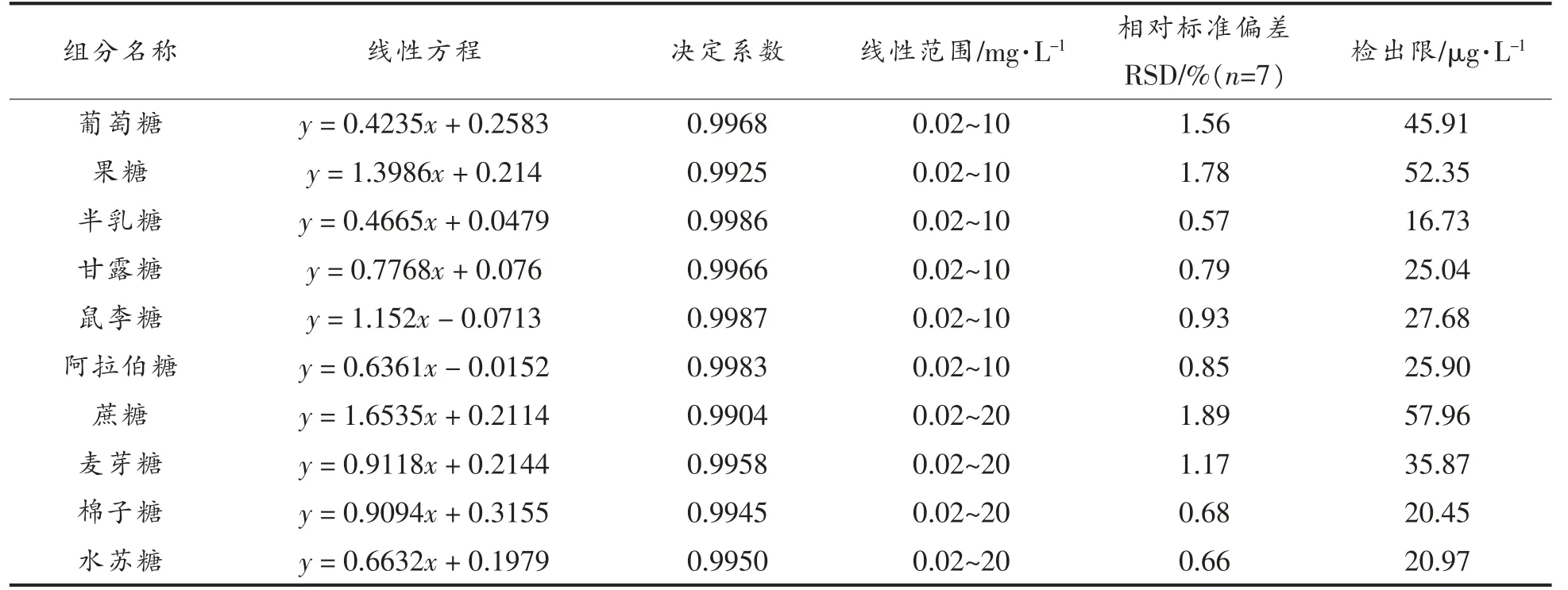
表2 标准曲线的线性范围、检出限Table 2 Linear range,limits of detection for every soluble sugar
2.5 回收率与实际样品测定
选择105 ℃下鼓风烘干的甘薯样品提取液,向待测液样品中添加2.0 mg/L 的标准溶液,和待测样品一起利用选定的方法进行测定,检测甘薯样品中各种可溶性糖组分的含量。并根据原样品中各糖组分浓度、添加浓度和添加后的测定浓度计算回收率,结果见表3。从表3 可以看出,样品中不同糖组分的回收率在94.5%~106.5%之间。

表3 回收率与样品测试结果Table 3 Recovery and results of real samples
从实际样品测定结果看,热风干燥处理的各可溶性糖组分及其总量均高于冷冻干燥处理,葡萄糖、果糖和蔗糖在两种干燥方式样品中含量均较高,而热风干燥样品中麦芽糖含量为冷冻干燥样品中的12.9 倍,说明热风干燥过程使淀粉酶活性提高从而促进淀粉分解成麦芽糖。另外,在热风干燥样品中还检测出冷冻干燥样品未检出的棉子糖和水苏糖,说明这两种糖分可能并非在甘薯生产中形成,而是样品干燥处理过程中由其它糖分转化而来。
3 结论
本研究建立了低温超声振荡提取、离子色谱-脉冲积分安培检测(IC-PAD)同时测定甘薯中10种可溶性糖组分的方法。结果表明,样品经80%的乙醇水溶液低温超声振荡提取,不仅提高了提取效率,还降低了杂质溶出率。再经滤膜过滤和RP柱净化,极大的减少了色谱分离时的杂质干扰。通过调节淋洗液组合浓度、柱温和淋洗液流速,使不同糖组分实现良好分离,且可保证在35 min 内完成10 种糖的分离测定。经对标准曲线系列样品的多次重复测定和加标回收率计算,6 种单糖线性范围为0.02~10 mg/L,其它4 种糖线性范围为0.02~20 mg/L。10 种糖组分加标回收率94.5%~106.5%,相对标准偏差0.57%~1.89%。本方法线性范围广、操作简单、分析速度快、灵敏度高、重现性好,可用于对甘薯提取液中多种可溶性糖组分的同时测定。
样品测定结果表明,热风干燥处理可使甘薯样品可溶性糖含量增加,尤其是麦芽糖增加最为明显。另外,热风干燥还可以促进棉子糖和水苏糖的生成,由于这两种功能性低聚糖在冷冻干燥样品中并未检出,因此推断其并非在甘薯生长过程中合成,而是在热风干燥过程中由其它糖分转化而来。
