lncRNA MALAT1调节miR-106b-5p/TLR4轴对慢性阻塞性肺疾病大鼠肺组织炎性损伤的影响
2023-11-25任丹,张田,李杰
任 丹,张 田,李 杰
(1.咸阳市第一人民医院 a老年病科二病区;b呼吸与危重症医学科,陕西 咸阳712000;2.湖北省第三人民医院 肿瘤科,湖北 武汉430030)
慢性阻塞性肺疾病(COPD)可引发肺组织炎症损伤和肺功能衰退,造成患者呼吸能力严重受损[1-2]。长非编码RNA转移相关肺腺癌转录本1(lncRNA MALAT1)可通过诱导并促进炎症参与动脉粥样硬化、COPD等炎性疾病的发病,lncRNA MALAT1缺失可抑制巨噬细胞衍生泡沫细胞的形成[3]。研究显示MALAT1在COPD肺组织标本中高表达,敲除lncRNA MALAT1可抑制转化生长因子-β处理的人肺成纤维细胞纤维化[4]。lncRNA MALAT1可通过调控微小RNA表达介导细胞增殖、凋亡及炎症[3],miR-106b-5p是其中一个调控靶点,被lncRNA MALAT1结合后表达降低,促进大肠癌细胞的侵袭转移[5]。另外miR-106b-5p可作为COPD的生物标志物,通过上调miR-106b-5p可抑制炎症反应,减轻COPD的严重程度[6-7],还可通过下调Toll样受体4(TLR4)抑制氧化低密度脂蛋白引起的内皮细胞炎症和氧化应激损伤[8],而TLR4是COPD炎症过程的重要调控因子[9]。本研究通过构建COPD大鼠模型,探讨lncRNA MALAT1是否能通过调节miR-106b-5p/TLR4轴影响COPD大鼠肺组织炎性损伤,报道如下。
1 材料与方法
1.1 材料
1.1.1实验动物 SD大鼠,购自陕西中医药大学,许可证号SCXK(陕)2021-001,SPF级,雄性,体质量200~230 g,分笼饲养(4只/笼),饲养温度设为23~25℃,饲养相对湿度设为50%~60%,光照以明暗各12 h进行循环。
1.1.2主要试剂与仪器 大鼠肺泡上皮细胞L2(货号JH-R3019)、RPMI-1640培养基(货号SH30809.01B),上海继和生物科技有限公司;脂多糖(纯度:≥98%,货号L8880)、姬姆萨染色液(10×原液,货号G1015)、HE染色试剂盒(货号G1120)、大鼠白细胞介素-10(IL-10)酶联免疫吸附测定(ELASA)试剂盒(货号SEKR-0006)、大鼠肿瘤坏死因子-α(TNF-α)ELASA试剂盒(货号SEKR-0009)、大鼠前列腺素E2(PGE2)ELASA试剂盒(货号SEKR-0053)、双荧光素酶报告基因检测试剂盒(货号D0010),北京索莱宝科技有限公司;Trizol试剂(货号B610409)、lncRNA MALAT1 siRNA质粒、miR-106b-5p antagomir、miR-106b-5p antagomir阴性对照、空载质粒,生工生物工程(上海)股份有限公司;一步法反转录实时荧光定量PCR试剂盒(货号D7277M),上海碧云天生物技术有限公司等。
SCIREQ小动物肺功能检测仪,北京广源达科技发展有限公司;LEIA-X4实时荧光定量pcr仪,济南欧莱博技术有限公司;FK-SY96S多功能酶标分析仪,山东方科仪器有限公司;TC-150Z型智能全封闭生物组织脱水机、R139型轮转式石蜡切片机,湖北泰维科技实业股份有限公司;XSP-13CA研究级生物显微镜,上海光学仪器一厂。
1.2 方法
1.2.1建立COPD大鼠模型并分组处理 参照文献[10],以气管滴注脂多糖溶液并联合烟熏法构建COPD模型大鼠:以生理盐水溶解脂多糖,混匀制为2 mg/mL的脂多糖溶液,于实验第1天和第14天向大鼠气管内分别滴注上述脂多糖溶液各1 mL,并于实验第2天到第28天(第14天不烟熏)将SD大鼠放入自制烟熏箱中进行烟熏,每天30 min(1支香烟/只),于实验第29天观察大鼠,若其出现精神萎靡、呼吸困难、咳嗽喘息等症状,即可表明COPD大鼠模型构建成功,共得到成功建模大鼠60只,随机分成模型组、lncRNA MALAT1敲低组、miR-106b-5p antagomir组、阴性对照组、lncRNA MALAT1敲低+miR-106b-5p antagomir组,每组12只,选12只正常大鼠于实验第1天和第14天向气管内滴注与造模大鼠等剂量的生理盐水,且不进行烟熏,设为对照组。
以生理盐水分别溶解lncRNA MALAT1 siRNA质粒、miR-106b-5p antagomir、miR-106b-5p antagomir阴性对照、空载质粒,lncRNA MALAT1敲低组大鼠尾静脉注射200 nmoL lncRNA MALAT1 siRNA质粒,miR-106b-5p antagomir大鼠尾静脉注射200 nmoL miR-106b-5p antagomir,阴性对照组大鼠尾静脉注射200 nmoL miR-106b-5p antagomir阴性对照和200 nmoL空载质粒,lncRNA MALAT1敲低+miR-106b-5p antagomir组大鼠尾静脉注射200 nmoL lncRNA MALAT1 siRNA质粒和200 nmoL miR-106b-5p antagomir,模型组和对照组大鼠尾静脉注射与lncRNA MALAT1敲低+miR-106b-5p antagomir组等剂量的生理盐水,各组大鼠均每周注射2次,共注射2周。
1.2.2检测肺功能 各组大鼠分组处理2周结束后24 h,采用小动物肺功能检测仪测定大鼠用力肺活量(FVC)、呼气峰流值(PEF)、吸气阻力(Ri)、潮气量(VT),每只大鼠测3次,取平均值。
1.2.3实时荧光定量PCR实验检测肺组织lncRNA MALAT1、miR-106b-5p、TLR4 mRNA表达及采集标本 各组大鼠肺功能检测结束后,吸入乙醚进行麻醉,剪开颈部找到颈总动脉,采集其中血液离心(3 000 r/min,4℃,15 min)获得血清,保存-80℃冰箱中备用;游离大鼠气管,于其下段剪1小口,插入并结扎固定1个注射器针头,连接注射器向大鼠肺部缓慢注入1 mL生理盐水灌洗,回抽后再次注入,灌洗3次后得到肺泡灌洗液(BALF)离心(1 500 r/min,4℃,5 min),获得细胞沉淀和上清,细胞沉淀加入1 mL生理盐水混匀后用于白细胞计数,BALF上清保存-80℃冰箱中备用;于大鼠尾静脉中注入25%氯化钾溶液0.6 mL处死大鼠,开胸取出双肺,剪下左肺洗涤后常规固定、脱水、透明,以热石蜡包埋后固定在切片机中切片备用;剪下0.5 g右肺组织,剪碎后加入Trizol试剂研磨提取总RNA,测出其浓度后采用一步法反转录实时荧光定量PCR试剂盒逆转录后做PCR扩增,lncRNA MALAT1及TLR4以GAPDH做内参对照,miR-106b-5p以U6做内参对照,各基因Ct值通过2-ΔΔCt算法分析量化其各组相对表达,基因引物序列见表1。

表1 引物序列
1.2.4Giemsa染色对BALF中白细胞计数 取1.2.3中经生理盐水重悬混匀后的BALF细胞沉淀,吸出20 μL滴入细胞计数板,风干、固定、姬姆萨染色,在显微镜下观察并对着色的白细胞计数。
1.2.5大鼠肺组织病理形态检测 取1.2.3中的肺组织切片,二甲苯脱蜡后水化,加入HE染色液浸没切片,按照HE染色试剂盒说明书指导做染色后脱水、透明、铺片、封片,在显微镜下观察并任选5个视野拍照,观察肺组织大量炎性细胞浸润,肺泡结构受损、融合、数目减少,气管黏膜充血、水肿等炎性损伤症状,根据如下标准做Holfbauer评分[11]:肺组织无炎性损伤症状,评0分;25%视野中肺组织出现炎性损伤症状,评1分;50%视野中肺组织出现炎性损伤症状,评2分;75%视野中肺组织出现炎性损伤症状,评3分;100%视野中肺组织出现炎性损伤症状,评4分。
1.2.6ELASA法测定BALF和血清中TNF-α、PGE2、IL-10水平 取1.2.3中保存在-80℃冰箱中的BALF上清和血清,放在冰水浴中慢慢解冻,采用ELISA法测定两者中TNF-α、PGE2、IL-10水平,具体步骤按照各自试剂盒说明书指导操作。
1.2.7检测L2细胞中lncRNA MALAT1对miR-106b-5p、miR-106b-5p对TLR4 的靶向调控 取购买的L2细胞解冻复苏,接种在25 mm2培养瓶培养,传代后接种在无菌12孔板培养24 h,随机分为野生miR-106b-5p+空载组(转染野生型miR-106b-5p报告质粒和空载质粒)、野生miR-106b-5p+lncRNA MALAT1过表达组(转染野生型miR-106b-5p报告质粒和lncRNA MALAT1过表达质粒)、突变miR-106b-5p+空载组(转染突变型miR-106b-5p报告质粒和空载质粒)、突变miR-106b-5p+lncRNA MALAT1过表达组(转染突变型miR-106b-5p报告质粒和lncRNA MALAT1过表达质粒),使用脂质体分组转染24 h后收集各组细胞,采用双荧光素酶报告基因检测试剂盒测定其双荧光素酶相对活性。
L2细胞传代后接种在无菌12孔板培养24 h,随机分为野生TLR4+miR-106b-5p mimics阴性对照组(转染野生型TLR4 3′-UTR报告质粒和miR-106b-5p mimics阴性对照)、野生TLR4 +miR-106b-5p mimics组(转染野生型TLR4 3′-UTR报告质粒和miR-106b-5p mimics)、突变TLR4+miR-106b-5p mimics阴性对照组(转染突变型TLR4 3′-UTR报告质粒和miR-106b-5p mimics阴性对照)、突变TLR4 +miR-106b-5p mimics组(转染突变型TLR4 3′-UTR报告质粒和miR-106b-5p mimics),以脂质体分组转染24 h后收集各组细胞,采用双荧光素酶报告基因检测试剂盒测定其双荧光素酶相对活性。
1.3 统计学分析

2 结果
2.1 各组大鼠肺功能检测结果
与对照组比较,模型组大鼠FVC、PEF降低(P<0.05),Ri、VT升高(P<0.05)。与模型组比较,lncRNA MALAT1敲低组大鼠FVC、PEF升高(P<0.05),Ri、VT降低(P<0.05);miR-106b-5p antagomir组大鼠FVC、PEF降低(P<0.05),Ri、VT升高(P<0.05);阴性对照组大鼠FVC、PEF、Ri、VT无显著差异(P>0.05)。与lncRNA MALAT1敲低组比较,lncRNA MALAT1敲低+miR-106b-5p antagomir组大鼠FVC、PEF降低(P<0.05),Ri、VT升高(P<0.05)。见表2。

表2 各组大鼠肺功能指标
2.2 各组大鼠肺组织lncRNA MALAT1、miR-106b-5p及TLR4 mRNA表达检测结果
与对照组比较,模型组大鼠肺组织lncRNA MALAT1及TLR4 mRNA表达升高(P<0.05),miR-106b-5p表达降低(P<0.05)。与模型组比较,lncRNA MALAT1敲低组大鼠肺组织lncRNA MALAT1及TLR4 mRNA表达降低(P<0.05),miR-106b-5p表达升高(P<0.05);miR-106b-5p antagomir组大鼠肺组织lncRNA MALAT1表达无显著差异(P>0.05),TLR4 mRNA表达升高(P<0.05),miR-106b-5p表达降低(P<0.05);阴性对照组大鼠肺组织lncRNA MALAT1、miR-106b-5p及TLR4 mRNA表达无显著差异(P>0.05)。与lncRNA MALAT1敲低组比较,lncRNA MALAT1敲低+miR-106b-5p antagomir组大鼠肺组织lncRNA MALAT1表达无显著差异(P>0.05),TLR4 mRNA表达升高(P<0.05),miR-106b-5p表达降低(P<0.05)。见表3。

表3 各组大鼠肺组织lncRNA MALAT1、miR-106b-5p及TLR4 mRNA相对表达
2.3 各组大鼠肺组织炎性损伤及BALF中白细胞计数检测结果
对照组肺组织没有发生炎性损伤。模型组大鼠肺泡结构受损且肺泡壁变厚,肺泡融合、数目减少,气管黏膜充血、水肿,肺组织发生大量炎性细胞浸润等炎性损伤,与对照组比较,模型组大鼠肺组织Holfbauer评分及BALF中白细胞计数升高(P<0.05)。与模型组比较,lncRNA MALAT1敲低组大鼠肺组织肺炎性损伤减轻,Holfbauer评分及BALF中白细胞计数降低(P<0.05);miR-106b-5p antagomir组大鼠肺组织肺炎性损伤加重,Holfbauer评分及BALF中白细胞计数升高(P<0.05);阴性对照组大鼠肺组织肺炎性损伤无明显变化,Holfbauer评分及BALF中白细胞计数无显著差异(P>0.05)。与lncRNA MALAT1敲低组比较,lncRNA MALAT1敲低+miR-106b-5p antagomir组大鼠肺组织肺炎性损伤加重,Holfbauer评分及BALF中白细胞计数升高(P<0.05)。见图1、表4。

图1 HE染色检测各组大鼠肺组织炎性损伤(×200)

表4 各组大鼠肺组织Holfbauer评分及BALF中白细胞计数
2.4 各组大鼠BALF中炎症相关因子TNF-α、PGE2、IL-10水平检测结果
与对照组比较,模型组大鼠BALF中IL-10水平降低(P<0.05),TNF-α、PGE2水平升高(P<0.05)。与模型组比较,lncRNA MALAT1敲低组大鼠BALF中IL-10水平升高(P<0.05),TNF-α、PGE2水平降低(P<0.05);miR-106b-5p antagomir组大鼠BALF中IL-10水平降低(P<0.05),TNF-α、PGE2水平升高(P<0.05);阴性对照组大鼠BALF中IL-10、TNF-α、PGE2水平无显著差异(P>0.05)。与lncRNA MALAT1敲低组比较,lncRNA MALAT1敲低+miR-106b-5p antagomir组大鼠BALF中IL-10水平降低(P<0.05),TNF-α、PGE2水平升高(P<0.05)。见表5。

表5 各组大鼠BALF中炎症相关因子TNF-α、PGE2、IL-10水平
2.5 各组大鼠血清炎症相关因子TNF-α、PGE2、IL-10水平检测结果
与对照组比较,模型组大鼠血清IL-10水平降低(P<0.05),TNF-α、PGE2水平升高(P<0.05)。与模型组比较,lncRNA MALAT1敲低组大鼠血清IL-10水平升高(P<0.05),TNF-α、PGE2水平降低(P<0.05);miR-106b-5p antagomir组大鼠血清IL-10水平降低(P<0.05),TNF-α、PGE2水平升高(P<0.05);阴性对照组大鼠血清IL-10、TNF-α、PGE2水平无显著差异(P>0.05)。与lncRNA MALAT1敲低组比较,lncRNA MALAT1敲低+miR-106b-5p antagomir组大鼠血清IL-10水平降低(P<0.05),TNF-α、PGE2水平升高(P<0.05)。见表6。

表6 各组大鼠血清炎症相关因子TNF-α、PGE2、IL-10水平
2.6 各组L2细胞中lncRNA MALAT1对miR-106b-5p、miR-106b-5p对TLR4的靶向调节
通过Starbase数据库查询到lncRNA MALAT1与miR-106b-5p之间存在结合位点,见图2。与野生miR-106b-5p+空载组比较,野生miR-106b-5p+lncRNA MALAT1过表达组相对荧光素酶活性显著降低(P<0.05);突变miR-106b-5p+空载组与突变miR-106b-5p+lncRNA MALAT1过表达组间相对荧光素酶活性无显著差异(P>0.05)。表7。
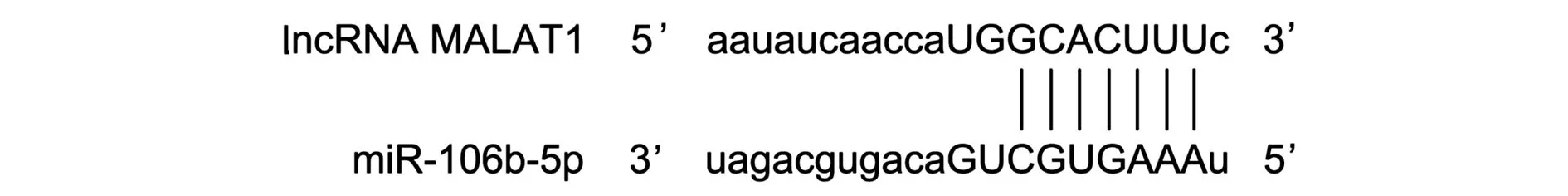
图2 通过Starbase数据库查询到lncRNA MALAT1与miR-106b-5p之间的结合位点
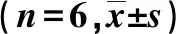
表7 各组相对荧光素酶活性值
查询Starbase数据库得知miR-106b-5p与TLR4之间存在结合位点,见图3。与野生TLR4+miR-106b-5p mimics阴性对照组比较,野生TLR4+miR-106b-5p mimics组相对荧光素酶活性显著降低(P<0.05);突变TLR4+miR-106b-5p mimics阴性对照组与突变TLR4+miR-106b-5p mimics组之间相对荧光素酶活性无显著差异(P>0.05)。表8。
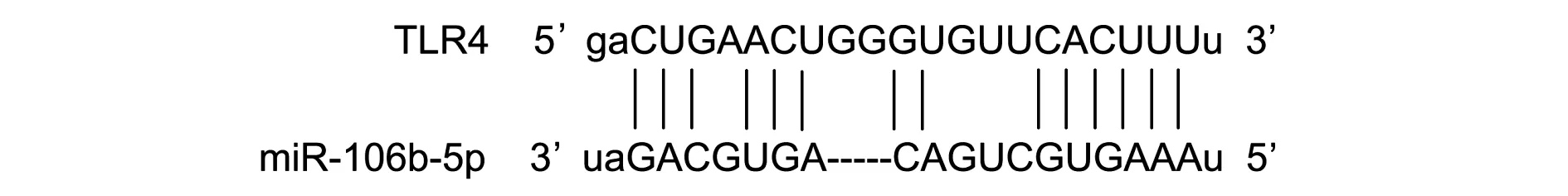
图3 通过Starbase数据库查询到miR-106b-5p与TLR4 之间的结合位点
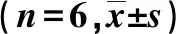
表8 各组相对荧光素酶活性值
3 讨论
长期吸烟是COPD发病的最主要因素,环境污染导致有害物质进入气管和肺部也可促进COPD发生,COPD作为一种慢性炎症疾病,多采用激素类药物治疗,不适合患者长期应用[12-13]。本文以气管滴注脂多糖溶液并联合烟熏法构建COPD模型大鼠,结果显示,造模大鼠BALF和血清中促炎因子TNF-α、PGE2水平升高,同时其中抗炎因子IL-10水平降低,引发大鼠体内炎症,造成大鼠BALF中白细胞计数增加,肺组织发生炎性损伤,导致大鼠肺功能指标FVC、PEF降低,同时Ri、VT升高,最终致使大鼠出现精神萎靡、呼吸困难、咳嗽喘息等症状,提示COPD模型建立成功。
lncRNA MALAT1是一种可介导组织细胞增殖、分化、损伤及炎症的非编码RNA,在COPD患者中高表达,并与其疾病分期、促炎因子TNF-α与IL-1β、IL-6水平等呈正相关[14],敲低lncRNA MALAT1可抑制巨噬细胞炎症[3],并增强体外COPD模型细胞活力[4]。本研究结果显示,以lncRNA MALAT1 siRNA质粒处理COPD大鼠,可降低Ri、VT、肺组织lncRNA MALAT1及TLR4 mRNA表达、Holfbauer评分、BALF中白细胞计数、BALF和血清中TNF-α、PGE2水平,升高FVC、PEF、肺组织miR-106b-5p表达、BALF和血清中IL-10水平,并减轻肺组织肺炎性损伤,表明敲低lncRNA MALAT1可减少促炎因子TNF-α、PGE2表达,增加抗炎因子IL-10表达,抑制COPD大鼠体内炎症,减轻肺组织炎性损伤,改善肺功能,揭示下调lncRNA MALAT1对COPD具有治疗作用。
微小RNA可调控炎性细胞因子表达,并参与调节COPD引发的气道组织损伤和肺部炎症[14-15],miR-106b-5p作为一种微小RNA,可参与介导COPD的发生发展[6],在过敏性鼻炎细胞模型中表达下调,过表达miR-106b-5p可抑制其模型细胞炎症和凋亡[16],并可抑制转化生长因子β1诱导的支气管上皮细胞纤维化[17],TLR4是其下游作用靶点,可被其下调,进而通过抑制炎症减轻氧化低密度脂蛋白引起的内皮功能障碍[8],COPD患者肺部感染会引发TLR4上调,导致患者预后不佳[18],抑制TLR4表达可减少炎性细胞因子释放,并促进抗炎因子释放,进而通过抑制炎症减轻COPD引发的肺功能损伤[19],因此miR-106b-5p/TLR4可作为COPD的潜在治疗靶点,研究显示,lncRNA MALAT1可通过吸收miR-106b-5p增强大肠癌细胞侵袭转移[5],并通过激活TLR4信号上调促炎因子IL-6和TNF-α的表达,促进急性胰腺炎中巨噬细胞的M1极化[20],由此预知调节miR-106b-5p/TLR4可能是敲低lncRNA MALAT1减轻COPD大鼠肺组织炎性损伤的作用机制。本文结果显示,以miR-106b-5p antagomir处理COPD大鼠,可加重大鼠肺组织肺炎性损伤,并降低FVC、PEF、肺组织miR-106b-5p表达、BALF和血清中IL-10水平,升高Ri、VT、肺组织TLR4 mRNA表达、Holfbauer评分、BALF中白细胞计数、BALF和血清中TNF-α、PGE2水平,表明抑制miR-106b-5p表达可促进炎症进展,加重COPD大鼠肺组织肺炎性损伤及肺功能障碍,双荧光素酶报告基因实验证实lncRNA MALAT1可靶向下调L2细胞中miR-106b-5p,且miR-106b-5p可靶向下调TLR4表达,lncRNA MALAT1可通过靶向下调miR-106b-5p而促进TLR4表达,从而促使COPD发生,敲低lncRNA MALAT1可升高肺组织miR-106b-5p表达,降低TLR4 mRNA表达,表明miR-106b-5p/TLR4参与敲低lncRNA MALAT1对COPD大鼠肺组织炎性损伤的减轻过程。以lncRNA MALAT1 siRNA质粒和miR-106b-5p antagomir联合处理COPD大鼠,相比lncRNA MALAT1 siRNA质粒单独处理,可加重COPD大鼠肺组织肺炎性损伤,并降低大鼠FVC、PEF、肺组织miR-106b-5p表达、BALF和血清中IL-10水平,升高Ri、VT、肺组织lncRNA MALAT1及TLR4 mRNA表达、Holfbauer评分、BALF中白细胞计数、BALF和血清中TNF-α、PGE2水平,表明miR-106b-5p antagomir可减弱敲低lncRNA MALAT1对COPD大鼠促炎因子表达的降低和抗炎因子表达的增强作用,拮抗其抗炎效果,最终逆转其对COPD大鼠肺组织炎性损伤及肺功能的改善作用,提示敲低lncRNA MALAT1减轻COPD大鼠肺组织炎性损伤是通过上调miR-106b-5p实现的。
总之,lncRNA MALAT1可通过降低miR-106b-5p表达而上调TLR4,从而促使COPD发生发展。敲除lncRNA MALAT1可通过上调miR-106b-5p而降低TLR4表达,从而阻止大鼠体内炎症发生发展,减轻其肺组织炎性损伤,改善其肺功能,调节miR-106b-5p/TLR4可能是其分子机制。
