复方苦参注射液对化疗后肺癌患者免疫应答、胸腔积液及炎症因子的影响
2023-11-25张晶晶尚春芳
娄 婷,张晶晶,尚春芳
(山西省运城市盐湖区人民医院,山西 运城 044000)
肺癌是临床常见的恶性肿瘤,以非小细胞肺癌较为常见。多数患者早期无特殊临床症状,确诊时已进展至中晚期,晚期肺癌患者易产生癌性胸腔积液,临床表现为食欲不振、咳嗽咳痰、呼吸困难、胸部疼痛等[1]。化疗是晚期肿瘤患者主要的治疗方式,但化疗过程会损伤患者的免疫应答,产生较多不良反应,需给予患者辅助治疗措施以减轻不良反应。肺癌属中医“癌病”“咯血”“肺壅”等范畴,患者病势缠绵,正气已虚,加上化疗损伤,导致患者脾胃受损,兼有忧思过度,以上均不利于患者康复。复方苦参注射液是中药制剂,具有健脾益胃、解毒利湿、宁心安神的功效,还可抗癌[2]。本研究观察复方苦参注射液对化疗后肺癌患者免疫应答、胸腔积液及炎症因子的影响,现报道如下。
1 临床资料
1.1 一般资料 选取2020年12月至2021年12月在运城市盐湖区人民医院治疗的肺癌患者90例,采用随机数字表法分为对照组和观察组,每组45例。对照组男35例,女10 例;年龄52~79 岁,平均(65.32±2.02)岁;平均病程(4.31±1.01)年。观察组男34例,女11例;年龄51~78岁,平均年龄(65.53±2.15)岁;平均病程(4.37±1.05)年。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准通过(审批号:20TY-75)。
1.2 诊断标准
(1)西医诊断标准 符合《内科学》中非小细胞肺癌的诊断标准[3]。患者可出现咳嗽、痰中带血或咯血、气短或喘鸣、消瘦等症状,中后期可有胸痛、声音嘶哑、吞咽困难、头痛、恶心呕吐、骨痛、腹痛、黄疸、食欲下降、体质量减轻等症状;通过痰液细胞学、支气管镜检查、CT、MRI、肺组织活检、纵膈镜、支气管镜等检查证实为肺癌,RT-PCR检查证实为非小细胞肺癌。
(2)中医诊断标准 符合肺癌肺脾气虚证的诊断标准[4]。证见咳嗽,痰白稀,胸闷气短,神疲乏力,腹胀纳呆,水肿便溏;舌质淡,边有齿痕,苔白或白腻,脉沉细。
1.3 纳入标准 符合上述诊断标准;非小细胞肺癌晚期患者;年龄50~80岁;TNM 分期为Ⅲ~Ⅳ级;合并胸腔积液者;Karnofsky评分在40 分以上;预计生存期在3个月及以上;患者及家属签署知情同意书。
1.4 排除标准 合并免疫系统疾病、全身感染、其他恶性肿瘤、脏器功能不全者;妊娠期或哺乳期女性;对复方苦参注射液过敏者;无法耐受胸腔内灌注化疗者;转移性肺癌者;其他原因导致胸腔积液者;既往接受其他相关治疗者;精神障碍者;依从性差者。
2 治疗方法
2.1 对照组 给予患者胸腔内灌注化疗。采用B 超定位胸腔积液,对胸腔积液量进行评估,给予患者局部浸润麻醉,在超声引导下行胸腔穿刺术,间断性引流胸腔积液,引流完成后,冲洗胸腔,给予灌注化疗,化疗前给予止吐处理,将顺铂(齐鲁制药有限公司,国药准字H37021358)以80 mg/m2剂量加入0.9%氯化钠注射液50 m L中进行胸腔内灌注化疗,嘱患者30 min后改变体位1次,有利于使胸膜充分接触药物,每4 d给药1次。连续治疗4周。
2.2 观察组 在对照组基础上给予复方苦参注射液治疗,将复方苦参注射液(山西振东制药股份有限公司,国药准字Z14021231)20 m L 加入0.9%氯化钠注射液200 m L中,稀释后静脉滴注,每日1次。连续治疗4周。
3 疗效观察
3.1 观察指标 ①炎症因子水平。治疗前后抽取患者空腹静脉血5 m L,采用酶联免疫吸附法(试剂盒由深圳市科润达生物工程有限公司提供)检测患者可溶性血管细胞黏附分子-1(sVCAM-1)、细胞角蛋白19降解片段-2G2(CK19-2G2)、干扰素-γ(IFN-γ)、肿瘤相关细胞角蛋白19片段(CYFRA21-1)、高迁移率族蛋白B1(HMGB1)、生长分化因子-15(GDF-15)、鳞状细胞癌抗原(SCC-Ag)水平。采用流式细胞仪(常州必达科生物科技有限公司,苏械注准:20192221063)检测患者外周血辅助性T 细胞(Th)1/Th2 值。②胸腔积液。分别于治疗前和治疗第1、4周后采用彩色多普勒超声诊断仪检测两组患者胸腔积液量。③生命质量测定量表评分。治疗前后给予癌症患者生命质量测定量表(EORTC QLQ-C30)评价,该量表包含躯体功能、情绪功能、社会功能、疲倦情况和总健康状况,总分100分,分数越高表明患者生活质量越好。④不良反应。记录治疗过程中血小板计数减少、发热、乏力、恶心、呕吐等不良反应发生情况。
3.2 疗效评定标准 完全缓解:患者胸痛、纳差、呼吸困难等临床症状消失,胸腔积液全部吸收;缓解:患者胸痛、纳差、呼吸困难等临床症状明显改善,胸腔积液吸收50%以上;稳定:患者胸痛、纳差、呼吸困难等临床症状改善,胸腔积液吸收25%~50%;无效:患者胸痛、纳差、呼吸困难等临床症状无改善,胸腔积液吸收25%以下。总有效率=(完全缓解例数+缓解例数+稳定例数)/总例数×100%。
3.3 统计学方法 采用SPSS 23.0统计软件处理数据。计量资料以均数±标准差(±s)表示,采用t检验;计数资料以百分率(%)表示,采用χ2检验。P<0.05为差异有统计学意义。
3.4 结果
(1)sVCAM-1、IFN-γ、HMGB1、Th1/Th2水平比较治疗前,两组患者sVCAM-1、IFN-γ、HMGB1 水平及Th1/Th2值比较,差异无统计学意义(P>0.05)。治疗后,两组患者sVCAM-1、HMGB1 水平均低于治疗前(P<0.05),且观察组均低于对照组(P<0.05);两组患者IFN-γ水平及Th1/Th2值均高于治疗前(P<0.05),且观察组均高于对照组(P<0.05)。见表1。
表1 两组化疗后肺癌患者治疗前后可溶性血管细胞黏附分子-1、干扰素-γ、高迁移率族蛋白B1水平及Th1/Th2值比较(±s)
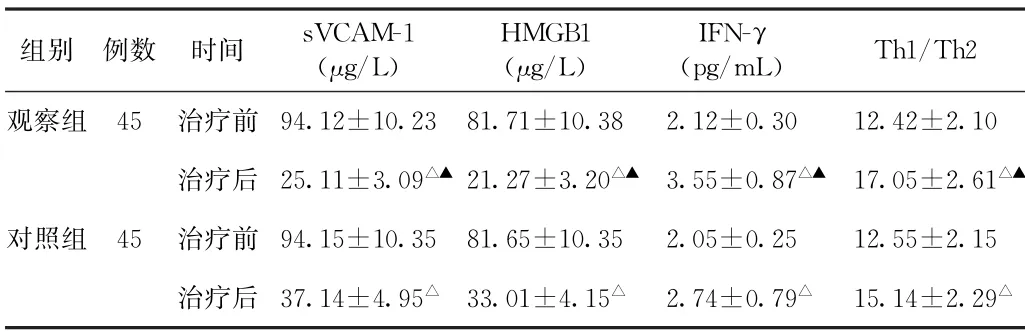
表1 两组化疗后肺癌患者治疗前后可溶性血管细胞黏附分子-1、干扰素-γ、高迁移率族蛋白B1水平及Th1/Th2值比较(±s)
注:1.sVCAM-1,可溶性血管细胞黏附分子-1;IFN-γ,干扰素-γ;HMGB1,高迁移率族蛋白B1。2.与本组治疗前比较,△P<0.05;与对照组治疗后比较,▲P<0.05。
组别 例数 时间sVCAM-1(μg/L)HMGB1(μg/L)IFN-γ(pg/mL)Th1/Th2观察组 45 治疗前94.12±10.23 81.71±10.38 2.12±0.30 12.42±2.10治疗后25.11±3.09△▲21.27±3.20△▲ 3.55±0.87△▲ 17.05±2.61△▲对照组 45 治疗前94.15±10.35 81.65±10.35 2.05±0.25 12.55±2.15治疗后37.14±4.95△ 33.01±4.15△ 2.74±0.79△ 15.14±2.29△
(2)CK19-2G2、CYFRA21-1、SCC-Ag、GDF-15水平比较 治疗前,两组患者CK19-2G2、CYFRA21-1、SCC-Ag、GDF-15水平比较,差异无统计学意义(P>0.05)。治疗后,两组患者CK19-2G2、CYFRA21-1、SCC-Ag、GDF-15水平均低于治疗前(P<0.05),且观察组均低于对照组(P<0.05)。见表2。
表2 两组化疗后肺癌患者治疗前后细胞角蛋白19降解片段-2G2、肿瘤相关细胞角蛋白19片段、生长分化因子-15水平比较(±s)
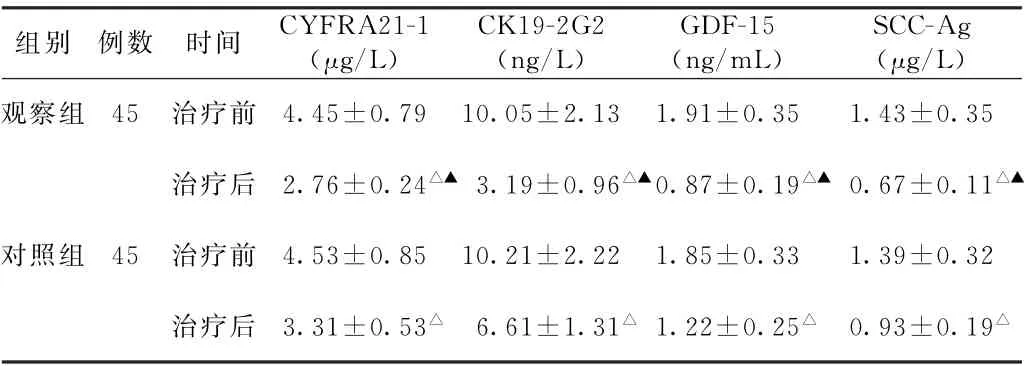
表2 两组化疗后肺癌患者治疗前后细胞角蛋白19降解片段-2G2、肿瘤相关细胞角蛋白19片段、生长分化因子-15水平比较(±s)
注:1.CK19-2G2,细胞角蛋白19降解片段-2G2;CYFRA21-1,肿瘤相关细胞角蛋白19片段;GDF-15,生长分化因子-15;SCC-Ag,鳞状细胞癌抗原。2.与本组治疗前比较,△P<0.05;与对照组治疗后比较,▲P<0.05。
组别 例数 时间 CYFRA21-1(μg/L)CK19-2G2(ng/L)GDF-15(ng/m L)SCC-Ag(μg/L)观察组 45 治疗前 4.45±0.79 10.05±2.13 1.91±0.35 1.43±0.35治疗后 2.76±0.24△▲3.19±0.96△▲0.87±0.19△▲0.67±0.11△▲对照组 45 治疗前 4.53±0.85 10.21±2.22 1.85±0.33 1.39±0.32治疗后 3.31±0.53△ 6.61±1.31△1.22±0.25△ 0.93±0.19△
(3)胸腔积液量比较 治疗前,两组患者胸腔积液量比较,差异无统计学意义(P>0.05)。治疗第1、4周,两组患者胸腔积液量均少于治疗前(P<0.05),且观察组少于对照组(P<0.05)。见表3。
表3 两组化疗后肺癌患者治疗前和治疗第1、4周胸腔积液量比较(mL,±s)
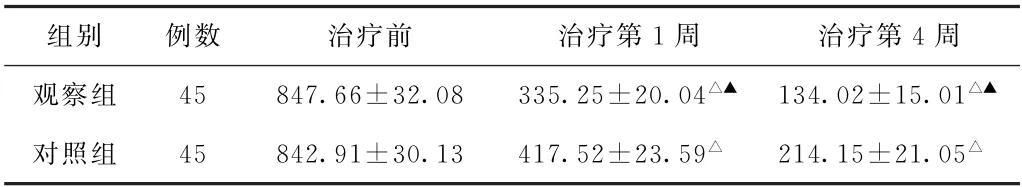
表3 两组化疗后肺癌患者治疗前和治疗第1、4周胸腔积液量比较(mL,±s)
注:与本组治疗前比较,△P<0.05;与对照组治疗后比较,▲P<0.05。
组别例数治疗前治疗第1周治疗第4周观察组45 847.66±32.08 335.25±20.04△▲ 134.02±15.01△▲对照组45 842.91±30.13 417.52±23.59△214.15±21.05△
(4)EORTC QLQ-C30 评分比较 治疗前,两组患者EORTC QLQ-C30评分比较,差异无统计学意义(P>0.05)。治疗后,两组患者EORTC QLQ-C30评分均高于治疗前(P<0.05),且观察组高于对照组(P<0.05)。见表4。
表4 两组化疗后肺癌患者治疗前后癌症患者生命质量测定量表评分比较(分,±s)

表4 两组化疗后肺癌患者治疗前后癌症患者生命质量测定量表评分比较(分,±s)
注:1.EORTC QLQ-C30,癌症患者生命质量测定量表。2.与本组治疗前比较,△P<0.05;与对照组治疗后比较,▲P<0.05。
组别例数治疗前评分治疗后评分观察组45 55.55±5.43 71.46±7.26△▲对照组45 55.38±5.25 64.76±6.12△
(5)临床疗效比较 观察组总有效率为91.11%(41/45),对照组总有效率为73.33%(33/45),观察组总有效率高于对照组(P<0.05)。见表5。
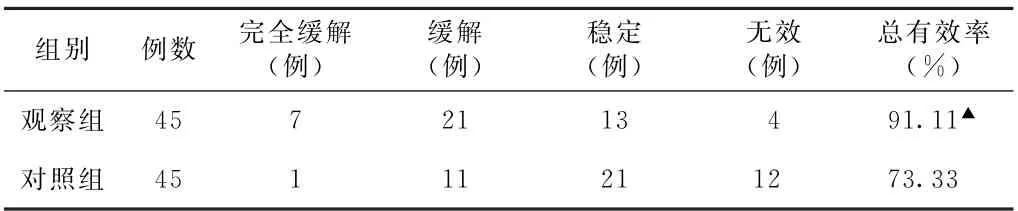
表5 两组化疗后肺癌患者治疗后临床疗效比较
(6)不良反应发生率比较 观察组不良反应发生率为28.89%(13/45),对照组不良反应发生率为62.22%(28/45),观察组不良反应发生率低于对照组(P<0.05)。见表6。
4 讨论
非小细胞肺癌发病因素复杂,包括吸烟、职业致癌因子、空气污染、饮食、遗传等[5]。胸腔积液是肺癌常见的并发症,发病与壁层胸膜淋巴管引流障碍密切相关,肺癌细胞可经淋巴管转移,阻碍淋巴回流,同时肺癌肿块压迫淋巴管,肺癌细胞浸润转移至壁层胸膜,产生胸腔积液[6-7]。
肺癌属于中医“癌病”“咯血”“肺壅”等范畴,患者病势缠绵,正气虚弱,无以抵御外邪侵袭。脾为生痰之源,肺为贮痰之器,若化疗药物损伤患者脾胃,则脾胃运化失司,宣降失调,水湿内停,痰湿聚集,气血凝滞,加重病情。复方苦参注射液是中药制剂,其主要成分为苦参、白土苓,苦参清热燥湿、平喘祛痰、解毒、安神,白土苓健脾燥湿、利水消肿、宁心,二者合用,具有健脾、清热利湿、凉血解毒、宁心安神的功效。研究表示,复方苦参注射液具有调节机体免疫作用,可抗炎镇痛,与抗癌药物同用,具有减毒增效作用[8]。
HMGB1是一种核DNA 结合蛋白,可促进多种细胞因子释放,诱发炎性反应。s VCAM-1 表达于血管内皮细胞,可介导内皮细胞、白细胞、淋巴细胞的黏附作用,加重机体炎性反应。Th1/Th2 是免疫应答指标,在恶性肿瘤患者中呈降低状态,IFN-γ 由Th1 细胞分泌,参与Th1/Th2 免疫应答。本次研究结果表明,观察组sVCAM-1、HMGB1水平低于对照组(P<0.05),IFN-γ 水平、Th1/Th2 值均高于对照组(P<0.05),说明复方苦参注射液辅助化疗后肺癌患者,可改善患者免疫应答状态,降低炎症因子水平;观察组CYFRA21-1、CK19-2G2、GDF-15、SCC-Ag水平均低于对照组(P<0.05),胸腔积液量少于对照组(P<0.05),EORTC QLQ-C30评分高于对照组(P<0.05),总有效率高于对照组(P<0.05),不良反应发生率低于对照组(P<0.05),说明复方苦参注射液辅助化疗后肺癌患者,可降低肿瘤标志物水平,减少胸腔积液量,提升患者生活质量和临床疗效,减少不良反应。本次研究时间较短,无法观察患者长期疗效,病例较少,还需增加病例数验证临床效果。
