抗肿瘤药物超敏反应
2023-11-24凌晓静魏继福
凌晓静,魏继福
作者单位:210009 南京,江苏省肿瘤医院,江苏省肿瘤防治研究所,南京医科大学附属肿瘤医院药学部
全球每年估计有1 410万肿瘤新发病例以及820万肿瘤死亡病例,致使肿瘤已经成为全球第二大死亡原因[1]。目前肿瘤主要的治疗措施包括手术切除、药物治疗(可分为化学治疗药物、生物治疗药物)、放射治疗等,其中手术治疗是切除恶性实体瘤的有效措施,尤其是早期的恶性肿瘤[2]。随着新型抗肿瘤药物不断研发,使得基于药物的抗肿瘤治疗发展迅速,组合方式也更加多样,如免疫检查点抑制剂等的应用,为部分晚期不能行手术、放射治疗的肿瘤患者提供了治疗选择[3]。目前临床上常用的抗肿瘤药物主要分为化学治疗药物[4-5]、激素类[6]、小分子靶向药物(如酪氨酸激酶抑制剂)[7]、大分子靶向药物(抗体类)[8]以及免疫治疗药物(如免疫检查点抑制剂[9]、嵌合抗原受体T细胞免疫疗法[10])等。
抗肿瘤药物的不良反应通常涉及全身各个脏器,其中常见的不良反应包括骨髓抑制、心脏毒性和消化道毒性等[11],这些不良反应如若不及时规范处理可能危及生命也可能导致抗肿瘤治疗中断,因此在抗肿瘤药物治疗过程中需要做好不良反应的监测以期达到疗效、毒性的平衡。相比于上述常见的不良反应,抗肿瘤药物引发的超敏反应的发生率较低,然而考虑到其一旦发生可能危及生命,而且也可能导致患者错失最佳或一线的治疗方案[7,12-14],并影响抗肿瘤药物是否能继续被使用,因此在抗肿瘤药物治疗过程中重视并监测可能发生的超敏反应,并及时妥善处理也非常有必要[15]。本综述将概述常见抗肿瘤药物引起的超敏反应的临床表现、机制、诊断方法以及处理措施,以期抗肿瘤药物引起的超敏反应能受到重视和研究。
1 抗肿瘤药物引起的超敏反应机制
根据经典免疫学,药物引起的超敏反应可分为Ⅰ型、Ⅱ型、Ⅲ型以及Ⅳ型[16],此外尚有非过敏性药物超敏反应(nonallergic drug hypersensitivity reactions)以及药物代谢动力学、药物效应动力学因素引起的超敏反应[12]。根据经典免疫学进行分类的超敏反应包括:Ⅰ型超敏反应也即通常所说的过敏反应,其是由IgE介导,致敏物质首先与预先结合在肥大细胞或嗜碱性粒细胞高亲和力受体上的IgE结合并使IgE交联进而使肥大细胞或嗜碱性粒细胞被激活脱颗粒,释放组胺、白三烯等过敏性炎症介质从而产生相应的临床症状[16];Ⅱ型超敏反应是由细胞表面、细胞外基质抗原的特异性IgG或IgM与相应抗原结合后,在补体、自然杀伤细胞以及吞噬细胞的参与下,引起的以细胞溶解或组织损伤为主的病理性免疫反应[17];Ⅲ型超敏反应是由抗原和抗体结合形成中等大小的可溶性免疫复合物沉积于局部或全身多处毛细血管基底膜后激活补体,并在血小板、中性粒细胞、嗜碱性粒细胞等效应细胞参与下,引起的以充血水肿、局部坏死和中性粒细胞浸润为主要特征的炎症反应和组织损伤[18];Ⅳ型超敏反应也即迟发型超敏反应,是由受抗原刺激产生的效应T细胞介导的以单个核细胞浸润为主要特征的炎症性免疫应答,反应较慢,通常是在再次接触抗原后24~72 h出现[19]。在上述4型超敏反应中,药物引起的超敏反应通常以Ⅰ型和Ⅳ型超敏反应较为常见[12]。除了上述经典免疫学分类的超敏反应,尚有药物效应动力学相关因素引起超敏反应的药物如表皮生长因子受体(epidermal growth factor receptor,EGFR)拮抗剂西妥昔单抗(cetuximab)引起的皮肤反应,以及非过敏性药物超敏反应,其通常是指药物分子不依赖于IgE,直接激活肥大细胞或嗜碱性粒细胞表面的受体(mas-related G protein-coupled receptor X2,MRGPRX2)从而使效应细胞释放相关炎症介质(如组胺、白三烯等)从而产生相应的临床症状,如万古霉素在高浓度快速滴注时引发的红人综合征[12]。
目前抗肿瘤药物引发的超敏反应机制尚未完全阐明,仍需进一步研究。对于化学治疗药物引起的超敏反应,可分为Ⅰ型超敏反应、细胞因子释放反应、混合型超敏反应以及机制尚未明确型[20],其中是以IgE介导的Ⅰ型超敏反应为主,此外补体系统以及非免疫学机制也可能涉及[21-23]。小分子抑制剂引发的超敏反应可涉及Ⅰ、Ⅳ型超敏反应[24]。对于单克隆抗体类药物引起的超敏反应有研究将其分为5类,包括Ⅰ型超敏反应(IgE介导以及非IgE介导)、细胞因子释放反应、混合型超敏反应(Ⅰ型超敏反应/细胞因子释放反应)、Ⅲ型超敏反应以及Ⅳ型超敏反应,临床表现各异[8],其中又以Ⅰ型超敏反应(IgE介导以及非IgE介导)的发生率为最高[8]。
2 抗肿瘤药物引起的超敏反应
2.1 化学治疗药物引起的超敏反应
化学治疗药物主要可分为烷化剂、抗代谢药物、金属铂配合物、植物类、抗肿瘤抗生素以及其他类(如门冬酰胺酶)。每种化学治疗药物均有引发超敏反应的可能,严重的超敏反应会限制化学治疗药物的使用,从而影响到肿瘤患者抗肿瘤治疗方案的继续进行[23,25]。在众多化学治疗药物中,以紫杉类[26]、铂类[22,27-28]、门冬酰胺酶[29]以及鬼臼毒素类[30]引起的超敏反应较为常见(表1)。

表1 常见可引起超敏反应的化学治疗药物Table 1 Common chemotherapeutic drugs causing hypersensitivity reactions
紫杉类是一种微管蛋白抑制剂,临床上主要用于治疗乳腺癌、非小细胞肺癌、淋巴瘤以及大肠癌等[31]。超敏反应作为紫杉类常见的不良反应之一,临床表现多样主要包括荨麻疹、斑丘疹、呼吸困难、水肿以及低血压等[31]。在给予地塞米松、抗组胺药物等预处理前提下,紫杉类药物引起的超敏反应的发生率仍有10%,其中严重超敏反应的发生率在2%~5%[32]。一例诊断为人表皮生长因子受体2(human epidermal growth factor receptor 2,Her-2)阳性的左乳导管癌患者,CT扫描提示腋窝淋巴结多发性病变,淋巴结穿刺活检确定为Her-2阳性的乳腺转移癌故给予曲妥珠单抗(560 mg),环磷酰胺(1 000 mg)联合三周多西他赛(130 mg)方案进行新辅助化疗。在第二次输注多西他赛时,患者出现了手脚发痒、全身无力和胸部紧迫表现,立即停止输注后症状缓解[26]。因此,后续将新辅助化疗方案中三周多西他赛调整为每周白蛋白紫杉醇(100 mg/m2,第1、8、15天),方案中其他药物调整为曲妥珠单抗(6 mg/kg,每21天)和环磷酰胺(600 mg/m2,第1天),患者顺利完成了3周期的新辅助化疗且未出现超敏反应相关表现[26]。
化学治疗药物中另一类较容易引发超敏反应的药物为铂类配合物,铂类配合物引起的超敏反应的临床表现多样[21]。在一项针对奥沙利铂引发的超敏反应的研究中,在纳入了153例接受奥沙利铂治疗的患者中,有17例出现了以呼吸困难、喉痉挛、支气管痉挛等呼吸道症状以及荨麻疹、皮疹、瘙痒等皮肤症状为主的超敏反应相关表现,此外部分患者出现寒战、心动过速、头晕、麻木以及意识丧失等表现[27]。在17例患者中,1例患者出现了4级超敏反应通过积极给予氢化可的松(1 g)、氯苯那敏(10 mg)以及肾上腺素(1 mg)和吸氧对症支持治疗,患者症状好转[27]。此外,该项研究提示通过严格规范的预处理以及延长输注时间可能降低奥沙利铂引起超敏反应的发生风险[27]。顺铂为另一种较为常用的铂类配合物,其引起超敏反应的发生率会因为联合其他化学治疗药物或放疗而升高:当顺铂联合其他化学治疗药物时引起超敏反应的发生率在1%~20%,而当顺铂单药治疗时引起超敏反应的发生率在1%~5%[21,28,33]。在一例局部放疗(70 Gy)联合每周低剂量顺铂化疗(40 mg/m2)治疗晚期下咽部鳞状细胞癌的病例报告中,该患者在顺铂首次给药后8 d出现严重的右侧舌部和面部水肿,予地塞米松20 mg静注和苯海拉明50 mg静注,患者的症状缓解;在给药后13 d再次出现面部和舌部水肿,予地塞米松20 mg静注后减量为每天4 mg,持续5 d症状改善,后将治疗方案中每周顺铂调整为每周西妥昔单抗,在后续治疗过程中则未出现超敏反应[28]。卡铂也是临床上常用的铂类配合物,可联合紫杉醇用于卵巢癌和子宫癌的一线化疗[22]。不同于顺铂,卡铂引起超敏反应的发生率会因重复给药逐渐增加,临床表现多样可包括轻微的瘙痒和红斑、面部水肿、支气管痉挛、低血压、心动过速,甚至是危及生命的过敏性休克等[24]。在一例使用TC方案(紫杉醇180 mg/m2+卡铂AUC 5)治疗复发性子宫癌肉瘤的病例报告中,当患者进行第4周期的TC化疗时,静脉输注卡铂30 min后患者的面部和上肢发红和发热,被诊断为2级超敏反应,立即停药并予马来酸氯苯那敏改善症状,后续调整治疗方案为AP方案(阿霉素60 mg/m2+顺铂50 mg/m2)[22]。相关研究也指出当使用含铂化疗方案而患者对其中铂类药物存在超敏反应时,可通过脱敏疗法获得耐受继续使用初始药物,或者换用另一种铂类治疗方案或不含铂类的治疗方案[22]。除了紫杉类和铂类配合物,门冬酰胺酶、鬼臼毒素类也较为容易引发超敏反应[29-30]。
化学治疗药物引发的超敏反应临床表现多样,通常给予糖皮质激素、抗组胺药物等进行预处理或对症治疗,而抗肿瘤治疗方案则依据具体情况进行相应的调整,包括更换药物、调整治疗方案等。
2.2 小分子抑制剂引起的超敏反应
不同于传统的化学治疗药物,小分子抑制剂通过潜在地结合细胞外和细胞内靶标而发挥抗肿瘤作用从而减少不良反应的发生,致使小分子抑制剂目前已经成为肿瘤主要治疗药物之一[7]。小分子抑制剂通常可分为多激酶抑制剂和选择性抑制剂两种,多激酶抑制剂通过同时靶向多种细胞激酶发挥抗肿瘤活性,使用时仅需要基于组织学诊断而不需要依据患者进行个体化选择;而选择性抑制剂的靶点较少,在某些情况下,这一类小分子抑制剂可以拮抗信号通路中单一组分的活性,当临床应用时通常需要依据患者肿瘤或血液样本生物标志物的分析结果选择是否使用[7]。
小分子抑制剂常见的不良反应主要为皮肤相关不良反应,临床表现多样可包括皮疹、皮炎、湿疹,严重者可出现中毒性表皮坏死溶解症(toxic epidermal necrolysis)以及史蒂文斯-约翰逊综合征(stevens-Johnoson syndrome),然而上述两种不良反应比较罕见[34]。在众多的小分子抑制剂中,临床上以靶向EGFR的小分子抑制剂最为常见,其引起的皮肤相关不良反应的机制可能包括:EGFR不仅在肿瘤细胞表面表达,在皮肤及其附属结构中同样大量表达。因此靶向EGFR的小分子抑制剂除了发挥抗肿瘤效应外,可以通过影响RAS/RAF/MEK/ERK,PI3K/AKT以及JAK/STAT信号通路干扰角质细胞增殖、分化、迁移以及凋亡等进而破坏皮肤屏障,也能够通过上调促炎因子、趋化募集巨噬细胞、中性粒细胞引起炎症反应;此外,肥大细胞激活脱颗粒在小分子抑制剂引起皮肤相关不良反应中可能也发挥一定作用;基因多态性以及药物代谢动力学因素也可能参与靶向EGFR小分子抑制剂引起的皮肤相关不良反应[34],然而确切的机制仍有待进一步阐明。由上述可知,Ⅰ型以及Ⅳ型超敏反应在靶向EGFR小分子抑制剂介导的皮肤相关不良反应中发挥一定的作用。目前,小分子抑制剂引起的皮肤相关不良反应主要使用中高效的糖皮质激素、抗菌药物(外用抗菌药物包括克林霉素、甲硝唑等;全身使用抗菌药物包括口服四环素类、头孢菌素类等)等进行对症处理[35]。
由此可知,小分子抑制剂引起的超敏反应可涉及Ⅰ、Ⅳ型超敏反应,是否涉及其他类型仍需要进一步研究。考虑到小分子抑制剂目前在临床上被广泛使用,故在使用期间监测其可能引发的超敏反应非常有必要。
2.3 抗体类药物引起的超敏反应
抗体类药物目前作为抗肿瘤治疗的另一种主要药物,相比于小分子抑制剂其具有靶向性强、半衰期长以及靶标通常位于细胞表面等特点,因为其分子量大,所以临床应用时通常需要静脉给药或皮下给药[8-9,36]。
西妥昔单抗为靶向EGFR的人鼠嵌合IgG1单克隆抗体,主要用于KRAS基因野生型的转移性结直肠癌以及头颈部鳞癌的治疗[37]。西妥昔单抗引发的严重超敏反应的发生率通常在3%左右,而在美国北卡罗来纳州和田纳西州接受西妥昔单抗治疗的患者中严重超敏反应的发生率高达22%[38]。西妥昔单抗引发的超敏反应一般在首次给药数分钟内发生,相关研究建议在首次使用西妥昔单抗时需要密切监测患者的反应[37]。
作用于T细胞的抗CD-28的单克隆抗体TGN1412的一期临床试验研究表明,在单剂量给予TGN1412,6例受试者静脉给药后90 min内出现全身炎症反应伴促炎细胞因子如γ-干扰素(interferon-γ,IFN-γ)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白介素-10(interleukin-10,IL-10)、IL-8、IL-6、IL-4、IL-2、IL-1β以及IL-12p70大量迅速释放,并出现头痛、肌痛、恶心、腹泻、红斑、血管扩张、低血压等临床表现;输注后12~16 h,症状加重,出现肺浸润、肺损伤、肾衰竭以及弥漫性血管内凝血;输注后2 h内出现严重的淋巴细胞和单核细胞减少;立即给予强化的心肺支持治疗、透析,高剂量甲强龙以及抗IL-2受体抗体等处理,受试者症状缓解[39]。
抗程序性死亡受体-1的信迪利单抗(sintilimab)联合传统化学治疗药物用于鳞状非小细胞肺癌术后辅助治疗10 d后出现严重的表皮坏死溶解症,病情迅速进展至累及超过50%的皮肤,胸部和腹部可见大量斑丘疹,口腔黏膜产生炎症,最终皮肤损伤约占整个体表的95%,尚无肺部、胃肠道以及心脏不良反应。该患者立即静脉给予甲强龙(40 mg/d),同时给予伤口护理、营养补充和止痛药等对症支持治疗,此外,左氧氟沙星(500 mg/d)被用于治疗皮肤损伤导致的感染,经过积极治疗后患者表皮逐渐愈合,仅有轻微瘢痕[40]。
由此可见,抗体类药物引起的超敏反应机制复杂,临床表现多样且无特异性的症状或体征,因此在治疗过程中需要密切监测患者的相关表现,并结合患者的药物过敏史、药物引发超敏反应特征以及相应的实验室检查综合判断,出现相关表现时需积极处理。
3 抗肿瘤药物引起的超敏反应检测方法
详细询问患者的药物过敏史以及密切监测患者治疗过程中出现的临床表现是判断患者是否对某种药物存在超敏反应的重要依据,但是药物引发的超敏反应的临床表现缺乏特异性以及不同类型的超敏反应的临床表现有重叠[8,36],这都给诊断增加了难度。除了需要密切关注患者的临床表现,皮肤试验、体外诊断(生物标志物、嗜碱性粒细胞激发实验)以及药物激发试验等也可作为判断患者是否发生超敏反应的重要依据(图1)。
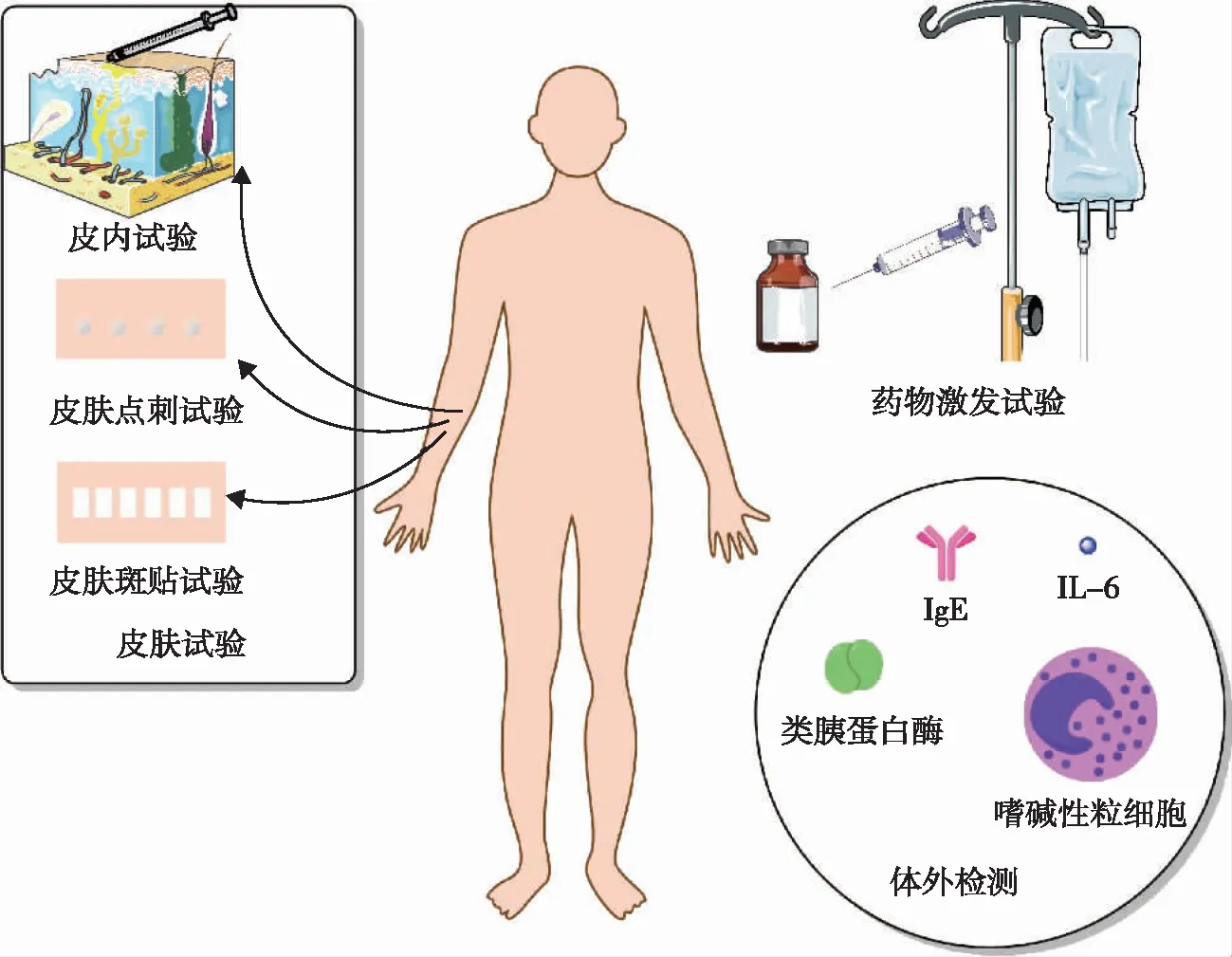
图1 药物超敏反应诊断方法Fig 1 Diagnostic methods of drug hypersensitivity reactions
皮肤试验作为一种简单方便的诊断方法,其中皮肤点刺试验、皮内试验可用于基于免疫介导的少部分化学治疗药物引起的超敏反应的诊断,主要为紫杉类、铂类配合物[20,23]。皮肤试验能够作为速发型超敏反应(也即IgE介导的Ⅰ型超敏反应)、迟发型超敏反应的诊断依据,通常速发型超敏反应可在15~20 min后进行结果判定而怀疑是迟发型超敏反应则一般在24或72 h后进行结果判定[20]。ARADyAL(Network of Asma,Reacciones Adversasa Drugs and Alergia)推荐紫杉类、铂类配合物皮肤点刺试验的浓度为:紫杉类(紫杉醇6 mg/mL,多西他赛10 mg/mL),铂类配合物(顺铂1 mg/mL,卡铂10 mg/mL,奥沙利铂5 mg/mL)[20]。如果皮肤点刺试验结果为阴性,可以继续选择将化学治疗药物梯度稀释后进行皮内试验,相应的推荐浓度为:紫杉类(紫杉醇1 mg/mL,多西他赛1、10 mg/mL),铂类配合物(顺铂0.1、1 mg/mL,卡铂1、10 mg/mL,奥沙利铂0.5、5 mg/mL)[20]。皮肤斑贴试验的相关研究较少,有研究指出皮肤斑贴试验对上述化学治疗药物引发的超敏反应的诊断作用较小[41]。欧洲过敏和临床免疫学会(European Academy of Allergy and Clinical Immunology,EAACI)推荐紫杉类、铂类配合物皮肤点刺试验、皮内试验的浓度与ARADyAL推荐的有些许差别[23]。
体外检测是对类胰蛋白酶、细胞因子(如IL-6)、总IgE以及特异性IgE等相关生物标志物的检测,也包括了基于嗜碱性粒细胞激发的功能性分析实验[8-9,20,23]。相关研究提示血清中类胰蛋白酶水平在超敏反应发生后15 min开始上升,在120 min左右达到高峰,其可作为判断是否发生超敏反应的标志物之一[20]。超敏反应过程中IL-6主要来自于淋巴细胞和巨噬细胞,一般在超敏反应发生100 min左右其血清水平可达到高峰并可维持10 h左右,被推荐作为细胞因子释放反应的生物标志物[20]。特异性IgE的检测可作为判断铂类配合物超敏反应的生物标志物[42-43]。嗜碱性粒细胞激发实验也被用于铂类配合物引发的超敏反应的诊断,其灵敏度和特异度分别为73%和100%[44]。此外,嗜碱性粒细胞激发实验也被用于脱敏治疗前的风险评估,但是仍需要进一步的研究[20]。
药物激发试验是诊断药物是否引发超敏反应的金标准,但是其可能导致超敏反应再次发生,因此需要在专业医务人员指导下并在严格的医疗监护下进行[20]。药物激发试验主要适用于以下情况:相关研究指出药物激发试验可用于评估轻、中度药物超敏反应的患者以及皮肤试验阴性的患者是否需要进行药物脱敏治疗,可以明确筛选出非超敏患者从而避免不必要的脱敏治疗[45];当存在潜在的交叉反应时或者药物过敏史不明确时,药物激发试验也可以作为药物超敏反应的患者寻求可能替代药物的一种工具[46]。药物激发试验的操作主要包括以下几点:(1)给药途径的选择:虽然激发试验时药物原则上应该采取先前相同的方式给药,但是如果可以时应首选口服,因为相比较于肠外途径口服吸收较慢,发生超敏性不良反应时能够及时进行处理。(2)激发药物的选择:通常使用商用制剂,同时考虑活性成分以及各辅料成分。药物联合使用或是复方制剂时,应按照单一化合物单独测定。(3)激发药物剂量以及给药间隔:需要结合患者自身情况综合考虑。一般来说,应该从低剂量开始,逐渐增加剂量直至出现第一个明确症状则立即停止。如果没有出现症状,则必须达到该药物的最大单次剂量,并且需要给予规定的每日剂量。两次给药的时间间隔至少为30 min,但许多药物和特定情况可能需要延长给药间隔。(4)在超敏反应发生后,至少需要经过5个药物消除半衰期才可进行药物激发试验,以保证体内药物被完全消除[46]。药物激发试验如果产生与先前发生超敏反应时相同的表现就可以认为药物激发试验阳性[46]。
4 快速药物脱敏治疗

在化学治疗药物、单克隆抗体类药物抗肿瘤治疗期间出现超敏反应时通常会停止使用该药物,通过更换药物品种或者选择其他的药物治疗方案来避免超敏反应的发生,但是替代药物可能耐受性较差或与首选药物相比疗效较差,然而进一步使用首选药物可能会在再次接触时引发严重的、甚至致命的超敏反应[8,36]。快速药物脱敏是一种用于在数小时内暂时改变患者对药物免疫反应的技术[49]。当这些患者有潜在的危及生命的慢性疾病,如肿瘤、炎症性疾病或急性感染,而相关药物是最有效、最经济或最安全时,快速药物脱敏可以继续维持一线治疗方案不影响后续治疗[36,49]。最近,世界变态反应组织药物过敏委员会已经制定实施静脉快速药物脱敏的标准操作流程[49]。以12步经静脉的单克隆抗体药物脱敏方案为例:首先配置3个不同浓度的单克隆抗体药物溶液。溶液1为1/100稀释的溶液,用于静脉快速药物脱敏的1~4步给药;溶液2为1/10稀释的溶液,用于静脉快速药物脱敏的5~8步给药;溶液3(全浓度)通过从总目标剂量减去步骤1至8中给药的累积剂量计算。每一步给药剂量相比于前一步给药剂量增加2~2.5倍。每15 min输注速率提高一倍,除了最后一步,直到达到总目标剂量[8]。快速药物脱敏疗法在化学治疗药物[14,25,50]、单克隆抗体类药物[8]引起的超敏反应中已经被广泛研究并且取得较为满意的效果。
5 结论
抗肿瘤药物引发的超敏反应可能会影响抗肿瘤药物的选择、导致剂量的调整甚至治疗方案中止从而影响抗肿瘤治疗。目前主要采用糖皮质激素、抗组胺药物等进行预处理以及对症治疗;对于危及生命的超敏反应如过敏性休克应首选肾上腺素,并同时积极给予补液、吸氧以及糖皮质激素等进行抗休克治疗,维护好生命体征。快速脱敏治疗研究虽然已经取得了较大的进展,但是因其操作复杂、专业人员缺乏等致使其在临床应用仍较少。总而言之,需要深入研究抗肿瘤药物引发超敏反应的机制,并在此基础上筛选灵敏度高、特异性强的诊断标志物,结合临床实践经验制定标准化的干预措施。